抗独特型抗体在半抗原免疫检测中的应用
杜凯 , 张卓玲 , 高莉 , 何海华 , 李婷华 , 饶微
深圳市新产业生物医学工程股份有限公司,广东 深圳 518118
半抗原是一类由于自身分子量过小而无法刺激免疫应答,必须偶联载体蛋白才能刺激机体产生免疫应答的小分子,这类小分子的检测可以广泛应用于多种领域。例如,甾体激素和甲状腺激素半抗原被广泛用于临床诊断[1];在食品安全和环境保护领域,需要检测水体、植物和微生物中的天然毒素、人工合成的农药和兽药等半抗原[2-3],这些方面的应用都迫切需要一种能快速准确检测半抗原且对检测人员和检测环境要求低的方法。相对于色谱等传统检测手段,免疫检测更契合这些需求。由于半抗原分子量小(一般<1000 Da),通常缺少抗体结合的多个表位,因此半抗原的免疫检测存在固有的局限性,限制了半抗原免疫检测的分析模式[4-5]。目前,半抗原的主流检测方法为竞争法,该方法需要将半抗原与载体蛋白相偶联再用于包被或标记,其中涉及复杂的化学偶联过程会导致批间变异难以控制,这也是导致半抗原免疫检测一致性差的主要因素[6-7]。同时,有些半抗原缺少可用于化学偶联的官能团,必须改变原始半抗原的结构,引入合适的化学基团,但这种改变会影响半抗原的免疫反应性。此外,在毒素免疫检测试剂中需要用到具有毒性的偶联物或标准品,这会给用户、制造商和环境带来较大的安全风险。因此,用表位模拟试剂(epitope mimicking reagents)替代半抗原及其偶联物具有非常重要的意义与价值。
1 抗独特型抗体的基本概念及其背景
抗独特型抗体(anti-idiotype antibody,Ab2)指针对第一抗体(Ab1)分子可变区的独特位(idiotope)产生的特异性抗体,独特位即免疫球蛋白高变区上的单个抗原表位。Ab2可以分为3种亚型:Ab2α、Ab2β和Ab2γ[8]。其中,Ab2α识别抗体可变区的独特位,该独特位与互补位(paratope)是相互分开的,因此Ab2α不会阻断抗原结合;Ab2β则结合互补位,直接阻断抗原的结合;Ab2γ的结合位置位于互补位或互补位附近,可能会因空间位阻干扰抗原结合(图1)。外位抗体(epibody)和抗伴型抗体(anti-metatype antibody)是另外2种类型的Ab2,外位抗体既可以结合抗原表位,也可以结合Ab1的独特位[9],而抗伴型抗体只结合半抗原和Ab1形成的复合物。
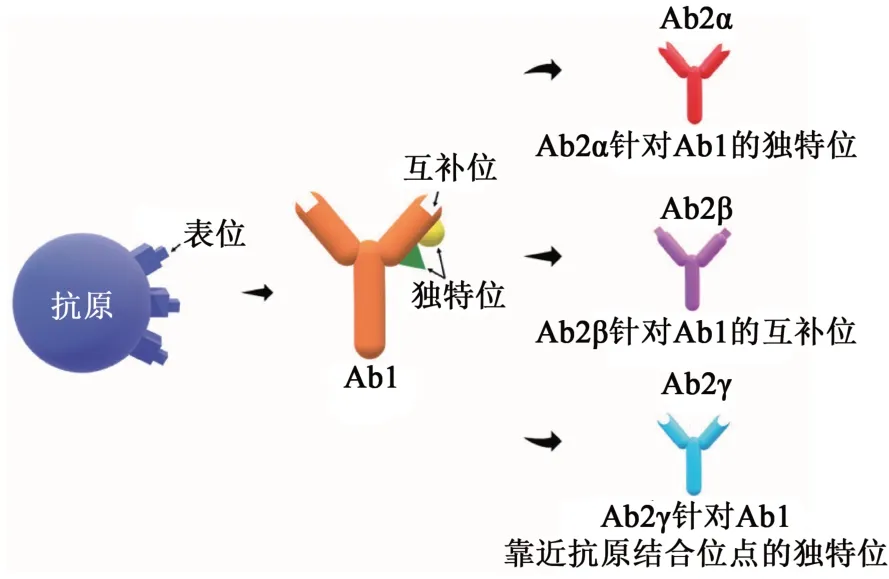
图1 Ab2的分类[8]Fig. 1 The classification of Ab2[8]
在一系列半抗原免疫检测中,研究人员已经开始用Ab2作为半抗原偶联物的替代试剂。Ab2的结合位点是Ab1的独特位,大多研究聚焦于Ab2在疫苗或免疫治疗中的应用[10],而在免疫检测中的应用不多,主要原因在于Ab2的制备比较困难。目前,基于Ab2开发的半抗原免疫检测项目中已被商品化的产品较少。下文综述了Ab2的制备方法,归纳了Ab2在不同模式半抗原免疫测定中的应用,并讨论了Ab2对不同分析性能的影响,以期对未来Ab2的制备及其在免疫检测中的应用提供指导。
2 抗独特型抗体的制备方法
Ab2的制备主要方法有3类:①通过传统实验动物免疫的抗体开发技术,常用同种属免疫(syngeneic immunisation)或异种属免疫(xenogeneic immunisation)2类免疫方式;②通过骆驼免疫抗体库或天然抗体库筛选纳米抗体;③通过合成抗体库筛选单链可变区片段(single-chain fragment variable,scFv)。
目前,关于制备Ab2所用的免疫原、免疫方法和其他关键试剂的文献报道较少,对于如何高效制备Ab2尚未形成相对一致的看法。Spkins等[11]在制备拟除虫菊酯和百草枯的Ab2时发现,用Ab1-载体蛋白的偶联物比单独用Ab1能产生更强的免疫反应。大多数研究人员采用以钥孔血蓝蛋白为载体蛋白的Ab1偶联物进行免疫接种,半抗原和载体蛋白之间采用戊二醛或1-乙基-3-(3-二甲基氨基丙基)碳二亚胺/N-羟基琥珀酰亚胺(EDC/NHS)偶联方法,在较为温和的偶联环境中以确保Ab1互补位的结构保持完整[12-13]。目前,最常用的免疫佐剂是弗氏佐剂,但Jones等[14-15]研究发现Gerbu佐剂比弗氏佐剂的生物相容性和稳定性更好,产生针对Ab1的免疫应答也大大增强。
本团队在开发25-羟基维生素D、雌二醇和醛固酮非竞争法试剂的过程中,尝试用免疫小鼠方式制备针对半抗原和Ab1的抗伴型抗体[16]。我们的研究发现,如果Ab1是鼠源性抗体,将其与半抗原孵育后的免疫效果不佳,而采用非鼠源性抗体和半抗原共孵育才可以获得较好的免疫效果。采用弗氏佐剂乳化时,由于Ab1和半抗原形成的复合物可能在剧烈乳化条件下发生解离,因此在后续筛选中,针对Ab1和半抗原复合物新表位的抗伴型抗体阳性率极低。阳性率低的另一种原因可能是抗体结合抗原后引起的免疫复合物空间构象变化较小,且半抗原大部分包埋于抗体内部,难以形成新的有效抗原决定簇。此外,在筛选过程中,由于抗伴型抗体与Ab1以及半抗原组成的复合物相互之间接触表面积较大,难以实现对免疫复合物空间构象变化的精准识别,从而造成较高的非特异性干扰。
从天然库和合成多肽库中筛选Ab2的主要难点在于库容多样性不高,难以筛到高亲和力的克隆,且商业化的文库成本高,难以获得。一般来说,需要用Ab1制备Ab2,但对于某些分子量很小的半抗原,难以制备半抗原偶联物用于免疫和筛选时,可以采用Ab2直接制备抗-抗独特型抗体,使其能识别原始的半抗原,以此制备的抗体与Ab1具有完全不同的结构特征[17]。
3 抗独特型抗体在免疫检测中的分析模式
在Ab1的基础上,结合不同亚类的Ab2可以实现一系列不同的半抗原免疫检测模式,完成不同的分析性能指标。
3.1 Ab2在竞争免疫检测中的分析模式
在竞争法中,半抗原主要用作标准品,也可用于制备包被抗原或者标记抗原偶联物。由于Ab2β模拟了半抗原并阻断了其与Ab1的结合,因此在竞争法检测中,可以用其替代包被抗原、竞争抗原或标准品。例如,在真菌毒素免疫检测中,Ab2常常作为毒素标准品的替代品,通过分别建立Ab2和毒素的竞争抑制曲线,再利用两步转换公式计算样本浓度[18-20]。然而,使用Ab2作为替代标准品对免疫检测方法分析性能的影响不一。Shi等[18]将Ab2作为玉米赤霉烯酮的模拟物,建立了玉米赤霉烯酮的竞争酶联免疫吸附剂测定法,该方法相对于非独特型抗体的竞争ELISA,工作范围和灵敏度均稍有提高。Zhang等[19]用Ab2作为标准品,建立了赭曲霉毒素A的ELISA方法,其工作范围比用赭曲霉毒素A作标准品更宽。Hu等[20]将Ab2替代黄曲霉毒素B1作为标准品,建立竞争ELISA法的检测范围有所变窄,由5~200 ng·mL-1变为5~100 ng·mL-1,而且当将黄曲霉毒素B1添加到样本中的浓度高于50 ng·mL-1时,回收率有明显的下降趋势。
除用于半抗原的ELISA检测外,Ab2还广泛用于表面等离子共振、微阵列、电生物芯片以及在免疫层析中作为包被试剂或检测试剂[21-23]。Schulz等[24]应用Ab2建立了一种同时检测石房蛤毒素、微囊藻毒素LR、T2毒素、杆孢菌素A(roridin A)、黄曲霉毒素B1的电化学快速检测方法。其中,检测石房蛤毒素、微囊藻毒素LR和杆孢菌素A的Ab2包被在生物芯片上,另外2种毒素的Ab2则用于标记半乳糖苷酶。该方法无需对样本进行复杂的前处理,在13.4 min内即可完成检测,对几种毒素的检出限为0.4~1.5 ng·mL-1,适合于现场检测。Tang等[22]以Eu/Tb(Ⅲ)纳米球作为标记物,利用2种抗独特型纳米抗体开发了一种同时快速定量检测黄曲霉毒素B1和玉米赤霉烯酮的时间分辨荧光免疫层析方法。该研究比较了2种不同的竞争检测模式,一种是将针对小分子的单抗包被硝酸纤维素膜,纳米抗体标记纳米球;另一种是将纳米抗体包被硝酸纤维素膜,小分子单抗标记纳米球(图2)。检测结果表明,对于黄曲霉毒素和玉米赤霉烯酮来说,后一种模式的灵敏度比前一种分别高18.3倍和20.3倍。
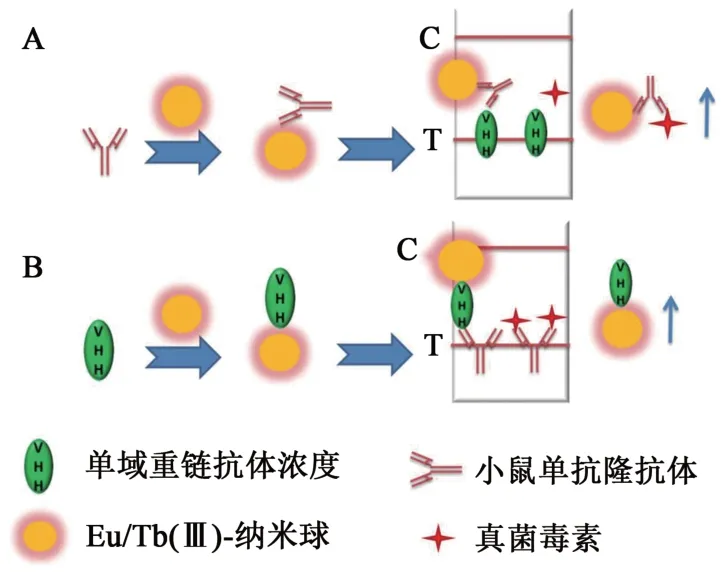
图2 免疫层析竞争法检测真菌毒素的2种模式Fig. 2 Two patterns of the competitive immunochromatographic assays for mycotoxin
最近有很多研究人员在半抗原免疫分析中将纳米抗体作为Ab2。纳米抗体可以作为模拟半抗原的有用工具,尤其是来源于骆驼天然抗体库中的纳米抗体。纳米抗体体积小,具有较长的互补决定区3(complementarity determining region,CDR3),相比传统的抗原结合域具有更强的穿透性,更利于Ab2的筛选。
在半抗原免疫分析中,Ab2的亲和力并非越高越好,免疫抗体库筛选的Ab2分析性能通常不如天然文库筛选的Ab2。采用比Ab1半抗原亲和力低的Ab2作为包被抗原,能提升分析灵敏度[25-27]。Qiu等[28]从天然噬菌体展示库中筛选到一株针对脱氧雪腐镰孢霉烯醇Ab1的纳米抗体,其对Ab1的亲和力增强,反而使检测灵敏度降低了7倍,另一株突变体降低了对Ab1的亲和力,而检测灵敏度有所增加[29],这种现象可能是Ab2与半抗原竞争结合Ab1的效果减弱导致的。免疫库中筛选得到的Ab2,由于经过体内亲和力成熟的过程,亲和力常高于天然抗体库中筛选的Ab2。Xiong等[30]评估了一系列针对桔青霉素Ab1的Ab2纳米抗体的亲和力,并将亲和力最低的一株用作包被抗原,最高的一株用于替代标准品。这项研究表明,不同亲和力的Ab2均有利用价值,应避免只筛选高亲和力的Ab2。在生物淘选过程中,降低Ab1包被浓度有利于筛选出亲和力更高的Ab2,而增加Ab1的浓度则更适合筛选用于免疫检测的Ab2。
3.2 Ab2在非竞争免疫检测中的分析模式
与采用同一Ab1的竞争法相比,加入Ab2是否有助于检测性能的提升取决于免疫检测方法学的设计和Ab2自身的性质。在非竞争免疫检测模式中,通过不同抗体的双重识别可以提高检测的灵敏度和特异性。在同时应用Ab2α和Ab2β的检测模式中,当半抗原结合到Ab1上后,Ab2α可以与Ab1的可变区结合。当Ab2β与Ab1结合时,由于空间位阻阻断了Ab2α的结合,通过检测Ab2α可以反映半抗原的浓度水平(图3)。Kobayashi等[32]报道了1种测定11-脱氧皮质醇的非竞争性酶免疫方法,首先将半抗原与一定量的融合蛋白scFv-ALP(scFv特异性识别11-脱氧皮质醇,该蛋白为scFv与碱性磷酸酶的融合蛋白)温育,再将未结合半抗原的融合蛋白与识别scFv互补位的鼠Ab2β形成复合物,进而被抗鼠IgG包被的磁球分离除去,上清中剩下的为半抗原与scFv-ALP的复合物,该复合物进一步被微孔板上包被的Ab2α捕获,抗原浓度与ALP成正相关关系。该方法的检出限可以达到每测试20 amol·L-1,且测量范围非常宽,远宽于竞争性放射免疫检测。该课题组采用类似的方法,用针对半抗原的抗体、Ab2α和Ab2β建立了熊脱氧胆酸7-N-乙酰葡萄糖胺的非竞争性检测平台,其灵敏度达118 amol·L-1,且特异性较好[33]。
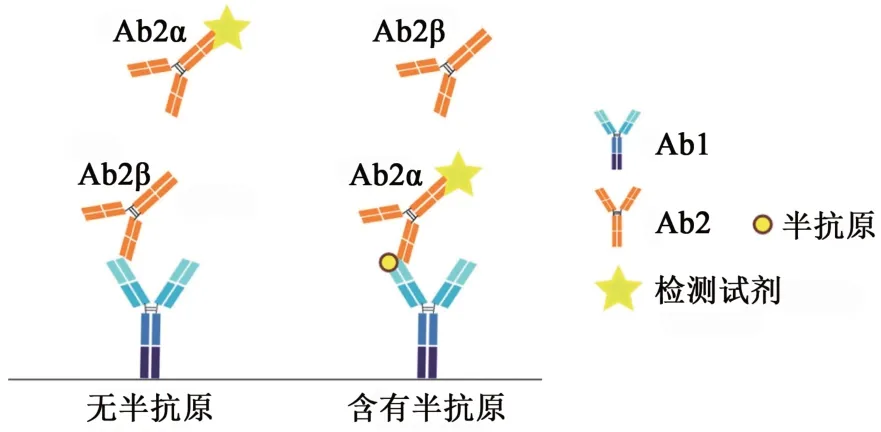
图3 基于Ab2的非竞争检测模式[31]Fig. 3 Schematic illustration of Ab2-based noncompetitive immunoassay format[31]
目前,采用抗独特型抗体进行小分子免疫检测的商业化产品很少,其中比较成功的是英国Selective Antibodies公司基于选择性抗体系统(selective antibody system)开发的免疫层析检测,该系统采用了2株抗体和1种阻断剂,其中1株抗体是针对半抗原的抗体Ab1,另一株抗体是针对Ab1的Ab2,阻断剂是1种半抗原-蛋白偶联物。在半抗原与Ab1结合后,Ab2仍可以结合Ab1,而未结合半抗原的Ab1被阻断剂结合后,由于空间位阻使Ab2无法结合。在免疫层析检测中,包被Ab1的纳米金与样本中的半抗原结合后,剩余的Ab1位点与阻断剂结合,半抗原的纳米金移动到固定有Ab2的检测线时,被Ab2捕获并显色,而结合阻断剂的纳米金则不会被Ab2捕获,因此样本中半抗原越多,显色越强[34](图4)。
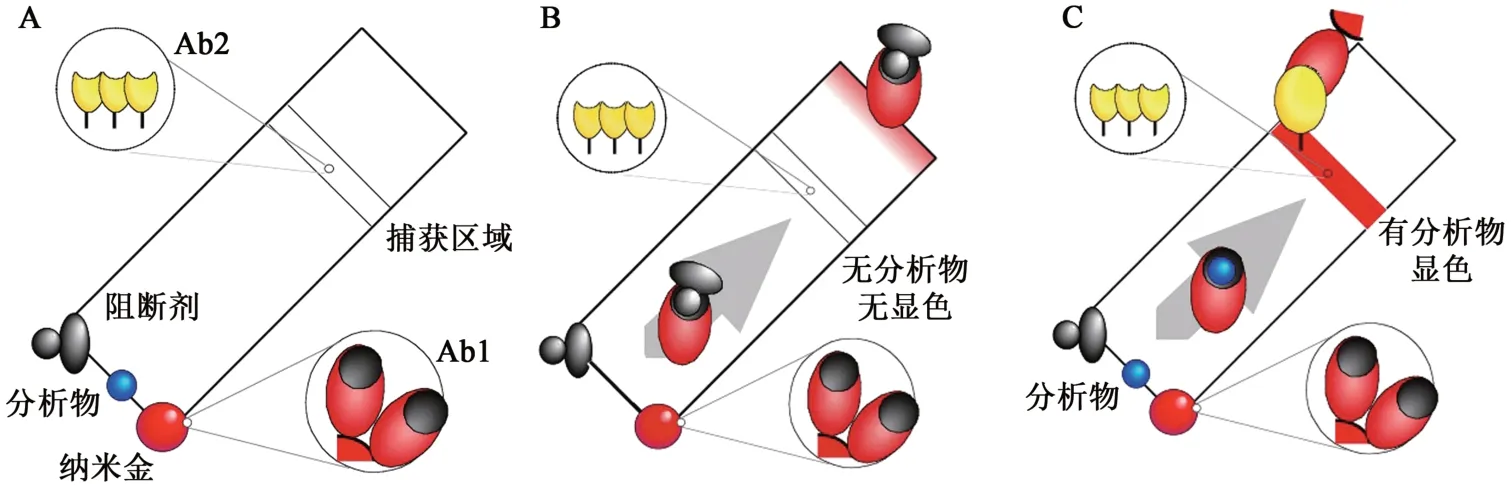
图4 免疫层析系统检测[34]Fig. 4 Detection of the immunochromatography system[34]
该系统的优势包括:①检测速度快,不需要与零值标准品进行显色对比;②可以采用1株通用的Ab2进行检测,无需针对不同的Ab1进行Ab2的开发。然而其不足之处是对阻断剂的要求较高,既要求阻断剂与Ab1的结合能够对Ab2与Ab1的结合造成空间位阻,同时又不能与半抗原形成竞争关系,避免降低灵敏度。
除同时采用Ab2α和Ab2β的非竞争检测模式以外,也可以只采用1株抗伴型抗体(anti-metatype antibody)与半抗原特异性单抗实现非竞争法检测。Omi等[35]利用自主多样化库(autonomously diversifying library,ADLib)系统制备了针对雌二醇和25-羟基维生素D 2种半抗原-抗体免疫复合物的抗伴型单抗,并基于此建立了2种半抗原的全自动化学发光酶免疫检测方法,其中25-羟基维生素D的检出限可达2.1 ng·mL-1,对1,25-二羟基维生素D3等类似物的交叉显著降低,且该方法与参考方法具有非常高的相关性。类似地,本团队也已经开发了针对25-羟基维生素D、醛固酮和雌二醇3种小分子半抗原的非竞争法试剂,并已经获批国内注册证[16],其分析性能相对于用同一株Ab1开发的竞争法,灵敏度、特异性和抗干扰能力均有显著提升(表1)。本团队对此类抗体的结合位点进行研究时发现,抗伴型抗体只识别Ab1可变区和半抗原结合后形成复合物的新表位,并不识别半抗原和Ab1本身,具体如图5所示。
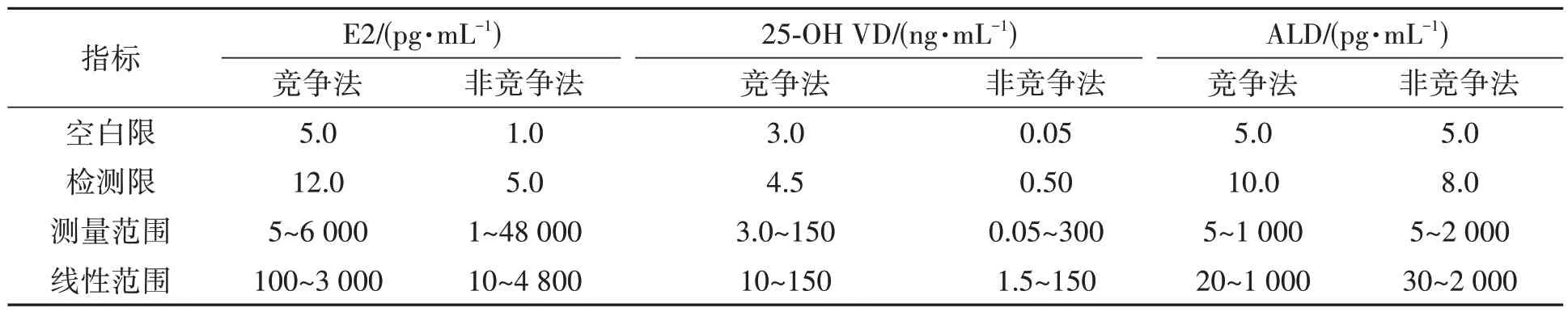
表1 非竞争法与竞争法分析性能指标对比数据Table 1 Comparison of performance indicators between non-competitive and competitive assays
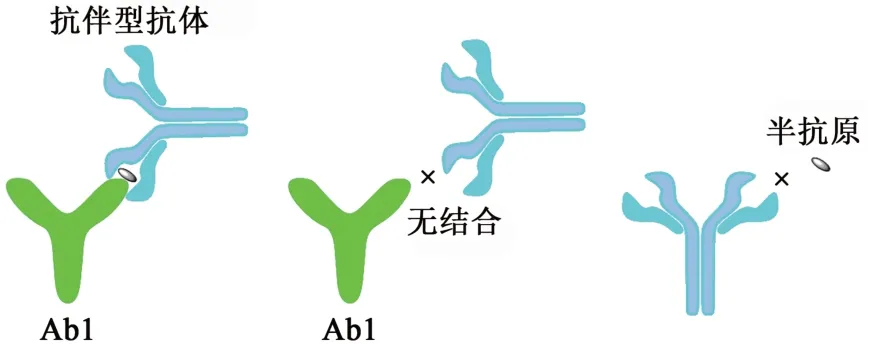
图5 抗伴型抗体的结合位点Fig. 5 The binding site of anti-metatype antibody
虽然非竞争法相对于竞争法具有明显优势,但是采用传统动物免疫技术制备Ab2α和Ab2β的配对组合是比较困难的,细胞阳性克隆率低,需要繁琐的筛选过程。近年来,采用噬菌体展示技术制备Ab2α和Ab2β使流程得以简化和改进,因此引起了研究人员的重视。Shu等[36]以抗伏马菌素B1单抗为靶分子,从羊驼天然纳米抗体噬菌体文库中筛选到与之结合的Ab2α和Ab2β,建立的非竞争性ELISA对半抗原的检出限为0.19 ng·mL-1,而竞争性ELISA为3.41 ng·mL-1。
Ab2的使用除了能提高检测灵敏度,还能显著改变Ab1的交叉反应性。Li等[37]用黄曲霉毒素-蛋白偶联物作为包被抗原时,评估了1株针对黄曲霉毒素的Ab1对黄曲霉毒素B1、B2、G1和G2的交叉率,分别为100%、92%、54%和6.7%;而当将偶联物更换为1株Ab2时,对这4种类似物的交叉率分别变为100%、54.4%、90.4%和37.7%[38]。采用不同的Ab2可以调节Ab1对不同半抗原类似物的交叉反应性,因此,可以通过Ab2的应用改善目前普遍存在的半抗原检测特异性问题。
3.3 基于噬菌体的Ab2免疫检测分析模式
基于噬菌体颗粒的Ab2免疫检测方法主要包括以下3种:①噬菌体展示ELISA(phage display ELISA,PD-ELISA);②噬菌体展示免疫PCR(phage display immuno-PCR,PD-IPCR);③噬菌体展示免疫环介导等温扩增(phage display immunoloop-mediated isothermal amplification,PD-iLAMP)。这3种检测方法均采用噬菌体颗粒与半抗原竞争结合包被Ab1的模式。在PD-IPCR和PD-iLAMP中,结合的Ab1噬菌体颗粒在洗脱后用于后续的RT-PCR或LAMP。采用噬菌体颗粒的优势在于,首先噬菌体表面衣壳蛋白的重复序列可以提供多个结合位点,其与DNA扩增技术组合使用能够显著放大信号,提升分析灵敏度。其次,将培养物简单离心即可收集噬菌体颗粒,使用方便[39-40]。
在使用相同Ab2纳米抗体的前提下,与标准ELISA或PD-ELISA相比,PD-IPCR显著提高了灵敏度,这在赭曲霉毒素A[40]、桔青霉素[41]和玉米赤霉烯酮[42]中均已被证明。然而,PD-IPCR的不足之处主要在于需要昂贵的荧光定量PCR仪以及较长的扩增时间[43],而且PCR对检测环境和条件有特殊的要求,不适合现场快速检测。Lei等[44]将竞争免疫检测和LAMP结合,构建了一种适合现场检测黄曲霉毒素的PD-iLAMP方法。LAMP中采用了1种金属离子指示剂羟基萘酚蓝,当样本中含有黄曲霉毒素时,溶液颜色为蓝紫色,当样本中不含黄曲霉毒素时,溶液变为天蓝色(图6)。这种方法检测花生中黄曲霉毒素B1的目测检出限为1.6 μg·kg-1,灵敏度不及该课题组建立的免疫层析法。分析可能的原因是毒素提取液中含有大量甲醇,为了消除溶剂和基质效应的影响,保证LAMP扩增效果,扩增前将样本进行了较大比例的稀释(16倍),因此降低了LAMP的检测灵敏度。
4 展望
建立安全、特异、灵敏、快速的半抗原检测方法是目前众多检测领域的迫切需求。Ab2作为一种半抗原的替代,可以应用于不同类型的免疫检测方法中,在竞争法中可以替代半抗原-载体蛋白偶联物作为竞争抗原,避免了毒性半抗原的使用,改善了检测的交叉反应率。在非竞争法中,可以与Ab1联合使用,实现比竞争法更高的灵敏度和特异性。Ab1和抗伴型抗体相结合的非竞争检测模式可能代表了半抗原免疫检测未来的发展方向。Ab2是针对Ab1产生的,不同的Ab2对检测的性能有不同的影响,但要实现对半抗原的灵敏特异性检测,Ab1的性能也是一个重要的前提条件。尽管目前的初步研究已经证明,Ab2在半抗原免疫检测中对性能改善有较大的帮助,但Ab2的制备依然存在一定的难度,其筛选方法也难以标准化。因此,目前没有一种基于Ab2的半抗原免疫检测方法被国际权威机构认可,其性能与半抗原检测的参考方法LC-MS/MS仍有一定的差距。即便Ab2的使用极大地改善了半抗原的检测性能,但由于临床检测试剂需要重新建立参考区间和阳性判断值,因此离大规模临床应用还有一段距离。
在Ab2的制备方面,与动物免疫相比,免疫抗体库、天然抗体库和合成抗体库为筛选不同性质的Ab2提供了更多的可能性。在不改变Ab1的前提下,通过搭配使用不同的Ab2来提升检测特异性可能是未来的一个重要研究方向。

