抗鼠棒状杆菌单克隆抗体制备及鉴定
余建国 朱楼英
(1.金华职业技术学院 浙江金华 321017;2.金华市实验动物中心 浙江金华 321007)
鼠棒状杆菌 (Corynebacterium kutscheri,CK)主要寄生于大鼠、小鼠上呼吸道,为动物源性致病菌,常为隐性感染。 临床上主要表现伪结核症状或化脓性炎症, 在鼠免疫功能损伤或抑制、 外界环境改变时,可引起鼠急性死亡。
实验动物国家检测标准中, 鼠棒状杆菌是清洁级大鼠、小鼠必须排除的项目。鼠棒状杆菌调查诊断方法目前有病原菌分离培养方法、免疫学方法、分子生物学(PCR)方法。实验动物国家标准(GB/T14922-2011)中规定的检测方法也是细菌学分离、血清学检测,该检测方法操作复杂,耗时长,容易造成漏检。PCR 法虽然灵敏、快速,但仪器设备要求高,检测成本昂贵,不适合基层规模推广应用。
单克隆抗体技术的发展及其优越性,在农业、医学等生物技术领域得到了广泛应用。 在鉴定细菌种类方面, 单克隆抗体技术具有的高灵敏性和高特异性是其它方法无法比拟的。 本研究通过细胞融合技术,筛选出分泌抗CK 单抗的杂交瘤细胞株,从而制备灵敏且特异度高的单克隆抗体, 为构建可用于临床快速检测的血清学方法奠定技术基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c 雌性小鼠(6~8 周龄),由金华市实验动物中心提供; 鼠棒状杆菌的纯培养菌体,由浙江省实验动物中心惠赠。
1.1.2 试剂 鼠棒状杆菌ELISA 检测试剂盒、牛血清白蛋白、卵清蛋白等,市售;PBS、CBS 等缓冲液由实验室自制。
1.2 方法
1.2.1 免疫抗原制备 收集鼠棒状杆菌的纯培养菌体,以小体积生理盐水调至悬浮,冰浴条件下超声粉碎5 min (150 W), 粉碎物4 ℃、12 000 r/min 离心20 min,收集上清。细菌沉渣重复超声5 min,重复离心,取上清液4 ℃冷藏备用。
1.2.2 动物免疫 取4 只BALB/c 雌性小鼠(6~8 周龄), 颈部及背部皮下多点注射免疫, 免疫剂量为50 μg/只,共免疫4 次。 初次免疫为1.2.1 中制备的免疫原与等体积弗氏完全佐剂乳化;加强免疫时,免疫抗原与等体积弗氏不完全佐剂乳化, 免疫剂量方式等均不变。 免疫间隔期为21 d, 第4 次免疫后10 d, 采尾根血10 μL, 加入到990 μL PBS 中,混匀,5 000 r/min 离心10 min,弃沉淀;收集上清、混匀,5 000 r/min 离心10 min, 弃沉淀, 上清保存在-20 ℃冰箱中备用。
1.2.3 细胞克隆 将致敏的脾细胞与SP2/0 瘤细胞以按文献方法进行融合[1]。 14 d 后,用含鼠棒状杆菌的大鼠肝匀浆做抗原,检测培养上清。 融合前1 周,采用常规方法处理,复苏冻存的SP2/0 细胞;采集血清效价符合试验要求的小鼠脾细胞, 转移至无菌筛网上,以注射器硅胶头充分研磨脾脏,重复滴加PBS冲洗筛网3 次,收集研磨混合液,转移至无菌离心管中,1 000 r/min 离心5 min, 收集后重悬15 min,以PBS 液洗涤溶液3 次,计数。
将SP2/0 细胞与脾脏细胞按1:5 混合, 按文献方法进行细胞融合[2]。 采用间接ELISA 方法进行克隆筛选, 获得能分泌抗鼠棒状杆菌的特异性抗体且稳定生长的瘤细胞系。 收集单克隆抗体细胞培养上清,用于鉴定,将细胞冻于-80 ℃保存备用。
1.2.4 单克隆抗体的制备与纯化
1.2.4.1 单抗的制备 采用体内诱生腹水法制备单克隆抗体,选取10 周龄左右的F1 昆明小鼠,每只小鼠腹腔注射0.5 mL 液体石蜡,5 d 后通过腹腔注射处于对数生长期的阳性杂交瘤细胞, 每只小鼠注射1×106个细胞;7~10 d 后, 待小鼠腹部明显膨大时,无菌收集小鼠腹水,以3 000 r/min 离心15 min,以去除细胞与杂质,加入适量防腐剂(防腐剂体积为腹水体积的0.05%),收集腹水上清并于-80 ℃冻存备用。
1.2.4.2 单抗的纯化 以辛酸硫酸铵沉淀法对单克隆抗体纯化[3]。 将醋酸钠-醋酸缓冲液(0.05 mol/L,pH4.2)与小鼠腹水上清按1:2 混合均匀,室温下均匀加入正辛酸(每毫升上清加25 uL);4 ℃静置2 h,低温下以15 000 r/min 离心30 min, 收集滤纸过滤液,校正pH 值至7.2。 冰浴条件下,均匀缓慢加入饱和硫酸铵溶液,调整硫酸铵的饱和度至45%,继续搅拌30 min, 冰上静置4 h,4 ℃下10 000 r/min 离心30 min,弃掉上清,保留沉淀;向沉淀中加入2 mL PBS,将溶液混匀后转移至PBS 缓冲液中进行透析;透析液体在4 ℃条件下12 000 r/min 离心25 min,收集上清并分析抗体纯度。
1.2.5 单克隆抗体的鉴定
1.2.5.1 单抗效价和灵敏度测定 用1.2.2 中制取的血清,采用间接ELISA 法测定杂交瘤细胞培养上清诱导小鼠产生的腹水效价, 抗体浓度稀释倍数依次为2×102、4×102、8×102、16×102、32×102、64×102、128×102, 配置浓度分别为200、100、50、25、12.5、6.25、3.125、1.563 ng/mL(CK 菌液悬液),用作灵敏度检测。
1.2.5.2 抗体特异性的鉴定 以间接竞争ELISA法,设定泰泽氏菌(BP)、巴氏杆菌(PMU)、沙门氏菌(SE)、弓形虫(TO)为参照,检测单抗与CK 类似物的交叉反应。
1.2.5.3 亲和力试验 亲和力反应可以提示单抗(mAb)的纯度,本试验采用间接ELISA 法检测mAb与5 种免疫球蛋白的交叉反应。 取1 μg/mL 天然IgE、IgG、IgM、IgA、IgD,按0.1 mL/孔进行包被,一抗选用非血清培养细胞上清液(0.1 mL/孔),二抗选取临时稀释的HRP 标记的山羊抗小鼠IgG (0.1 mL/孔)。 各孔加入0.1 mL TMB 进行显色,最后各反应孔中加入2 mol/L 硫酸0.05 mL 终止反应。 于450 nm 处测各孔吸光度(A)值(见图1)。
结果显示:4 只实验鼠的免疫抗体都能被CK 抗原抑制,半数抑制浓度(IC50)在150~4.69 ng/mL,其中3 号小鼠的IC50最好,由抑制曲线(见图2)计算IC50为4.77 ng/mL。 3 号鼠的血清效价最高,灵敏度最强,所以,3 号鼠备选作亲和试验。 据CK-mAb 灵敏度测定结果, 可得亲和度线性回归方程:y=-0.4229x+0.4714,R2=0.0782, 经计算, 其IC50为0.86 ng/mL[10]。 亲和曲线显示(见图2):当包被抗原浓度为1.0 μg/mL 和0.5 μg/mL,mAb 与抗原结合达到50%饱和状态时的浓度分别为3.16 μg/mL 和2.85 μg/mL,通过亲和常数公式计算出亲和常数Ka为1.96×109L/mol[4]。
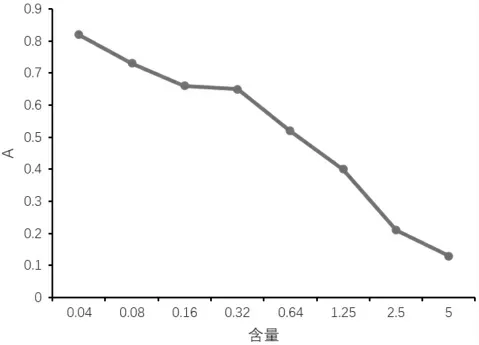
图2 3 号鼠亲和力检测结果
2 结 果
2.1 单抗效价和灵敏度检测结果 由表1 可知,第4 次免疫10 d 后,4 只受免鼠均产生了血清学抗体,效价在1.6×103~1.28×104,抗体水平均值非常高。 免疫小鼠血清单抗灵敏度检测结果见表2。

表1 单抗效价检测结果

表2 单抗灵敏度检测结果
2.2 单抗(CK-mAb)特异性鉴定 3 号小鼠脾细胞与骨髓瘤细胞SP2/0 融合后,经过有限稀释法[5]亚克隆和ELISA 筛选, 最后得到1 株能够稳定分泌抗CK-mAb 的杂交瘤细胞09A2B5,通过体内诱生腹水法批量制备出抗体。 间接ELISA 测定腹水效价,细胞上清的效价为1:1 600,腹水的效价为1.256×105。从特异性试验结果间接可知(见表3),单抗与泰泽氏菌、巴氏杆菌、沙门氏菌、弓形虫的交叉反应比例分别为1.47%、0.91%、0.42%、0.06%。
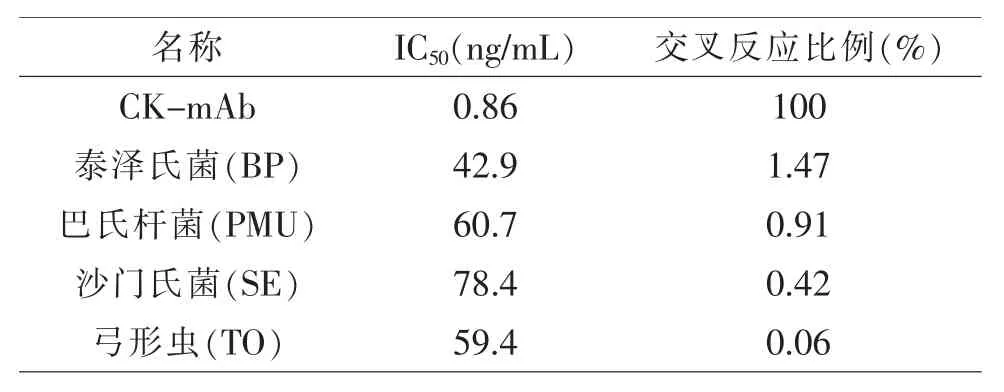
表3 特异性试验结果
3 讨论与分析
单克隆抗体制备中, 高效价抗体的获取相对简易,但抗体的特异性易因杂蛋白干扰而呈现异常[6]。本试验制备的鼠棒状杆菌单克隆抗体 (CK-mAb),具有良好的特异性,为构建血清学快速检测方法(胶体金检测法)奠定了坚实的基础。
本研究在筛选瘤细胞系过程中, 采用了有限稀释法,该法的缺点是需要进行多次克隆,延展了试验周期。有文献提示,甲基纤维素半固体培养基法可以较好解决这一问题[7],在未来的研究中有待进一步探索。
在mAb 交叉免疫试验中,mAb 与天然IgE 的反应性总体较好,与其它免疫球蛋白的反应性极低,提示单抗本身极强的亲和性。文献提示,单抗的亲和力与蛋白表达系统有密切关联, 利用哺乳动物蛋白表达系统, 活性蛋白所必需的空间结构和修饰更接近于天然状态,与原核表达系统比较,能弥补缺少高级修饰和糖基化、磷酸化等翻译后加工,表达的蛋白不能很好地折叠等缺陷, 对单克隆抗体的表达具有明显的优势。
实验动物的快速检测技术相对缺乏, 以小鼠棒状杆菌单克隆抗体为基础的快速检测方法的构建,为实验动物微生物评价和质量控制提供了一条新的途径。尤其是在病毒测定中,快速检测可以发挥积极的作用。

