Helsinki CT 评分和CONUT 评分预测重度颅脑损伤患者28 d预后情况的价值
张军 张红伟 朱艺 范承启 韩瑞璋
目前全球范围内每年发生颅脑损伤(traumatic brain injury,TBI)例数近5 000 万,其中重度颅脑损伤(severe traumatic brain injury,sTBI)约占TBI 患者总数的23%,其预后不良率达53%[1-2]。有研究表明,基于影像学特征建立的CT 评分不受外界因素影响,能够客观评估TBI 严重程度及预后[3]。较其他CT 评分,赫尔辛基(Helsinki)CT 评分更侧重统计TBI 类型,纳入分析的头颅影像学特征更为全面、详细,且操作简单,易获取。Thelin 等[4]研究显示,Helsinki CT 评分是影响TBI患者预后的独立预测因素,用于判断患者预后的能力优于Marshall 评分、Rotterdam 评分。但国内外此类研究较少,其结论的可靠性尚需验证。控制营养状况(controlling nutritional status,CONUT)评分是一种基于白蛋白、TC、淋巴细胞计数3 项指标构成的营养评分系统,有研究发现,早期营养状况也是影响TBI 患者预后的重要因素[5],但CONUT 评分与TBI 关系的研究鲜有报道。鉴于此,本研究回顾sTBI 患者的临床资料,同时计算Helsinki CT 评分、CONUT 评分,并通过倾向性评分匹配(propensity score matching,PSM),分析Helsinki CT评分、CONUT 评分以及两种评分联合使用与sTBI 患者28 d预后的相关性,旨在为改善sTBI预后提供参考。
1 对象和方法
1.1 对象选取2018 年1 月1 日 至2021 年12 月31 日中国人民解放军陆军第七十二集团军医院收治的sTBI 患者196 例,其中男123 例,女73 例,年龄39~73(52.97±7.66)岁;合并多发伤56 例,糖尿病32 例,高血压50 例,肺部疾病19 例,低氧血症41 例,低血压37例;受伤至入院时间1~9(4.63±1.83)h。纳入标准:(1)有明确颅脑外伤史,头颅CT 检查异常;(2)年龄≥18 岁;(3)受伤至入院时间≤12 h;(4)入院格拉斯哥昏迷评分(Glasgow coma scale,GCS)≤8 分。排除标准:(1)既往患有脑部疾病;(2)合并严重的肝、肾等重要器官疾病;(3)基线资料缺失。本研究经本院医学伦理委员会审查通过(批准文号:2022020)。
1.2 方法
1.2.1 资料收集 收集患者入院基线资料,主要包括性别、年龄、受伤至入院时间、有无多发伤、有无基础疾病(糖尿病、高血压、肺部疾病)、有无低氧血症、有无低血压、GCS 评分、CT 检查结果以及血乳酸、D-二聚体、白蛋白、TC、淋巴细胞计数检测水平。根据患者28 d 预后情况分为死亡组和存活组。
1.2.2 Helsinki CT 评分 采用2014 年Raj 等[6]制定的Helsinki CT 评分系统对患者头颅CT 检查结果进行评分。评分标准如下:硬膜下血肿(2 分)、颅内血肿(2分)、硬膜外血肿(-3 分)、出血体积超过25 cm3(2 分)、脑室出血(3 分)、鞍上池正常/受压/消失(0、1、5 分),总分-3~14 分。由2 位中级职称及以上的放射科医师独立计算,当分数不一致时,由第3 位副主任医师指导并协商确定。
1.2.3 CONUT 评分 该评分系统由血清白蛋白、TC、淋巴细胞计数3项指标组成[7]。评分标准为:血清白蛋白≥35.0、30.0~34.9、25.0~29.9、<25 g/L 分别记0、2、4、6分;TC>1 800、1 400~1 800、1 000~1 390、<1 000 mg/L分别记0、1、2、3 分。淋巴细胞计数>1 600、1 200~1 599、800~1 199、<800 个/mL 分别记0、1、2、3 分。总分0~12 分,评分越高,提示患者营养状态越差。
1.2.4 PSM 采用SPSS 26.0 统计软件中的PSM 扩展程序实现,采用1∶1 匹配法,以纳入单因素分析的指标作为协变量,卡钳值取0.02,如果有多个个体在卡钳值0.02 范围内,则采用随机抽样法,选取一个样本作为匹配,基于PSM 原则,本研究共计匹配成功48 对。
1.3 统计学处理 采用SPSS 26.0 统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验。采用多因素logistic 回归分析影响sTBI患者预后的危险因素。利用MedCalc 软件绘制ROC 曲线,基于logistic 回归分析建立回归方程,采用Z检验比较两种评分单独及联合使用预测sTBI 患者预后不良的AUC。P<0.05 为差异有统计学意义。
2 结果
2.1 PSM 前两组患者基线资料比较 死亡68 例,存活128 例。PSM 前,死亡组年龄、乳酸水平高于存活组,GCS 评分低于存活组,合并多发伤、蛛网膜下腔出血、糖尿病的比例高于存活组,差异均有统计学意义(均P<0.05),其余指标两组间比较差异均无统计学意义(均P>0.05),见表1。

表1 PSM 前两组患者基线资料比较
2.2 PSM 后两组患者基线资料比较 经1∶1 PSM 后,两组患者共48 对匹配成功。两组患者基线资料比较差异均无统计学意义(均P>0.05),见表2。
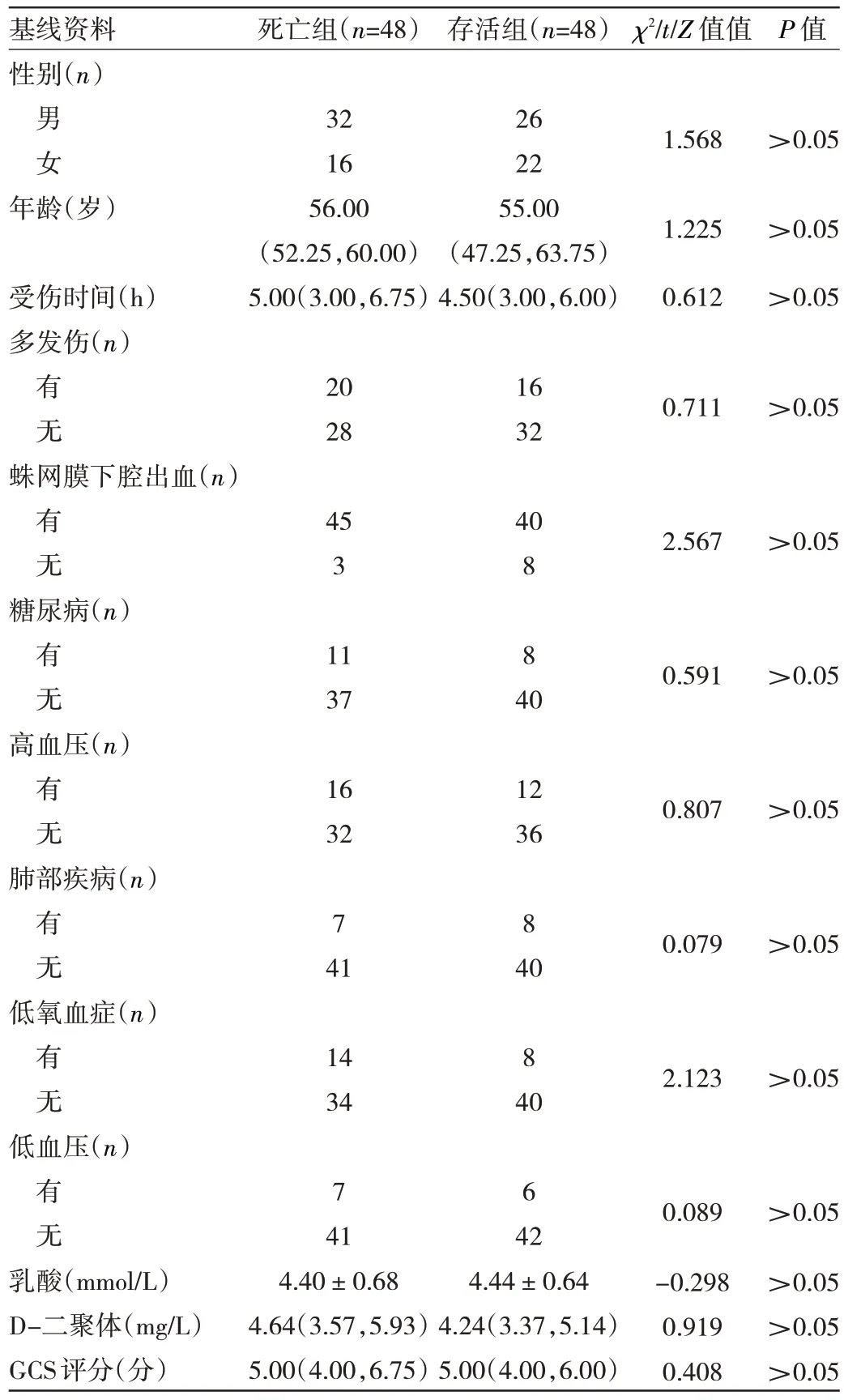
表2 PSM 后两组患者基线资料比较
2.3 影响sTBI 患者预后的危险因素分析 经PSM 后,死亡组患者Helsinki CT 评分为7.00(6.00,8.00)分,CONUT 评分为5.00(4.00,6.00)分,均明显高于存活组的5.00(4.00,6.00)分、4.00(3.00,5.00)分,差异均有统计学意义(Z=1.837、1.633,均P<0.05)。多因素logistic回归分析显示,Helsinki CT评分升高(OR=1.930,95%CI:1.355~2.750,P<0.01)和CONUT 评分升高(OR=1.781,95%CI:1.287~2.464,P<0.01)是影响sTBI 患者预后的独立危险因素。设X1=Helsinki CT 评分,X2=CONUT评分,计算两种评分联合使用回归方程:Y=1/[1+EXP(0.658X1+0.577X2-6.595)]。
2.4 两种评分预测sTBI 患者预后不良的效能分析ROC 曲线分析显示,Helsinki CT 评分判断预后不良的AUC为0.735(95%CI:0.636~0.820),最佳截断值为7分,灵敏度、特异度分别为0.604、0.771,约登指数为0.375;CONUT 评分判断预后不良的AUC 为0.721(95%CI:0.621~0.808),最佳截断值为5 分,灵敏度、特异度分别为0.688、0.646,约登指数为0.333。两种评分联合使用判断预后不良的AUC 为0.814(0.721~0.886),最佳截断值为0.523,灵敏度、特异度均为0.750,约登指数为0.500。两种评分联合使用预测sTBI 患者预后不良的AUC 大于Helsinki CT 评分和CONUT 评分(Z=2.152、2.087,均P<0.05),而Helsinki CT 评分与CONUT 评分比较差异无统计学意义(Z=0.190,P>0.05)。见图1。

图1 Helsinki CT 评分、CONUT 评分及其联合使用判断预后不良的ROC 曲线
3 讨论
每年我国约60 万人发生TBI,病死率约为13/10万,造成的经济损失超过5 亿美元[8]。sTBI 患者病情危急、进展迅速,预后更差,病死率高达30%~50%。目前临床评估TBI 预后主要使用GCS 评分、颅内压监测等,但GCS 评分易受外界因素干扰;颅内压监测属于有创操作,易增加患者感染风险,且入院早期无法直接使用[9-10]。因此,寻找适合早期判断sTBI 患者预后不良的预测指标,对于改善患者临床结局至关重要。
有研究发现,头颅CT 影像学异常表现与TBI 发生呈正相关,其阳性预测率可达70%,且基于异常影像学特征建立的CT 评分与TBI 发生、脑组织损伤程度存在相关性[6]。对比GCS 评分,CT 评分不受患者镇静、插管等因素影响;对比颅内压监测,CT 评分属于无创评估,对患者无潜在危害。Helsinki CT 评分是基于Marshall CT 评分和Rotterdam CT 评分的进一步完善,更侧重观察TBI 类型,包括硬膜下/外血肿、脑内血肿、血肿体积、脑室内出血以及鞍上池状态。Raj 等[6]研究显示,Helsinki CT 评分预测TBI 患者6 个月预后的价值优于Marshall CT 评分和Rotterdam CT 评分。范国锋等[11]调查显示,Helsinki CT 评分纳入的6 项影像学特征均与TBI 患者6 个月病死率存在关联性,其中鞍上池消失与预后的关联性最强。本研究基于PSM 法,将年龄、蛛网膜下腔出血等可能影响预后的因素量化为倾向性评分,降低组间混杂偏倚和选择偏倚[12],客观评价Helsinki CT 评分与sTBI 患者预后的关系。结果显示,死亡组患者Helsinki CT 评分明显高于存活组,Helsinki CT 评分是影响sTBI 患者预后的独立预测因素。ROC 曲线分析显示,Helsinki CT 评分判断预后不良的AUC 为0.735,最佳截断值为7 分,灵敏度为0.604,特异度为0.771,提示Helsinki CT 评分判断sTBI 患者预后不良的准确度较高,但该方法灵敏度相对较低,临床运用时应注意假阴性问题。
目前临床上常用BMI、白蛋白评估患者营养状况,但危重症患者营养状态异常并不会即刻引起BMI 变化,单一的白蛋白水平易受其他因素影响,波动较大。CONUT 评分是国外常用的复合型营养评估工具,该评分通过检测患者血清白蛋白、TC 及淋巴细胞计数水平,将其量化为免疫营养评分,从而客观、准确的反映机体免疫营养状态。有研究显示,术前CONUT 评分是髋部骨折患者术后1 个月、1 年预后不良的独立预测指标[13-14]。此外,CONUT 评分与肿瘤、心肌梗死患者预后也存在相关性[15-16]。目前国内CONUT 评分与TBI患者预后研究鲜有报道。有调查发现,CONUT 评分纳入分析的白蛋白、TC 及淋巴细胞计数均与TBI 患者预后存在关联性。Brenard 等[17]研究发现,sTBI 患者极早期白蛋白水平低于正常值,低蛋白血症是影响预后的独立危险因素。此外,有研究发现,血清TC 水平下降、T 淋巴细胞亚群线粒体损伤程度可作为判断TBI严重程度及预后的预测指标[18-19]。以此推测,CONUT评分可能对sTBI 患者预后具备一定的预测价值。本研究结果显示,经PSM 后,死亡组患者CONUT 评分明显高于存活组,CONUT 评分是影响预后的独立危险因素。ROC 曲线分析显示,CONUT 评分判断sTBI 患者预后不良的AUC 为0.721,最佳截断值为5 分,灵敏度为0.688,特异度为0.646,提示CONUT 评分判断sTBI 患者预后不良准确度较高。
临床上认为,当AUC 高于0.700 时,提示筛选试验预测准确度较好。近年来,研究发现多指标联合使用能够明显改善筛选试验预测效能。本研究利用logistic模型构建联合使用回归方程,分析两种评分联合使用判断预后不良的预测效能。结果显示,两种评分联合使用判断sTBI 患者预后不良的AUC 为0.814,灵敏度、特异度均为0.750。联合使用判断sTBI 患者预后不良的AUC 大于Helsinki CT 评分、CONUT 评分,Helsinki CT评分与CONUT 评分AUC 的差异无统计学意义,提示联合使用的预测效能优于单独评分。此外,与单独评分比较,两种评分联合使用将灵敏度提升至0.750,特异度与Helsinki CT 评分接近,联合使用灵敏度、特异度均处于较高水平。
综上所述,Helsinki CT 评分和CONUT 评分是影响sTBI 患者28 d 预后的独立危险因素,两种评分系统联合使用预测效能更高。但本研究属于单中心、小样本、回顾性研究,今后需要进一步开展多中心、大样本、队列研究来验证本研究结论的可靠性。

