胎鼠真皮间充质干细胞对小鼠巨噬细胞极化的影响
夏震宇 龚思宇 王晓川 姜笃银 单菲 赵洁
[摘要]目的:探究胎鼠真皮间充质干细胞(Fetal mice dermal mesenchymal stem cells, FDMSCs)对M1/2型巨噬细胞极化的影响。方法:本研究提取FDMSCs,利用脂多糖(Lipopolysaccharide,LPS)、γ干扰素(Interferon-γ,IFN-γ)刺激RAW 264.7诱导为M1型巨噬细胞,利用白细胞介素4(Interleukin-4,IL-4)刺激RAW264.7诱导为M2型巨噬细胞,并建立了FDMSCs-RAW 264.7共培养体系。共培养24 h后,收集巨噬细胞,用实时定量PCR和流式细胞学检测M1/2型巨噬细胞特征性因子白细胞介素6(Interleukin-6,IL-6)、诱导性一氧化氮合酶(Inducible nitric oxide synthase,iNOS)、CD86、白细胞介素10(Interleukin-10,IL-10)、精氨酸酶1(Arg-1)、CD206的表达变化。结果:FDMSCs使M1型巨噬细胞表达的IL-6、iNOS、CD86减少,IL-10、CD206增多;使M2型巨噬细胞表达的IL-10、Arg-1、CD206表达增多,iNOS表达减少。结论:FDMSCs可以通过调控巨噬细胞极化来调控伤口愈合,对于探索FDMSCs在创面治疗过程中的免疫调节机制有积极意义。
[关键词]胎鼠;真皮間充质干细胞;巨噬细胞极化;M1/M2亚型;创面愈合;共培养
[中图分类号]R751 [文献标志码]A [文章编号]1008-6455(2023)09-0058-03
Effect of Fetal Dermal Mesenchymal Stem Cells on Mouse Macrophage Polarization
XIA Zhenyu1,GONG Siyu2,WANG Xiaochuan3,JIANG Duyin1,3,4,SHAN Fei4,ZHAO Jie4
(1.Cheeloo College of Medicine,Shandong University,Jinan 250012,School of Basic Medicine,Jining Medical College,Jining 272067,Shandong,China; 3.Department of Burns and Plastic Surgery,the Second Hospital of Shandong University,Jinan 250033,Shandong,China; 4.Department of Emergency,the Second Hospital of Shandong University,Jinan 250033,Shandong,China)
Abstract: Objective To investigate the effect of FDMSCs on the polarisation of M1/2 type macrophages. Methods In this study, RAW264.7 was induced into M1-type macrophages by stimulation with lipopolysaccharide (LPS) and gamma interferon (IFN-γ) and into M2-type macrophages by stimulation with interleukin 4 (IL-4), and a FDMSCs-RAW264.7 co-culture system was established. After 24 hours of co-culture, macrophages were harvested and changes in the expression of the characteristic factors interleukin 6 (IL-6), inducible nitric oxide synthase (iNOS), CD86, interleukin 10 (IL-10), arginase 1 (Arg-1) and CD206 in M1/2 type macrophages were detected by qRT-PCR and flow cytometry. Results FDMSCs decreased the expression of IL-6, iNOS and CD86 and increased the expression of IL-10 and CD206 in M1 macrophages; increased the expression of IL-10, Arg-1 and CD206 and decreased the expression of iNOS in M2 macrophages. Conclusion FDMSCs can regulate wound healing by modulating macrophage polarisation, which has positive implications for exploring the immunomodulatory mechanisms of FDMSCs in the process of wound treatment.
Key words: fetal mice; dermal mesenchymal stem cells; macrophage polarization; M1/M2 macrophage wound healing; coculture
间充质干细胞(Mesenchymal stem cells,MSCs)是一种具有多向分化能力和自我更新能力的祖细胞,可以从骨髓、脂肪、脐带血等多种组织中分离得到[1]。大量研究表明,MSCs具有强大的修复能力,既可以迁移至受损部位,通过自身的分化能力修复损伤;又可以通过释放参与创面愈合的细胞因子、趋化因子、生长因子等协助修复[1]。除分化功能外,MSCs还具有免疫调节功能,特别是对巨噬细胞表型和功能的调控。因此,MSCs成为治疗创面不良愈合、自身免疫和炎癥相关疾病的潜在工具[2]。FDMSCs是从孕15 d胎鼠真皮组织中提取的一种间充质干细胞,与其他成人间充质干细胞相比,具有更强的多向分化能力和更低的免疫原性,并且与胎儿期皮肤的无瘢痕愈合密切相关。课题组前期研究结果证实FDMSCs在促进创面愈合,血管再生方面都发挥着显著作用[3]。但有关FDMSCs在免疫调控方面的作用尚未见探索。巨噬细胞作为人体免疫细胞的重要组成部分,在伤口愈合的炎症、增殖和重塑期都发挥着关键作用,这种作用是通过由炎症型M1型巨噬细胞至抗炎型M2型巨噬细胞的表型转换实现的[4]。在一些难以愈合的慢性伤口中,M1型巨噬细胞群占据优势,导致创面长期处于炎症期,进而影响组织修复与重塑[5]。本次实验拟探究FDMSCs对巨噬细胞极化的调控作用以及对创面愈合的影响,对于进一步探索FDMSCs在创面治疗中的作用有着积极意义。
1 材料和方法
1.1 细胞提取和培养:FDMSCs提取自孕15 d BAL B/C小鼠背部真皮。孕鼠购自济南朋悦实验动物繁育有限公司。孕鼠购回后,按手术无菌操作取出胎鼠并切取背部皮肤。先用中性蛋白酶分离表皮与真皮,后用Ⅰ型胶原酶消化真皮组织,用70μm滤网滤出FDMSCs,与含有10%FBS的DMEM低糖培养基于5% CO2、37℃培养箱进行传代培养。RAW264.7(苏州海星生物公司)培养采用高糖DMEM培养基。传代培养3次后取对数生长期的细胞用于试验。
1.2 培养细胞鉴定
1.2.1 FDMSCs:课题组早期已完成FDMSCs的提取及鉴定,本次FDMSCs的提取与前期研究步骤相同[6]。
1.2.2 巨噬细胞:RAW 264.7为小鼠单核巨噬细胞白血病细胞,源自BAL B/c小鼠由Abelson鼠科白血病病毒诱导的肿瘤。购回后按常规方法,分别使用LPS、IFN-γ与IL-4将RAW 264.7诱导为M1,M2型巨噬细胞[7-8]。
1.3 FDMSCs与M1/M2型巨噬细胞共培养:使用0.4 μm小孔的transwell小室进行共培养实验。M1/2型巨噬细胞接种于下室,FDMSCs接种于上室。检测前共培养24 h。
1.4 流式细胞术:流式细胞术检测FDMSCs与RAW264.7的表面标志物。收集5×105个细胞并用PBS缓冲液重新悬浮,在黑暗中与特异性抗体孵育15 min。之后用PBS缓冲液洗涤细胞,并用流式细胞仪进行检测。
1.5 实时定量PCR:按试剂盒说明书要求从细胞中提取RNA并逆转录成cDNA,用SYBR Green探针检测mRNA的相对表达。通过ΔΔCt的方法计算mRNA表达。
1.6 统计学分析:使用GraphPad Prism 8进行统计分析。对每个结果进行3次或多次独立实验,并计算平均值和标准差,行单因素方差分析或t检验。P<0.05为差异具有统计学意义。
2 结果
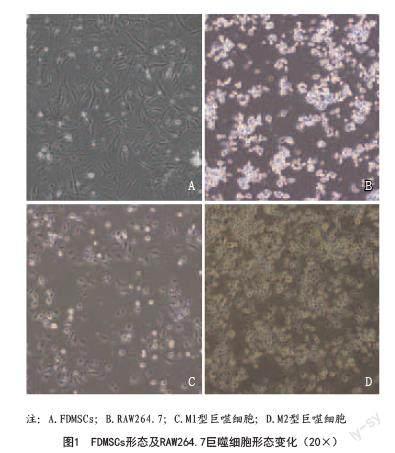
2.1 细胞形态学观察:提取的FDMSCs贴壁生长,细胞细长,呈现梭形或纺锤形(见图1A)。巨噬细胞RAW 264.7购回后,细胞贴壁生长,呈小卵圆形,折光性强,呈团簇状生长(见图1B)。用LPS和IFN-γ将RAW 264.7极化为M1表型。M1型巨噬细胞伸出特征性的伪足,呈棒状和放射状,细胞折光性减弱(见图1C);用IL-4将巨噬细胞极化为M2表型,M2型巨噬细胞体积增大呈椭圆形,胞质丰富(见图1D)。
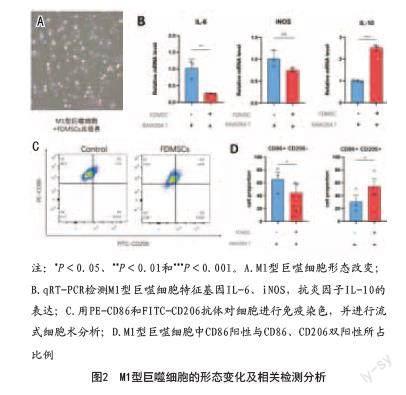
2.2 FDMSCs促进RAW 264.7由M1型向M2型转换:将FDMSCs与M1型巨噬细胞共培养24 h后,放射状、棒状巨噬细胞明显减少,细胞变圆,胞质增多(见图2A)。随后应用荧光定量PCR检测M1型巨噬细胞的特征促炎因子iNOS和IL-6的基因表达。结果表明,与对照组相比,与FDMSCs共培养的M1型巨噬细胞特征性因子iNOS与IL-6表达均显著降低,抗炎细胞因子IL-10升高(见图2B)。最后,使用流式细胞术检测CD86和CD206两种细胞标记物,结果显示代表M1极化水平的CD86表达降低,代表M2极化水平的CD206表达升高(见图2C、D)。以上实验结果表明,FDMSCs可以降低M1型巨噬细胞的极化水平,降低促炎因子IL-6和iNOS的表达水平,从而使巨噬细胞调控的炎症反应水平下降;同时FDMSCs可以促进IL-10表达水平的升高,促进M1型巨噬细胞向M2型的表型转换。
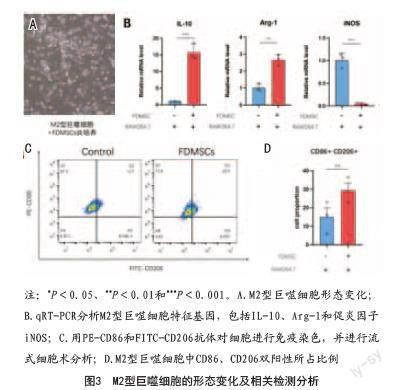
2.3 FDMSCs使M2型巨噬细胞进一步活化:将FDMSCs与M2型巨噬细胞共培养24 h后,M2型巨噬细胞形态变化不明显(见图3A)。随后,通过荧光定量PCR检测代表M2型巨噬细胞极化水平的特征性细胞因子IL-10和Arg-1,与对照组相比,FDMSCs干预后的M2型巨噬细胞IL-10和Arg-1的基因表达升高(见图3B)。最后,使用流式细胞术检测CD86和CD206两种细胞标记物,结果显示,相较于对照组,实验组中CD86表达降低,CD206表达升高(见图3C、D)。以上实验结果表明,FDMSCs可以增强M2型巨噬细胞的极化,增加M2型巨噬细胞特征性细胞因子IL-10和Arg-1的基因表达,进一步增强M2型巨噬细胞的抗炎作用。
3 讨论
在伤口愈合初期,具有促炎表型的(M1型)巨噬细胞表达高水平的CD86和PD-L1,分泌iNOS、TNF-α、IL-1β、IL-6等多种炎症介质参与炎症反应。随着组织修复阶段的开始,巨噬细胞群转换为抗炎表型(M2)型,表达高水平的CD206、Arg-1、FIZZ1,分泌TGF-β、IL-1受体拮抗IL-10等抗炎细胞因子[10]。在组织重塑阶段,巨噬细胞还可以释放基质金属蛋白酶(MMPs)以分解临时细胞外基质,并在成纤维细胞的参与下共同推动基质的重塑和胶原沉积,这一过程在伤口闭合后还会持续一段时间[9]。在愈合过程中,MSCs与巨噬细胞共同定位于伤口附近,并将巨噬细胞极化为M2表型,从而发挥促进创面愈合的作用。例如骨髓间充质干细胞,可以通过减少炎症细胞的浸润,减少IL-6和TNF-α的表达,增加IL-10的表达,以达到促进创面愈合的效果。有研究证实了MSCs通过调控巨噬细胞的极化,在心肌修复和减轻急性肾损伤后的纤维化都发挥着关键作用[11-12]。
作为一种从胎鼠真皮中提取的间充质干细胞,FDMSCs具有较低的免疫原性和较好的生物相容性;其来源于真皮,在皮肤创面修复过程中可能更好的发挥原位作用;还是参与无瘢痕愈合的关键细胞。前期研究结果已证实了FDMSCs在血管再生、创面修复、治疗瘢痕疙瘩方面都有着积极作用。然而,FDMSCs对于巨噬细胞的免疫调控作用还没有相关研究。
本研究利用Transwell共培养體系,通过荧光定量PCR和流式细胞学检测,发现在FDMSCs干预下,M1型巨噬细胞特征性因子IL-6和iNOS表达降低,M2型巨噬细胞特征性因子IL-10和Arg-1表达升高;M1/2型巨噬细胞表面标记物CD86表达降低,CD206表达升高。实验结果表明FDMSCs在诱导巨噬细胞极化方面可以促进M1型巨噬细胞向M2型转换,并使M2型巨噬细胞进一步活化,从而在伤口愈合早期发挥对炎症的抑制作用以及后期促进组织修复的作用,为进一步研究FDMSCs通过对巨噬细胞的免疫调节进行创面治疗奠定了基础。
[参考文献]
[1]Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease[J].Nat Rev Immunol,2008,8(9):726-736.
[2]Zheng G,Ge M,Qiu G,et al.Mesenchymal stromal cells affect disease outcomes via macrophage polarization[J].Stem Cells Int,2015,2015:989473.
[3]Pan Y,Jiang D Y.Research advances on the application of fetal dermal mesenchymal stem cells in burn wound treatment[J]Zhonghua Shao Shang Za Zhi,2021,37(1):86-89.
[4]Mosser D M,Edwards J P.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8(12):958-969.
[5]Zhao R,Liang H,Clarke E,et al.Inflammation in chronic wounds[J].Int J Mol Sci,2016,17(12):2085.
[6]Jiao Y,Wang X,Zhang J,et al.Inhibiting function of human fetal dermal mesenchymal stem cells on bioactivities of keloid fibroblasts[J].Stem Cell Res Ther,2017,8(1):170.
[7]Ti D,Hao H,Tong C,et al.LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].J Transl Med,2015,13:308.
[8]Gao S,Mao F,Zhang B,et al.Mouse bone marrow-derived mesenchymal stem cells induce macrophage M2 polarization through the nuclear factor-κB and signal transducer and activator of transcription 3 pathways[J].Exp Biol Med (Maywood),2014,239(3):366-375.
[9]Wynn T A,Vannella K M.Macrophages in tissue repair, regeneration, and fibrosis[J].Immunity,2016,44(3):450-462.
[10]Murray P J.Macrophage polarization[J].Annu Rev Physiol,2017,79:
541-566.
[11]Wang M,Zhang G,Wang Y,et al.Crosstalk of mesenchymal stem cells and macrophages promotes cardiac muscle repair[J].Int J Biochem Cell Biol,2015,58:53-61.
[12]Wise A F,Williams T M,Kiewiet M B,et al.Human mesenchymal stem cells alter macrophage phenotype and promote regeneration via homing to the kidney following ischemia-reperfusion injury[J].Am J Physiol Renal Physiol,2014,306(10):F1222-1235.
[收稿日期]2023-02-21
本文引用格式:夏震宇,龚思宇,王晓川,等.胎鼠真皮间充质干细胞对小鼠巨噬细胞极化的影响[J].中国美容医学,2023,32(9):58-60,77.

