人参皂苷Rg5通过诱导凋亡抑制原发性肝癌小鼠肿瘤生长
屈琳琳,刘彦楠,范代娣
(西北大学化工学院,陕西 西安 710069)
肝癌是全球范围内最常见和最具侵袭性的恶性肿瘤之一,也是癌症相关死亡的主要原因之一[1],其中,肝细胞癌(hepatocellular carcinoma,HCC)是最常见的类型,约占所有肝癌患者的90%。HCC造成了巨大的疾病负担,在全球许多地区是癌症相关死亡的第四大原因。尽管在高风险人群中实施了监测和合理治疗策略,对预防HCC和降低总体死亡率显示出一定效果,但在许多国家,HCC的发病率和特异性死亡率仍在上升。因此,寻找安全、高效抗HCC药物迫在眉睫。
人参是一种生长缓慢的多年生植物,属于五加科人参属。它含有复杂的化学成分,这些成分的组成因使用的物种、产地和生长条件而异[2]。人参在中国有悠久的应用历史。经过检测,人参含有多种生物活性物质,如人参皂苷、维生素、挥发油、类黄酮、氨基酸和多糖等[3-4]。人参皂苷是人参中最主要的生物活性成分,是一类特定类型的三萜类皂苷,几乎只存在于人参中。目前已从人参不同部位分离出150多种天然存在的人参皂苷[5]。在肝癌中,人参皂苷Rd和Rh2已被证明能够抑制肿瘤的转移和侵袭[6],而稀有人参皂苷Rg5对HCC的抑制尚未见报道。
因此,本文以二甲基亚硝胺和四氯化碳诱导的原发性肝癌小鼠为模型,探究人参皂苷Rg5抑制HCC生长的效果及其作用机制,以期为新型抗HCC药物的研发提供科学依据及基础。
1 材料与方法
1.1 试剂
人参皂苷Rg5,西安巨子生物基因技术股份有限公司,其分子结构式如图1所示。二甲基亚硝胺(DEN)、四氯化碳(CCl4)、二甲基亚砜(DMSO)和PEG300,美国Sigma公司;注射用橄榄油、吐温80、索拉非尼(Sorafeinib),上海阿拉丁生化科技股份有限公司;H&E染色试剂盒,北京索莱宝科技有限公司;谷丙转氨酶(ALT)、谷草转氨酶(AST)、透明质酸(HA)和甲胎蛋白(AFP)酶联免疫试剂盒,上海酶联生物科技有限公司;Tunel荧光试剂盒,上海碧云天生物技术有限公司;Bax、c-Casp 3、c-PARP和GAPDH抗体,北京博奥森生物技术有限公司。
图1 人参皂苷Rg5结构式Fig.1 Structure of ginsenoside Rg5
1.2 仪器
ES-VM25型漩涡混匀仪,翌圣生物科技(上海)股份有限公司;DW-86L388J型超低温冰箱(-80 ℃),青岛海尔集团;TS2型显微镜,日本尼康公司;Sub-Cell GT型电泳仪、Trans-Blot Turbo型全能型蛋白快速转膜仪,Bio-Rad公司。
1.3 试剂配制
注射/灌胃用溶剂:DMSO、PEG300、吐温80和生理盐水按照体积比为1∶8∶1∶10配比进行配制。以40 mL为例,取2 mL的DMSO、20 mL的生理盐水、2 mL的吐温80和16 mL的PEG300,加入离心管内,并放置于超声波清洗机中辅助混匀。每只小鼠灌胃0.2 mL。
1.4 模型建立
40只体质量约为12~15 g的雄性C57BL/6J小鼠(江苏集萃药康生物科技有限公司)。将小鼠放置在洁净鼠笼内进行适应性喂养,并提供自由进食和饮水(该实验已获得西北大学动物伦理委员会批准,批准号为NWU-AWC-20200813M)。
经过一周的适应性喂养后,将小鼠随机分为4组,每组10只,分为以下组别:正常组(Normal)、原发性肝癌模型组(Model)、100 mg/kg人参皂苷Rg5组(Rg5)和100 mg/kg索拉非尼组(Sorafenib)。参照文献[7]的相关方法,建立原发性肝癌小鼠模型。
首先,除正常组外,其余3组小鼠单次腹腔注射1 mg/kg DEN,正常组小鼠注射PBS溶液。然后,经过6周后,除正常组外,其余3组小鼠每周腹腔注射0.2 mL/kg CCl4,每周2次,正常组小鼠注射橄榄油。据文献[7]的方法判定,经过14周即可成功建立原发性肝癌小鼠模型[7]。最后,给药组每天分别以100 mg/kg人参皂苷Rg5和索拉非尼灌胃,而模型组则接受灌胃溶剂处理。动物实验处理流程如图2所示。

图2 实验处理过程Fig.2 Experimental processing
实验结束后,将小鼠称质量后,迅速脱颈处死,眼眶取血,解剖取小鼠肝脏组织进行拍照,取肝脏组织置于10%中性福尔马林内用于切片染色。
1.5 血液生化指标检测
将实验结束后收集的小鼠血液室温静置2 h后离心机内离心,离心结束后,可观察到离心管内血液出现分层,上层为血清样本,用移液枪小心移取血清样本于新离心管内,置于-80 ℃冰箱保存。对于小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、透明质酸(HA)和甲胎蛋白(AFP)等生化指标含量,按照试剂盒说明书进行检测。
1.6 组织切片染色
进行动物实验后,脏器固定48 h。使用乙醇去除水分,透明化组织。石蜡包埋后切片。对切片进行脱蜡、染色(H&E和免疫组化)和封片处理。切片风干后观察和拍照。
对组织切片进行脱蜡、抗体处理和荧光染色。切片风干后观察和拍照。
1.7 蛋白质免疫印迹实验
取冷冻的肝脏组织,冷冻后研磨成粉末。加入Radio-Immunoprecipitation Assay (RIPA)裂解液裂解并离心。检测蛋白浓度,保存剩余样品。制备聚丙烯酰胺凝胶电泳,倒入制胶槽中并凝固。配制浓缩胶缓冲液,倒入制胶槽中并凝固。清洗凝胶后装入电泳装置,进行电泳。冲洗凝胶并转膜至PVDF膜。封闭膜,加入一抗和二抗。显影并分析蛋白条带灰度。
1.8 数据分析
数据显示为平均值±方差。使用SPSS软件19.0版(SPSS Inc.)分析各组间显著性差异。不同的字母表示具有显著性差异(P<0.05)。
2 结果与讨论
2.1 Rg5对原发性肝癌小鼠肿瘤生长的影响
DEN和CCl4诱导的原发性肝细胞癌模型已被广泛用来研究纤维化和肝细胞癌发展的分子机制,并试验新型药物的治疗效果。
首先,分析小鼠肝脏的肿瘤结节变化情况,结果见图3(a)。由图3(a)可知:与正常组相比,Model组观察到明显的大量肿瘤结节,而人参皂苷Rg5和索拉非尼给药在宏观上明显减少了肝脏中的肿瘤结节数量。
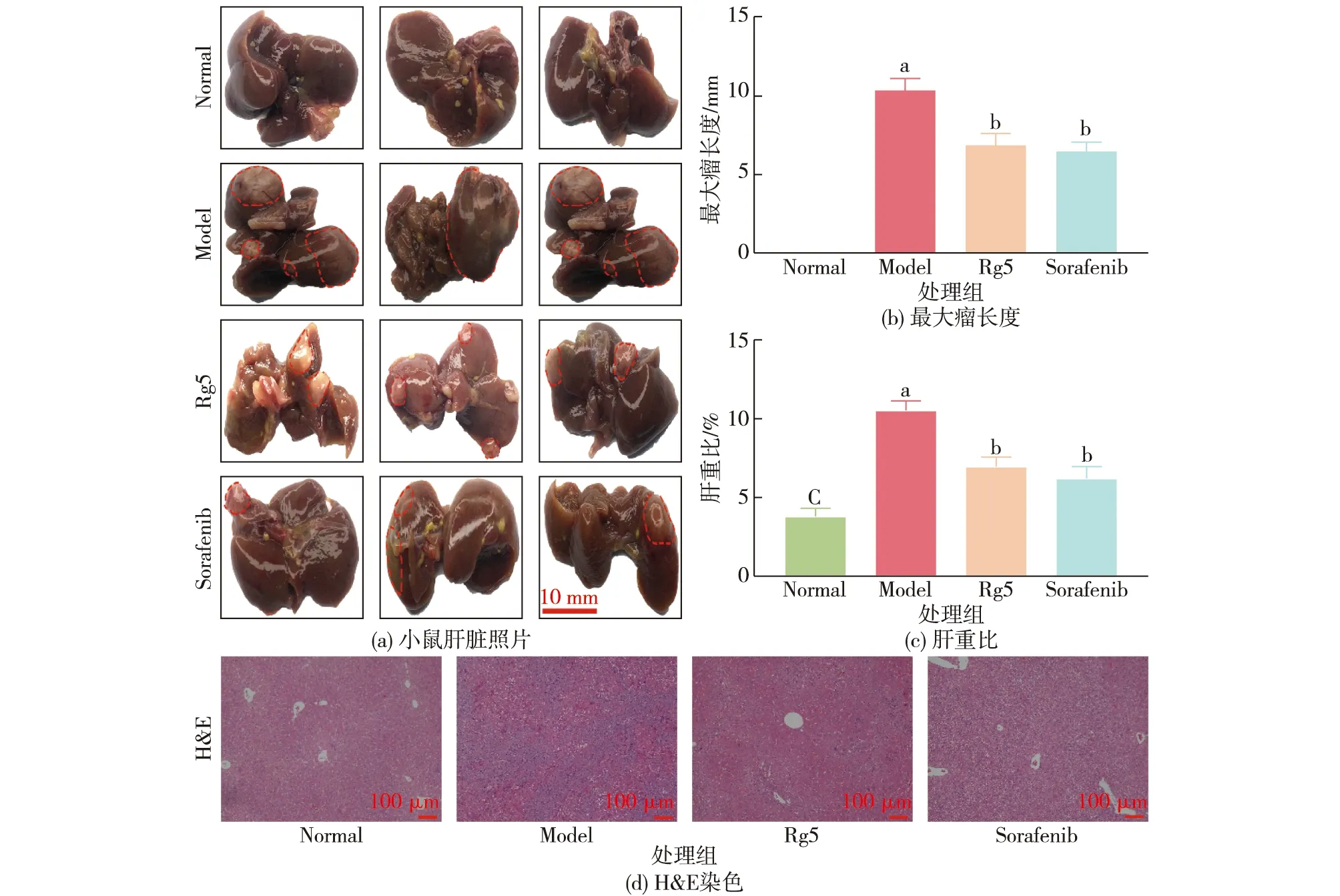
字母不同表示显著差异(P<0.05),n=3图3 人参皂苷Rg5对原发性肝癌小鼠肝脏肿瘤生长的影响Fig.3 Effects of ginsenoside Rg5 on the growth of liver tumor in mice with primary liver cancer
接着,测小鼠肝脏上最大瘤长度变化,结果见图3(b)。由图3(b)可知:Model组、Rg5组和Sorafenib组的最大瘤长度平均值分别为10.37、6.87和6.46 mm。经人参皂苷Rg5处理后,小鼠肝脏表面的最大肿瘤直径明显减少(P<0.05)。
然后,分析小鼠肝脏/体质量比(肝重比)的变化,结果见图3(c)。由图3(c)可知:正常组、Model组、Rg5组和Sorafenib组的肝重比平均值分别为3.77%、10.56%、6.98%和6.20%。与正常组相比,Model组的肝重比有明显差异(P<0.05),但与Model组相比,人参皂苷Rg5和Sorafenib组的这一比值明显下降(P<0.05)。
最后,通过肝脏组织病理学染色来分析病理学特征,结果如图3(d)所示。由图3(d)可知:在Model组中,可观察到肝脏中有大量的肿瘤细胞浸润、肝脏纤维化和坏死,增殖细胞的形态和分布符合肝癌的组织病理学特征。而人参皂苷Rg5治疗大大减少了肿瘤细胞的浸润,HCC细胞增殖明显减少。
2.2 Rg5对原发性肝癌小鼠肿瘤细胞增殖的影响
Ki-67是细胞增殖的一个典型标志蛋白,因此对小鼠肝脏进行了Ki-67免疫组化染色,结果见图4。由图4可知:与正常组相比,Model组可观察到大量的增殖细胞呈棕黄色,表明Model组中小鼠肝脏内HCC细胞增殖较活跃;而在Rg5和Sorafenib组中,可观察到HCC小鼠肝脏癌细胞增殖被抑制,表明小鼠肝脏的Ki-67蛋白表达明显降低。

图4 原发性肝癌小鼠肝脏Ki-67免疫组化染色Fig.4 Ki-67 immunohistochemical staining of liver in mice with primary liver cancer
2.3 Rg5对原发性肝癌小鼠肝损伤、肝纤维化和肝硬化的影响
为了研究人参皂苷Rg5对HCC引起的肝损伤的影响,分别评估了小鼠血清中两种可以反映肝损伤的主要转氨酶(ALT和AST)的表达水平。小鼠血清ALT结果如图5(a)所示。由图5(a)可知:正常组、Model组、Rg5和Sorafenib组的血清ALT含量平均值分别为12.68、31.50、21.30和38.51 U/L。

字母不同表示显著差异(P<0.05),n=3图5 人参皂苷Rg5对原发性肝癌小鼠肝损伤、肝纤维化和肝硬化的影响Fig.5 Effects of ginsenoside Rg5 on liver injury,liver fibrosis and cirrhosis in mice with primary liver cancer
小鼠血清AST结果如图5(b)所示。由图5(b)可知:正常组、Model组、Rg5和Sorafenib组的血清AST含量平均值分别为20.64、37.17、27.44和46.53 U/L。与正常组相比,Model组的小鼠血清和肝脏中的ALT和AST水平较高(P<0.05),人参皂苷Rg5预处理使HCC小鼠血清转氨酶含量显著降低,而Sorafenib组含量显著升高,这些数据表明人参皂苷Rg5可以改善HCC小鼠肝损伤。
众所周知,肝纤维化的严重程度与HCC的风险呈正相关关系。HA作为基质成分之一,可以准确而敏感地反映肝脏中产生的纤维数量和肝细胞的损伤情况[8]。因此,接下来通过HA试剂盒评估了血清中HA的浓度。小鼠血清HA结果如图5(c)所示。由图5(c)可知:正常组、Model组、Rg5和Sorafenib组的血清HA含量平均值分别为190.00、359.67、243.33和249.31 ng/mL。
作为肝癌三部曲之一的肝硬化,其具有很大的概率转变成为肝癌,因此对HCC小鼠的肝硬化水平进行检测。AFP作为临床HCC的血液标志物,可以反映肝硬化的程度。通过AFP试剂盒检测了血液中AFP含量,小鼠血清AFP结果如图5(d)所示。由图5(d)可知:正常组、Model组、Rg5和Sorafenib组的血清AFP含量平均值分别为69.00、122.67、80.06和64.96 ng/mL。与正常组相比,HCC小鼠血液中AFP显著增高(P<0.05),而人参皂苷Rg5有效地降低了血清的AFP水平(P<0.05)。
2.4 人参皂苷Rg5对原发性肝癌小鼠肝脏肿瘤细胞凋亡的影响
以Tunel实验来探究人参皂苷Rg5是否能诱导HCC的凋亡,结果如图6所示。由图6可知:与Normal组相比,Model组Tunel红色荧光强度几乎无变化,而人参皂苷Rg5组及Sorafenib组处理后可显著增强Tunel红色荧光强度,表明人参皂苷Rg5可以诱导HCC发生细胞凋亡。

图6 原发性肝癌小鼠肝脏肿瘤Tunel荧光染色Fig.6 Tunel fluorescence staining of liver tumors in mice with primary liver cancer
接下来通过Western blotting对凋亡相关蛋白(Bax、c-Casp3和c-PARP)进行了检测,具体结果如图7所示。由图7可知:与Model组相比,人参皂苷Rg5处理后,促细胞凋亡蛋白Bax、c-Casp3和c-PARP的表达在人参皂苷Rg5组均增高。
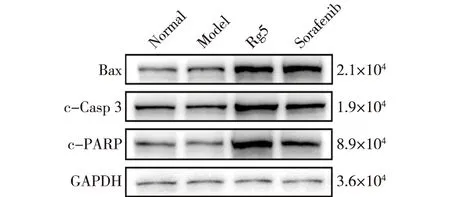
图7 原发性肝癌小鼠肝脏凋亡相关蛋白的Western blotting结果Fig.7 Western blotting results of liver apoptosis related proteins in mice with primary liver cancer
此外,对这3种蛋白表达进行了免疫组织化学染色,结果如图8所示。由图8可知:促凋亡相关蛋白Bax、c-Casp3和c-PARP在Model组小鼠肝脏中低表达。经过人参皂苷Rg5治疗后,与Model组相比,促凋亡相关蛋白Bax、c-Casp3和c-PARP蛋白表达显著增高。这些数据表明,人参皂苷Rg5可以在体内动物模型中诱导HCC细胞凋亡。
HCC被认为是慢性肝脏疾病的严重并发症,特别是晚期肝脏纤维化和/或肝硬化。大约80%~90%的HCC患者有肝纤维化或肝硬化[12]。因此,肝纤维化和肝硬化是导致HCC发生的危险因素。本文对小鼠血液中HA和AFP进行分析后发现,人参皂苷Rg5可以显著改善HCC小鼠肝纤维化和肝硬化症状。
细胞凋亡是一种高度调控的细胞死亡机制,在平衡细胞增殖和细胞分化信号途径中起着核心作用[13]。在细胞凋亡过程中,Bcl-2家族的促凋亡蛋白成员,如Bax、c-Casp 3和c-PARP经过蛋白质加工和修饰,引起其他促凋亡因子如凋亡诱导因子的释放,导致细胞凋亡[14]。本文的研究结果表明,补充人参皂苷Rg5后,促凋亡蛋白的表达增加,这表明人参皂苷Rg5通过诱导肝脏肿瘤细胞的凋亡抑制HCC增殖。
2.5 讨论
HCC是全世界癌症相关死亡的第四大因素。HCC在早期是没有症状的,这就是为什么80%的患者在中晚期才被诊断出来。晚期HCC患者的死亡率高达80%,中位生存期不到1年,5年生存率不到20%[9]。在过去的几十年里,被FDA批准的药物——索拉非尼,一直被用于治疗中晚期HCC患者。然而,大多数晚期HCC患者由于生存期短,不能从这种疗法中长期受益。同时,其他疗法,如肝移植,由于HCC术后复发和转移,大大影响了肝移植的疗效[10]。因此,寻找治疗HCC的新策略很重要。在这项研究中,探究了人参皂苷Rg5抑制HCC生长的机制。
索拉非尼是第一个被批准用于治疗晚期HCC疾病患者的系统性疗法,但它存在严重的毒副作用,包括肝毒性、白细胞减少、中性粒细胞减少、胃肠道和皮肤毒性,这在临床实践中很常见[11]。本文的结果显示,通过测量小鼠的血液中肝功能指标,人参皂苷Rg5在体内动物研究中改善了HCC小鼠肝损伤,而索拉非尼对HCC小鼠造成了更严重的肝损伤。
3 结论
人参皂苷Rg5不仅可以显著抑制原发性肝癌小鼠肝脏肿瘤的生长,而且还能显著改善了HCC小鼠肝损伤、肝纤维化和肝硬化症状。从作用机制来看,人参皂苷Rg5通过诱导凋亡作用来抑制HCC增殖。

