中性粒细胞来源MMP-8对腐皮镰刀菌性角膜炎的组织损伤作用及其机制
董军璐 金鑫 刘华 简守珺 岳娟 张红敏 王丽娅
河南省人民医院眼科 河南省立眼科医院 河南省眼科研究所 河南大学人民医院 郑州大学人民医院,郑州 450003
真菌性角膜炎(fungal keratitis,FK)是一种由致病真菌引起的感染性角膜炎,该病致盲率高,为我国常见的难治性致盲眼病[1]。FK的治疗目前大多依赖于局部抗真菌药物。然而,由于抗真菌药物相对分子质量大且渗透性差,严重的FK药物控制效果欠佳,预后不良,大多数患者遗留下中度或重度视力障碍,约25%的患眼仍需进行复杂的手术,且手术成功率较低[2-3]。中性粒细胞在抗真菌感染方面发挥重要作用。研究发现,在真菌感染早期,角膜内募集的中性粒细胞达90%以上,是FK早期主要的免疫细胞[4-5]。角膜真菌感染后中性粒细胞迅速从角膜缘血管游出并在感染部位浸润,以杀灭真菌并使病灶局限[6]。然而,中性粒细胞在杀菌的同时,还通过释放蛋白水解酶、活性氧和氮对组织造成损伤[7]。基质金属蛋白酶(matrix metalloproteinase,MMP)是中性粒细胞释放的蛋白酶中的一类。MMP-8是MMP家族胶原酶的一种,可降解Ⅰ、Ⅱ、Ⅲ型胶原[8],不仅可以辅助中性粒细胞迁移,还参与组织的损伤过程[9-10]。目前对MMP-8调节先天免疫作用的研究主要集中在肿瘤、癌症以及肺部、血管等炎症相关性疾病[7],FK角膜组织破坏方面的研究不多,对其作用机制知之甚少。AMP依赖的蛋白激酶(adenosine 5-monophosphate-activated protein kinase,AMPK)是一种高度保守的蛋白激酶,主要以异源三聚体复合物的形式存在于真核细胞中。以往AMPK信号通路作为调节能量代谢的途径而备受关注,O'Neill等[11]研究发现,AMPK信号通路在感染和免疫炎症性疾病中也发挥重要作用,但其在FK中的作用尚不清楚。FK的致病菌主要有丝状真菌和酵母样真菌2种类型,其中丝状真菌中的镰刀菌是我国FK的主要致病菌[12-13],在FK的发生和发展过程中具有一定的代表性。本研究拟探讨中性粒细胞来源MMP-8对FK角膜组织破坏的作用机制,为避免患眼角膜组织的损害提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物及外周血、菌种来源 SPF级6~8周龄雄性C57BL/6J小鼠108只,购自南京大学模式动物研究所,经眼科检查均无眼疾。实验小鼠按每笼6只饲养,饲养室内温度保持在22~26 ℃,湿度40%~60%,每日光照与黑暗时间各12 h。实验动物的饲养及使用均遵照ARVO声明,遵循国家科学技术委员会颁布的《实验动物质量管理办法》要求,研究方案经河南省眼科研究所实验动物伦理委员会批准(批文号:HNEECA-2017-04-02)。选取健康成人志愿者1名,采集外周静脉血5 ml,研究方案经河南省立眼科医院医学研究伦理委员会审批[批文号:HNEECKY-2019(16)号]。腐皮镰刀菌(编号:3.5840)购自中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2主要试剂及仪器 兔抗小鼠Phospho-AMPKα(Thr172)抗体、兔抗小鼠AMPKα(D5A2)抗体(美国CST公司);兔抗小鼠MMP8抗体(英国Abcam公司);兔抗小鼠GAPDH抗体(杭州贤至生物科技有限公司);羊抗兔IgG-HRP标记二抗、重组 MMP-8蛋白(美国R&D公司);Alexa fluor 488标记PEG生物素二抗(美国Jackson公司);DAPI(美国Invitrogen公司);Acadesine、二盐酸盐化合物 C(美国MCE公司);BCA法蛋白浓度测定试剂盒、组织裂解液(北京索莱宝科技有限公司);ECL发光液(美国Millipore公司);小鼠眼球固定液(北京康为试剂公司);脱脂奶粉(美国BD公司);羟脯氨酸测定试剂盒(南京建成生物工程研究所)。裂隙灯显微镜(SLM-8E,重庆康华瑞明科技股份有限公司);体视解剖显微镜(OMS-90,日本Topcon公司);正置荧光显微镜(美国Olympus公司);电泳仪、化学发光仪(美国Bio-Rad公司)。
1.2 方法
1.2.1FK小鼠模型制作 所有小鼠腹腔内注射80 mg/kg戊巴比妥钠进行全身麻醉,并采用1%盐酸丁卡因滴眼液点右眼进行角膜表面麻醉,麻醉后将小鼠置于解剖显微镜下进行FK模型制作,具体制作方法参照文献[4]。
1.2.2腐皮镰刀菌复苏和传代 腐皮镰刀菌复苏和传代方法参照文献[14]中描述的方法。4 ℃保存的镰刀菌转种至葡萄糖马铃薯琼脂培养基,置于26~28 ℃培养箱内生长7 d,转种至葡萄糖马铃薯液体培养基于26~28 ℃培养箱内生长,取培养5~7 d的菌丝用于实验。
1.2.3实验分组及模型眼炎症评分 造模后12 h于裂隙灯显微镜下对小鼠模型眼进行FK炎症评分,并根据炎症评分将小鼠分为12 h、24 h、48 h、72 h模型组,每组27只小鼠27眼,再分别于24、48和72 h在裂隙灯显微镜下对小鼠模型眼进行炎症评分,采用过量麻醉方法处死各组小鼠。参照文献[15]中描述的方法对FK模型眼进行炎症评分,总评分为各项评分之和。(1)病灶面积 占角膜总面积1%~25%为1分;占角膜总面积26%~50%为2分;占角膜总面积51%~75%为3分;占角膜总面积76%~100%为4分。(2)角膜混浊度 角膜轻度雾状混浊,瞳孔及虹膜清晰可见为1分;角膜浅层混浊,透过病灶可见瞳孔及虹膜为2分;角膜全层呈不均匀混浊为3分;均匀致密混浊为4分。(3)角膜水肿为1分。(4)前房积脓 少量积脓,未及旁中央为1分;大量积脓,达角膜旁中央为2分。(5)角膜病灶表面粗糙和隆突为2分。(6)后弹力层膨出为3分。(7)角膜穿孔为4分。(8)角膜新生血管 新生血管面积占角膜总面积1%~50%为1分;新生血管占角膜总面积51%~100%为2分。(9)眼球肿胀明显,比正常眼球体积膨大为5分。(10)角膜溶解,眼球萎缩为6分。
1.2.4Western blot法检测FK小鼠角膜组织内目标蛋白相对表达量 每组分别取23只小鼠,冰上取角膜组织,浸泡于100 μl组织裂解液(内含蛋白酶抑制剂),剪碎角膜,充分研磨。离心半径8 cm,4 ℃条件下12 000 r/min离心10 min,取上清,蛋白变性后备用。聚丙烯酰胺凝胶90 V恒压电泳,湿转法转膜,将目标相对分子质量范围的硝酸纤维素膜进行免疫反应。将硝酸纤维素膜放入5%脱脂奶粉封闭液中,于摇床上室温下封闭1 h;去除封闭液,分别浸入MMP-8(1∶1 000)、AMPKα(1∶1 000)、Phospho-AMPKα一抗(1∶1 000),4 ℃孵育过夜;复温后用0.01 mol/L TBST洗3次,每次5 min;于HRP IgG二抗(1∶1 000)室温孵育1 h;用ECL显色液显色,置于化学发光仪中进行曝光,以GAPDH为内参。采用Quantity One软件进行灰度统计分析,目标蛋白相对表达量为目标蛋白灰度值与内参蛋白灰度值的比值。
1.2.5羟脯氨酸测定法检测角膜组织中羟脯氨酸质量分数 每组取2只未处理小鼠的角膜4只,按照1.2.4部分方法取角膜并修剪为直径2 mm大小。将角膜分为MMP-8组、缓冲液组和生理盐水组,取96孔板,每孔各加入1只角膜,按照分组分别添加100 μl活化的重组MMP-8、缓冲液和生理盐水,每组4个孔。将96孔板置在培养箱中于37 ℃、5% CO2条件下孵育24 h,采用羟脯氨酸测定试剂盒测定角膜中羟脯氨酸质量分数。
1.2.6苏木精-伊红染色法检测小鼠角膜组织中中性粒细胞数量 各时间点组分别取4只小鼠的4只眼球,室温下置于固定液内12 h以上,梯度乙醇脱水,石蜡包埋,5 μm厚切片并制成白片。各组分别取4张白片行苏木精-伊红染色,正置荧光显微镜下观察角膜样本中性粒细胞并拍照。采用ImageJ 软件计数各切片中性粒细胞数。
1.2.7免疫荧光染色法观察角膜组织中中性粒细胞与MMP-8蛋白的共定位表达 取小鼠48 h FK模型组白片切片1张(见1.2.6部分),脱蜡,浸泡于Tris-EDTA修复液内加热煮沸进行抗原修复。取出白片,滴加MMP-8一抗(1∶200)4 ℃孵育过夜,次日复温,浸入0.01 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次,每次5 min;再滴加Alexa fluor 488二抗(1∶1 000)室温孵育1 h,浸入0.01 mol/L PBS洗涤3次,每次5 min;滴加5 μg/ml DAPI室温孵育30 min,封片,正置荧光显微镜下观察并定位角膜组织中中性粒细胞和MMP-8蛋白的表达。MMP-8显示绿色荧光,中性粒细胞显示蓝色荧光。
1.2.8人中性粒细胞和腐皮镰刀菌孢子提取 将抽取的外周静脉血置于抗凝管内,1 300 r/min离心10 min,收集血细胞。加入红细胞裂解液,血液与红细胞裂解液体积比为1∶3;在Percoll密度梯度液(依次向15 ml离心管内缓慢加入4 ml 81% Percoll、3 ml 70% Percoll和4 ml 55% Percoll)上层加入白细胞悬液,1 700 r/min离心20 min,收集4 ml液面层的细胞,即中性粒细胞。以1倍PBS重悬,1 700 r/min离心5 min,收集沉淀物,加入RPMI-1640培养基重悬后计数。刮取真菌培养基上的腐皮镰刀菌菌落并溶于无菌生理盐水,过滤,1 700 r/min离心5 min,得到真菌孢子,光学显微镜下计数。
1.2.9体外腐皮镰刀菌孢子感染人中性粒细胞 将1.2.8中处理和获取的中性粒细胞分为4个组,阴性对照组为常规培养基培养的中性粒细胞,共培养组为中性粒细胞与孢子共培养,AICAR处理组和化合物C处理组分别向中性粒细胞和孢子共培养体系内加入p-AMPK蛋白酶激动剂AICAR或抑制剂化合物C。采用24孔板,按照分组分别依次添加培养基500 μl/孔、AICAR 500 μmol/L/孔或化合物C 10 μmol/L/孔、中性粒细胞5.0×105/孔和孢子5.0×105/孔,其中孢子在中性粒细胞培养30 min后加入,均于37 ℃、5% CO2条件下孵育4 h。

图1 各组小鼠模型眼裂隙灯显微镜下病灶表现 随着造模后时间的延长,角膜病灶面积逐渐扩大Figure 1 Slit lamp micrographs of cornea lesion in different groups Area of corneal lesions was progressively expended over time after modeling
1.2.10细胞免疫荧光染色法检测中性粒细胞中MMP-8的表达 取1.2.9中处理的细胞,以4%多聚甲醛固定,0.2% Triton透化,滴入2%牛血清白蛋白室温下封闭1 h,滴加MMP-8一抗(1∶200)4 ℃孵育过夜。次日复温,滴加0.01 mol/L PBS洗涤3次,每次5 min;再滴加荧光488二抗(1∶1 000)室温下孵育1 min,浸入0.01 mol/L PBS洗涤3次,每次5 min。滴加5 μg/ml DAPI室温下反应30 min,封片,正置荧光显微镜下观察并拍照,各组统一曝光强度和时间,每组随机拍下10个视野,采用ImageJ软件分析各组中性粒细胞中MMP-8表达的荧光强度。
1.3 统计学方法

2 结果
2.1 造模后不同时间组小鼠模型眼角膜病变情况及评分比较
造模后24 h组小鼠模型眼出现典型的菌丝苔被,随造模后时间延长病灶面积逐渐扩大,角膜混浊逐渐加重,并伴有前房积脓,造模后72 h 组42%的模型眼出现角膜穿孔(图1)。造模后12、24、48和72 h组模型眼角膜炎症评分分别为2(2,3)、6(5,6)、9(8,9)和12(12,14)分,总体比较差异有统计学意义(H=129.38,P<0.01),其中造模后24、48和72 h组炎症评分均明显高于12 h组,差异均有统计学意义(均P<0.001)。
2.2 造模后不同时间组角膜中MMP-8相对表达量比较
与造模前相比,造模后不同时间组MMP-8蛋白表达条带均明显增强,其中以造模后24 h组角膜中 MMP-8蛋白表达条带最强(图2A)。造模后0、12、24、48、72 h组角膜中MMP-8蛋白相对表达量分别为1.07±0.24、22.77±13.40、53.41±15.97、43.99±24.94和14.35±10.21,总体比较差异有统计学意义(F=9.89,P<0.01),其中造模后12、24和48 h 组MMP-8蛋白相对表达量明显高于0 h组,差异均有统计学意义(均P<0.01)(图2B)。模型眼角膜组织内MMP-8蛋白相对表达量与相应炎症评分呈中等强度正相关(rs=0.50,P<0.05)(图3)。

图2 造模后不同时间组小鼠角膜组织中MMP-8蛋白表达 A:不同时间组小鼠角膜组织中MMP-8蛋白表达电泳图 B:不同时间组小鼠角膜组织中MMP-8蛋白相对表达量量化比较 F=9.89,P<0.01.与造模后0 h组比较,aP<0.05(单因素方差分析,LSD-t 检验,n=5) MMP:基质金属蛋白酶;GAPDH:甘油醛-3-磷酸脱氢酶Figure 2 MMP-8 protein expression of modeling eyes at different time points following modeling A:Electrophoretogram of MMP-8 protein expression of modeling eyes at different time points B:Comparison of MMP-8 protein relative expression level in cornea among different time points F=9.89,P<0.01.Compared with 0 hour after molding,aP<0.05 (One-way ANOVA,LSD-t test,n=5) MMP:matrix metalloproteinase;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
2.3 未处理小鼠离体角膜MMP-8孵育后角膜中羟脯氨酸质量分数比较
缓冲液组、生理盐水组和MMP-8组角膜羟脯氨酸质量分数分别为(0.52±0.02)、(0.51±0.03)和(0.27±0.02)μg/mg,总体比较差异有统计学意义(F=156.63,P<0.01),其中MMP-8组角膜中羟脯氨酸质量分数明显低于缓冲液组和生理盐水组,差异均有统计学意义(均P<0.05)。
2.4 造模后不同时间组模型眼角膜组织中p-AMPK蛋白相对表达量比较及其与MMP-8蛋白表达量的相关性
随造模后时间的延长,小鼠模型眼角膜中p-AMPKα(Thr 172)蛋白相对表达量升高,造模后0、12、24、48、72 h组模型眼角膜中p-AMPKα(Thr172)/AMPKα值分别为0.61±0.40、0.82±0.36、1.04±0.64、1.13±0.60和1.09±0.58,总体比较差异有统计学意义(F=3.11,P<0.05),其中,造模后12 h组模型眼角膜中p-AMPKα(Thr 172)/AMPKα值与造模后0 h组相比,差异无统计学意义(P>0.05);造模后24、48和72 h组角膜中p-AMPKα(Thr 172)/AMPKα值明显高于0 h组,差异均有统计学意义(均P<0.05)(图4)。角膜中p-AMPKα(Thr 172)/AMPKα值与MMP-8蛋白相对表达量呈中等强度正相关(r=0.54,P<0.01)(图5)。

图4 造模后不同时间组小鼠角膜中p-AMPK蛋白表达比较 A:不同时间组小鼠角膜组织中p-AMPK蛋白表达电泳图 B:不同时间组小鼠角膜组织中p-AMPKα (Thr172)/AMPKα表达值比较 F=3.11,P<0.05.与造模后0 h组比较,aP<0.05(单因素方差分析,LSD-t检验,n=18) AMPK:AMP依赖的蛋白激酶;GAPDH:甘油醛-3-磷酸脱氢酶Figure 4 Comparison of p-AMPK expression in cornea among different time points following modeling A:Electrophoretogram of p-AMPK protein expression in cornea among different time points B:Comparison of relative expression levels of p-AMPKα (Thr172)/AMPKα protein in cornea among different time points F=3.11,P<0.05.Compared with 0 hour after molding,aP<0.05 (One-way ANOVA,LSD-t test,n=18) AMPK:adenosine 5-monophosphate-activated protein kinase;GAPDH:glyceraldehyde-3-phosphate dehydrogenase

图5 p-AMPKα(Thr 172)/AMPKα表达量与MMP-8表达量相关性分析 p-AMPKα(Thr 172)/AMPKα表达量与MMP-8表达量呈中等强度正相关(r=0.54,P<0.01)(Pearson线性相关分析,n=25) AMPK:AMP依赖的蛋白激酶;MMP:基质金属蛋白酶Figure 5 Correlation of p-AMPKα (Thr 172)/AMPKα expression with MMP-8 expression p-AMPKα (Thr 172)/AMPKα expression was moderately positively correlated with MMP-8 expression in cornea (r=0.54,P<0.01) (Pearson linear correlation analysis,n=25) AMPK:adenosine 5-monophosphate-activated protein kinase;MMP:matrix metalloproteinase
2.5 造模后不同时间组角膜中中性粒细胞数量比较
造模后12 h组模型眼角膜中即出现中性粒细胞,随造模时间延长,角膜内中性粒细胞逐渐增多(图6)。造模后0、12、24、48、72 h组角膜内中性粒细胞数量分别为(8±6)、(35±19)、(1 479±286)、(1 994±188)和(1 328±93)个/切片,总体比较差异有统计学意义(F=17.13,P<0.01),其中造模后24、48和72 h组角膜中中性粒细胞数量明显多于0 h组,差异均有统计学意义(均P<0.001)。模型眼角膜中中性粒细胞数量与炎症评分呈强正相关(rs=0.77,P<0.001),与MMP-8蛋白相对表达量呈中等强度正相关(r=0.56,P<0.05)(图7)。

图6 造模后不同时间组裂隙灯显微镜下角膜表现及病理组织学检查表现 随造模后时间延长及病情加重,角膜组织中中性粒细胞向数量增加并向角膜深层浸润 A:不同时间组裂隙灯显微镜下角膜病灶表现 B:不同时间组模型眼角膜组织学表现(HE ×200,标尺=100 μm) 方框内所示为角膜病灶区 C:角膜病灶区放大图(HE ×400,标尺=20 μm)Figure 6 Slit lamp microphotographs and histopathological findings of corneal lesions at various time points following modeling The inflammation of the corneas was gradually aggravated over the time,and the number of neutrophils was obviously increased A:Manifestation of corneal lesion under a slit lamp microscope at each time point B:The pathohistological findings of lesions (HE ×200,bar=100 μm) The corneal lesion was marked in square frame C:Magnified view of the corneal lesion (HE ×400,bar=20 μm)
2.6 MMP-8蛋白在角膜中性粒细胞中的表达及定位
MMP-8蛋白在角膜的中性粒细胞中呈阳性表达,呈绿色荧光,包绕中性粒细胞的分叶核,角膜中中性粒细胞呈蓝色荧光,可见绿色荧光与蓝色荧光重叠,即MMP-8蛋白与中性粒细胞表达高度共定位(图8)。
2.7 不同腐皮镰刀菌孢子感染处理组人中性粒细胞中MMP-8蛋白相对表达量比较
MMP-8蛋白在中性粒细胞中表达呈绿色荧光,AICAR处理组MMP-8蛋白表达荧光强度强于阴性对照组和化合物C处理组(图9)。阴性对照组、中性粒细胞与孢子共培养组、AICAR处理组和化合物C处理组人中性粒细胞中MMP-8蛋白表达荧光强度值分别为5 516 671±146 755、5 666 755±331 791、6 063 087±332 378和5 518 788±419 323,组间总体比较差异有统计学意义(F=12.75,P<0.01),其中AICAR处理组人中性粒细胞中MMP-8蛋白表达荧光强度值明显高于阴性对照组和化合物C处理组,差异均有统计学意义(均P<0.05)。
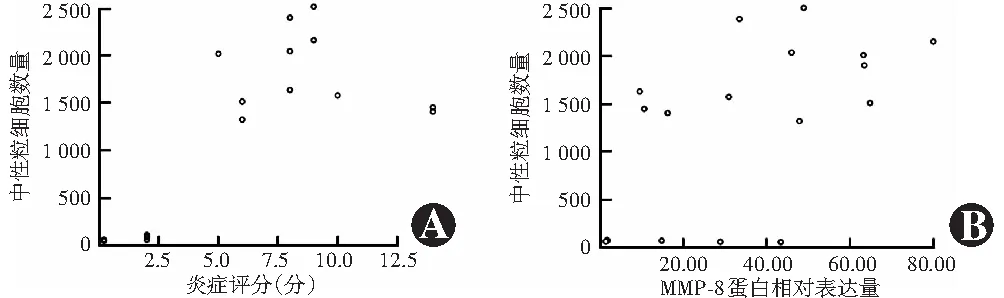
图7 模型眼角膜中性粒细胞数量与炎症评分或MMP-8蛋白相对表达量相关性分析 A:中性粒细胞数与炎症评分呈强正相关(rs=0.77,P<0.001)(Spearman秩相关分析,n=20) B:中性粒细胞数与MMP-8蛋白相对表达量呈中等强度正相关(r=0.56,P<0.05)(Pearson线性相关分析,n=20) MMP:基质金属蛋白酶Figure 7 Correlations of neutrophil count with inflammation score or MMP-8 protein expression A:Neutrophil count was positively correlated with inflammation score (rs=0.77, P<0.001) (Spearman rank correlation analysis,n=20) B:Neutrophil count was positively correlated with MMP-8 protein expression (r=0.56, P<0.05) (Pearson linear correlation analysis,n=20) MMP:matrix metalloproteinase

图8 MMP-8蛋白在角膜中性粒细胞中的表达情况 A:MMP-8蛋白表达包绕中性粒细胞分叶核,呈绿色荧光(Alexa fluor 488),中性粒细胞核呈蓝色荧光(DAPI)(×400,标尺=50 μm) B:荧光共定位分析拟合图 C:荧光共定位分析计算结果条图(Pearson_Rr=1,Overlap_R=1) MMP:基质金属蛋白酶;DAPI:二脒基苯基吲哚Figure 8 MMP-8 protein expression in neutrophils in the cornea A:MMP-8 encompassed neutrophil segmented nuclei,showing green fluorescence (Alexa fluor 488),and neutrophil nuclei presented blue fluorescence (DAPI) (×400,bar=50 μm) B:Fitted plot of fluorescence co-localization analysis C:Histogram of calculated results of fluorescence co-localization analysis (Pearson_Rr=1,Overlap_R=1) MMP:matrix metalloproteinase;DAPI:diaminidine phenyl indole

图9 各处理组人中性粒细胞中MMP-8蛋白表达的免疫荧光染色 MMP-8蛋白在人中性粒细胞的表达呈绿色荧光(Alexa fluor 488),人中性粒细胞核呈蓝色荧光(DAPI)(×200,标尺=100 μm) AICAR处理组MMP-8蛋白表达荧光强于阴性对照组和化合物C处理组 MMP:基质金属蛋白酶;DAPI:二脒基苯基吲哚Figure 9 Immunofluorescence staining of MMP-8 expression in human neutrophils nuclei MMP-8 expression showed green fluorescence (Alexa fluor 488) and human neutrophil nuclei presented blue fluorescence (DAPI) (×200,bar=100 μm) The fluorescence was stronger in AICAR-treated group than in negative control group and compound C-treated group MMP:matrix metalloproteinase;DAPI:diaminidine phenyl indole
3 讨论
正常角膜无血管、透明,是重要的屈光介质。角膜基质约占整个角膜厚度的90%,由绝大部分胶原纤维构成的细胞外基质和少量细胞组成。角膜胶原纤维的主要成分是Ⅰ型胶原,构成了角膜组织的主要骨架[16]。角膜的折光功能依赖于有序排列的胶原板层结构,有序胶原结构的破坏是角膜混浊的主要原因[17]。本课题组既往通过小鼠角膜MMP-8基质注射造模发现,注射眼角膜较对照眼明显混浊,证明MMP-8可直接降解角膜基质层胶原纤维造成基质破坏,导致角膜混浊[18],与本研究体外实验结果一致。正常角膜中无中性粒细胞,角膜真菌感染诱发中性粒细胞向角膜内迁移募集。研究表明,去除中性粒细胞的FK小鼠角膜内菌丝量较高,证明了中性粒细胞关键的杀菌作用,而去除中性粒细胞的FK小鼠角膜混浊程度、组织损伤程度较正常FK小鼠低,表明角膜组织混浊是中性粒细胞降解胶原蛋白破坏组织所致[19]。本研究也同样发现,FK小鼠感染早期,随着角膜内中性粒细胞数量的增多,其分泌的MMP-8表达水平也逐渐升高,有助于中性粒细胞由角膜缘向角膜感染部位迁移以杀死真菌,在此过程中也会降解角膜基质层胶原纤维致使角膜混浊,使MMP-8表达水平与FK炎症评分严重程度呈正相关。
中性粒细胞分泌MMP-8前体,只有破坏其活性位点与Zn2+的相互作用才会被激活。激活的过程可以通过中性粒细胞释放的活性氧和多种蛋白酶来介导,如组织蛋白酶G、糜蛋白酶以及MMP-3、MMP-7、MMP-10、MMP-14等[8,20-25]。AMPK磷酸化激活MMP-8是我们首次在FK中发现的,其在人肺结核疾病中已有报道,中性粒细胞来源的MMP-8导致基质破坏空洞化的过程依赖于AMPK,AMPK激活水平在人肺结核细胞模型中上调,并驱动中性粒细胞MMP-8分泌和基因表达,这被AMPK抑制剂化合物C抑制[26],与本研究中体外镰刀菌孢子感染人中性粒细胞实验结果一致。由于中性粒细胞趋化网络在小鼠和人中是不同的,鼠和人的中性粒细胞在循环细胞的数量和形态方面也不同[27],因此本研究中选用人中性粒细胞来研究AMPK与MMP-8之间的作用。AICAR、二甲双胍或A-769662(AMPK激活剂)均被报道在各种炎症和免疫动物模型中发挥抗炎作用[28-32],在FK动物模型中尚未见报道,AMPK磷酸化激活MMP-8在FK病变中的作用还需进一步研究。
综上所述,本研究证明了在FK病变早期,中性粒细胞分泌大量MMP-8降解角膜基质层胶原纤维致使角膜混浊,组织被破坏,MMP-8表达水平与FK的严重程度相关。本研究首次发现在FK病程中,AMPK信号通路在调节中性粒细胞MMP-8分泌和天然免疫介导的组织破坏之间存在相互作用,AMPK磷酸化可调控人中性粒细胞MMP-8分泌。本研究为FK中性粒细胞分泌MMP-8致组织破坏提供了实验依据。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明董军璐:实施研究、采集数据、统计/分析数据、文章撰写;金鑫、刘华、简守珺、岳娟:实施研究;张红敏、王丽娅:酝酿和设计实验、实施研究、解释数据、对文章的知识性内容作批评性审阅

