丝瓜皮多酚的提取及抗氧化性研究
刘晓倩,陈佳宇,任文静,郭 然,彭 琪,丁建英
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
丝瓜(Luffa aegyptiacaMiller)属于葫芦科的攀援草本植物[1],别名为胜瓜、菜瓜,含有蛋白质、脂质、碳水化合物、铁、钙、磷、维生素B1及抗坏血酸等多种营养成分[2-3]。丝瓜皮可以作为中药,具有清热解毒、消炎、抗氧化、提高免疫力等功效[4,5]。相关研究显示,丝瓜中含有多酚类物质[6],主要由类黄酮类和酚酸类成分组成[7];丝瓜皮中的多酚含量高于丝瓜果肉,其醇提物中总多酚含量为9.8 mg/g。而丝瓜皮作为丝瓜食用时的副产物常被当作废弃物丢弃,利用率极低[4-5],因此对丝瓜皮功能成分的提取及研究,可为丝瓜皮资源的开发利用提供基础。
超声辅助提取方法与传统提取方法相比,利用其热作用和机械作用,可以促使功能成分的溶出,因此可以缩短时间、提高得率[8],用于多种功能成分的提取[4,9],本文用超声辅助提取方法提取丝瓜皮中的多酚,通过研究不同的提取温度、时间、乙醇浓度和料液比对多酚提取率的影响,利用单因素结合响应面法对多酚提取工艺进行优化,确定最优的提取工艺,同时研究其抗氧化性,以期为丝瓜皮的开发利用提供技术支持。
1 材料与方法
1.1 原料与试剂
新鲜寿光丝瓜购于常熟大润发超市。
没食子酸,上海源叶生物技术有限公司;福林酚试剂、无水乙醇、无水碳酸钠、1,1- 二苯基-2- 苦基肼自由基(DPPH)、抗坏血酸(VC)、水杨酸、硫酸亚铁,国药集团化学试剂有限公司;30%过氧化氢溶液,强盛功能化学股份有限公司;以上试剂均为分析纯。
1.2 仪器与设备
RE-5205A 旋转蒸发仪,上海亚荣生化仪器公司;SHZ-D(III)循环水式真空泵,上海力辰邦西仪器科技有限公司;TU-1901 双光束紫外分光光度计,北京普析通用仪器有限责任公司;KH-100DB 超声波清洗机,昆山禾创超声仪器有限公司;HH-4 数显恒温水浴锅,国华电器有限公司;TG16-WS 高速台式离心机,湖南湘仪实验室仪器开发有限公司。
1.3 试验方法
1.3.1 丝瓜皮多酚提取
丝瓜皮处理:将新鲜的丝瓜刮皮,刮下的丝瓜皮于阴凉处干燥24 h,再将丝瓜皮于60 ℃干燥至恒质量,磨成粉末,过60 目筛,置于4 ℃冰箱备用。
丝瓜皮多酚提取:称取4 g 丝瓜皮粉末,倒入锥形瓶中,同时以不同料液比加入一定浓度的乙醇溶液,振荡混匀,使丝瓜皮粉末与乙醇溶液充分混合,超声功率为100 W,连续超声提取一定时间,4 000 r/min 离心5 min,将上清液转入旋转蒸发仪进行浓缩,浓缩成原体积的1/4,得到丝瓜皮多酚浓缩液,备用。
1.3.2 单因素试验
丝瓜皮超声辅助法提取时,结合预试验,将超声提取的温度、时间、乙醇浓度和料液比四个因素进行单因素试验,提取温度为20、30、40、50、60、70 ℃,提取时间为10、20、30、40、50、60 min,乙醇浓度为60%、65%、70%、75%、80%、85%,料液比(质量体积比)为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL),依次比较不同因素下各水平对丝瓜皮多酚得率的影响,以期获得超声辅助提取丝瓜皮多酚的最佳水平[10]。
1.3.3 丝瓜皮多酚提取的响应面优化试验
为进一步研究各因素的交互作用对多酚提取率的影响,采用响应面分析法优化提取工艺[11]。基于Box-Behnken 试验设计,选择对多酚提取率有影响的4 个主要因素乙醇浓度、提取时间、料液比、提取温度进行4 因素3 水平响应面分析试验,响应面设计水平见表1[12]。

表1 响应面设计因素水平表Table 1 Factors and levels table of response surface design
1.3.4 丝瓜皮多酚得率的测定
将1.3.1 得到的丝瓜皮多酚浓缩液5.0 mL加入25.0 mL容量瓶中,加水定容,取0.5 mL 置入50 mL 比色皿中,随后向比色皿中加入1.0 mL 福林酚试剂,振荡,使溶液充分混匀,再加入2.0 mL 10%碳酸钠溶液,振荡,静置1 h。最后测定溶液在760 nm 下的吸光度,根据公式(1)计算丝瓜皮多酚得率[13]。
式中,Y为丝瓜皮的多酚得率,mg/g;m为丝瓜皮质量,g;n 为稀释倍数;V为被测液体积,mL;c为多酚浓度,mg/mL。
1.3.5 丝瓜皮多酚对DPPH 自由基的清除作用
在试管中分别滴加0.2、0.4、0.6、0.8、1.0 mg/mL 的提取液2 mL,再加入2.0 mL、0.2 mmol/L 的DPPH 溶液,充分震荡,避光静置30 min。以无水乙醇调零,在517 nm 波长下测得吸光度值;把DPPH 溶液换为无水乙醇,作为对照测其吸光度值;取相同体积DPPH 溶液和无水乙醇混合,测其吸光度值。按照上述步骤,将抗坏血酸作为参照物[14],测定其吸光度值。以上述操作平行3 次,取平均值。用公式(2)计算多酚对DPPH 自由基的清除率。
式中,A样品为提取液和DPPH 溶液的吸光度值;A对照为提取液和无水乙醇的吸光度值;A空白为无水乙醇和DPPH 溶液的吸光度值。
1.3.6 丝瓜皮多酚对羟基自由基的清除作用
在试管中分别滴加0.2、0.4、0.6、0.8、1.0 mg/mL 提取液2 mL,再加入9 mmol/L FeSO4溶液和8.8 mmol/L H2O2溶液各2.0 mL,充分震荡,静置5 min 再加入9 mmol/L 水杨酸溶液2.0 mL,充分震荡,放置于水浴锅中37 ℃恒温水浴30 min。以蒸馏水调零,在510 nm 波长下测得吸光度值;把过氧化氢溶液换为蒸馏水,作为对照测其吸光度值;将提取液替换成蒸馏水作为空白对照,测其吸光度值[15]。按照上述步骤,将抗坏血酸作为参照物,测定其吸光度值。以上述操作平行3 次,取平均值。根据公式(3)计算丝瓜皮多酚对羟基自由基的清除率。
式中,A样品为提取液和H2O2溶液的吸光度值;A对照为提取液和蒸馏水的吸光度值;A空白为蒸馏水和H2O2溶液的吸光度值。
1.4 数据处理方法
使用Excel 2010 进行数据处理及作图。
2 结果与分析
2.1 丝瓜皮多酚提取单因素试验结果
2.1.1 料液比对丝瓜皮多酚得率的影响
由图1 可知,随着丝瓜皮多酚提取体系中溶剂量的增加,丝瓜皮多酚的得率呈现先升高后下降的趋势,这可能是由于溶剂的增加,使丝瓜皮多酚与溶剂中多酚浓度差增大,促进多酚的溶出。但当料液比超过1∶15 后,随着溶剂量的不断增加,多酚在浓缩后处理过程中损失增加[14-15],使提取率下降。由此将料液比设定为1∶10~1∶20,作为后续响应面优化试验的条件。

图1 料液比对丝瓜皮多酚得率的影响Fig.1 Effect of material liquid ratio on the yield of polyphenols from luffa peels
2.1.2 乙醇浓度对丝瓜皮多酚得率的影响
如图2所示,随着乙醇浓度的增加,丝瓜皮多酚出现先增后减的趋势。当乙醇浓度为60%~75%时,丝瓜皮多酚提取率呈明显上升趋势,在75%时达到最大值,这可能是由于乙醇浓度过低时,极性过强,导致糖类等水溶性物质浸出量增大;但在乙醇浓度为75%~85%时,得率逐渐降低,可能是乙醇浓度过高造成提取溶剂极性太低,导致蛋白质发生变性,使细胞壁结构变得致密,从而导致多酚不能溶出;另外多酚往往以氢键形式与其他成分结合,乙醇浓度过高,直接影响氢键的断裂,使多酚提取得率下降[16]。因此,将乙醇浓度设定为70%~80%作为响应面优化试验的条件。

图2 乙醇浓度对丝瓜皮多酚得率的影响Fig.2 Effect of ethanol concentration on polyphenol yield rate of luffa peels
2.1.3 提取时间对丝瓜皮多酚得率的影响
如图3所示,当提取时间为10~30 min 时,丝瓜皮多酚得率随提取时间增加而增加;当达到30 min 时,多酚得率达到最大值,为7.50 mg/g;提取时间达到30 min以后,多酚得率随提取时间的增加而下降。可能的原因是多酚溶解于溶剂内需要时间,所以在30 min 之前,多酚得率呈上升趋势;当达到30 min 临界点时,多酚得率将不再增长,而且随着提取时间延长,提取液中的多酚物质会发生氧化、聚合、分解等各种反应[17],从而使其含量有所下降。由此将提取时间设定为20~40 min 作为响应面优化试验的条件。

图3 提取时间对丝瓜皮多酚得率的影响Fig.3 Effects of extraction time on the polyphenol yield rate of luffa peels
2.1.4 提取温度对丝瓜皮多酚得率的影响
如图4所示,当提取温度在20~60 ℃时,丝瓜皮多酚得率随提取温度的升高而上升,当提取温度达到60 ℃时,达到最大值,为6.08 mg/g。这是因为随着提取温度的升高,分子运动加剧,从而使多酚析出增加;但温度超过60 ℃,过高的温度使多酚的化学结构破坏,从而使多酚得率下降[17]。由此将提取时间设定为50~70 ℃作为响应面优化试验的条件。
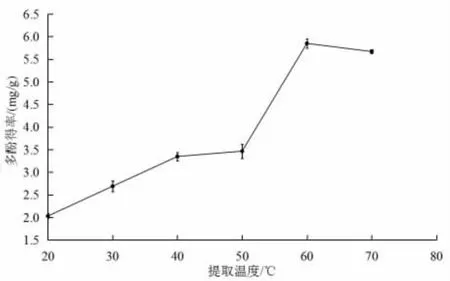
图4 提取温度对丝瓜皮多酚得率的影响Fig.4 Influence of extraction temperature on polyphenol yield rate of luffa peels
2.2 响应面试验结果与分析
2.2.1 响应面试验结果及方差分析
响应面试验结果如表2(见下页)所示,利用软件Design- Expert 10.0.3 对数据进行解析[18],得到二次多项回归方程:多酚提取率Y(%)=9.96+0.96A+0.87B+0.26C+109D+0 .37AB-0 .24AC+0 .30AD+0 .28BC-0.62BD+0.045CD-3.24A2-1.86B2-0.85C2-1.64D2。
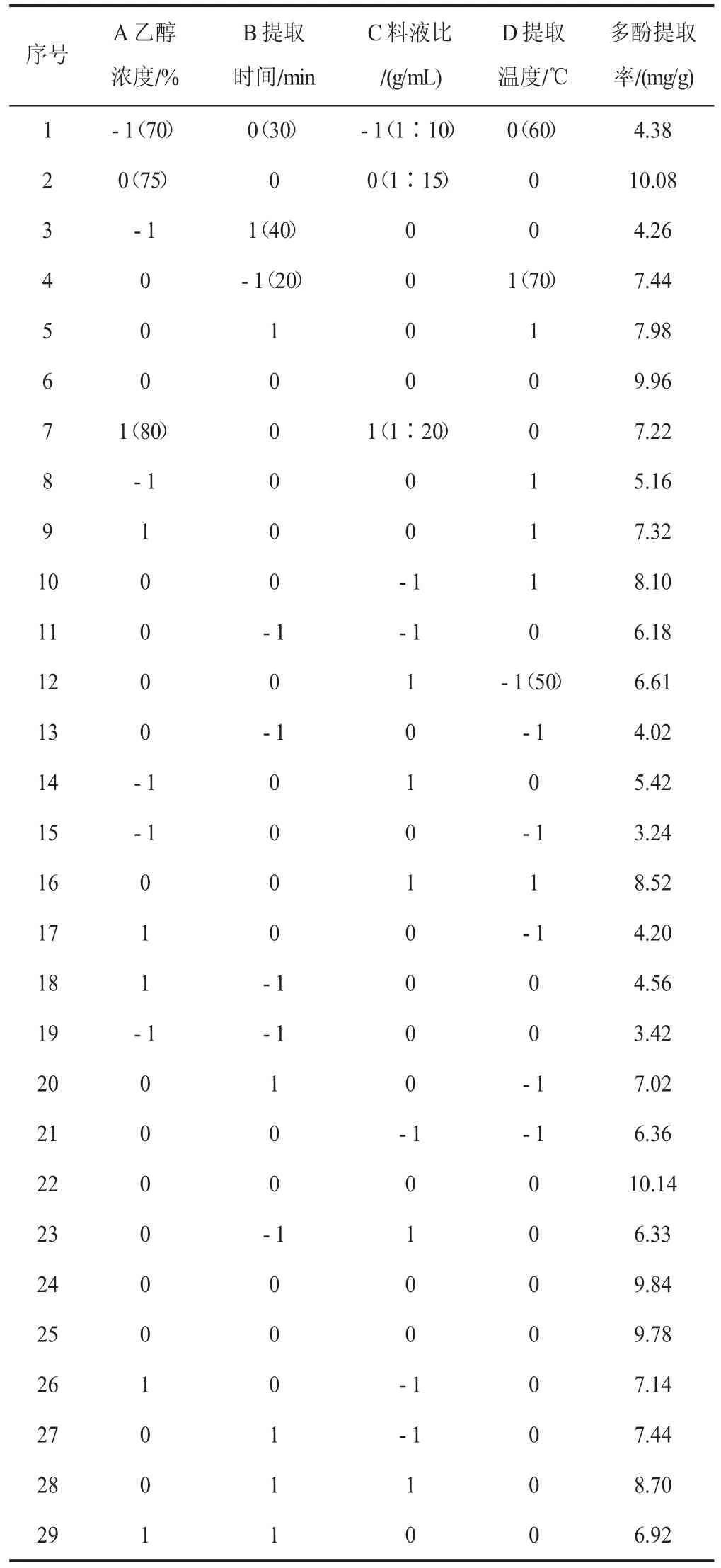
表2 试验设计与结果Table 2 Test design and results
对模型进行回归分析,其结果见表3,一次项A、B、C、D 对多酚提取率线性效应显著(P<0.05),二次项A、B、C、D 对多酚提取率曲面效应显著(P<0.05),AB、AD、BD 对多酚提取率交互效应显著(P<0.05)。该模型的负相关系数R2=0.991 8,P<0.000 1,可以证明该模型达到极显著水平,该模型失拟项不显著(P>0.05),证明该模型可信,拟合度较高,可用于丝瓜皮超声波辅助提取工艺的分析和优化。由F值可知,各因素对丝瓜皮多酚提取量的影响大小顺序为提取温度>乙醇浓度>提取时间>料液比。
2.2.2 因素间交互作用分析结果
由图5(见53 页)结合表3(见54 页)可知,提取时间-乙醇浓度、乙醇浓度-提取温度、乙醇浓度-料液比交互作用对丝瓜皮多酚提取率影响显著(P<0.05),其他因素交互作用对丝瓜皮多酚提取率影响不显著。
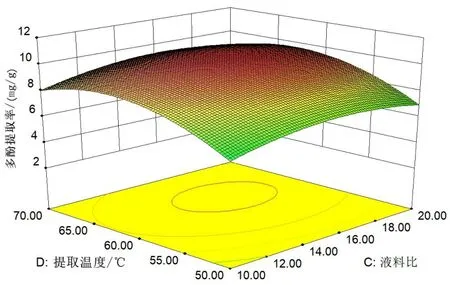
图5 各因素的交互作用对多酚提取率的影响Fig.5 The influence of the interaction of various factors on the extraction rate of polyphenols
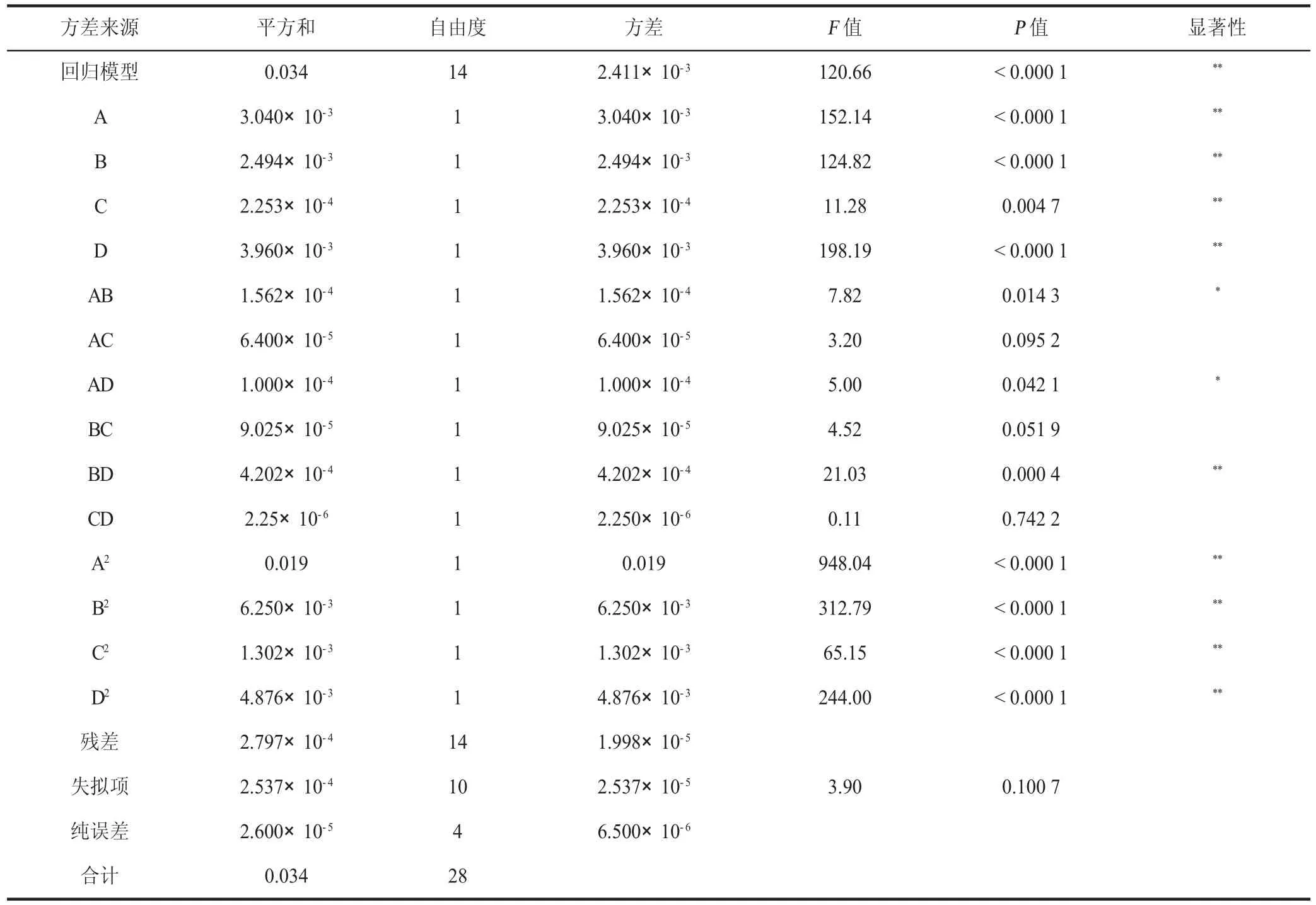
表3 丝瓜皮多酚提取率拟合回归方程的方差分析结果Table 3 Variance analysis results of the Prate fit regression equation
2.2.3 最优工艺条件试验验证
多酚最优提取工艺为乙醇浓度76.02%、提取时间30.19 min、料液比1∶15.75(g/mL)、提取温度62.62 ℃,在此条件下模型预测的多酚提取率为10.24 mg/g。
根据软件预测结果,结合实际工艺设置的可行性,取乙醇浓度76%、提取时间30 min、料液比1∶16(g/mL)、提取温度63 ℃为条件进行三次重复试验,平均多酚提取率为10.13 mg/g,与模型预测结果接近,表明模型拟合效果良好,基于该响应面模型分析优化多酚提取率提取工艺的方法有效可行[19]。
2.3 丝瓜皮多酚溶液的抗氧化能力分析结果
2.3.1 丝瓜皮多酚对DPPH 自由基的清除效果
酚类化合物是果蔬中主要的抗氧化物质之一,DPPH自由基被广泛应用于天然植物或化合物的抗氧化能力评价。如图6(见53页)所示,丝瓜皮多酚与VC在消除DPPH自由基方面效果相近,其清除率随溶液浓度的增加而增加,呈现正相关。当丝瓜皮多酚浓度为0.6 mg/mL 时,对DPPH 自由基的清除率为92.8%,显示丝瓜皮多酚对DPPH 自由基具有良好的清除效果。有研究表明胎菊多酚对DPPH 自由基的清除率为97.49%[20],与丝瓜皮多酚相当。
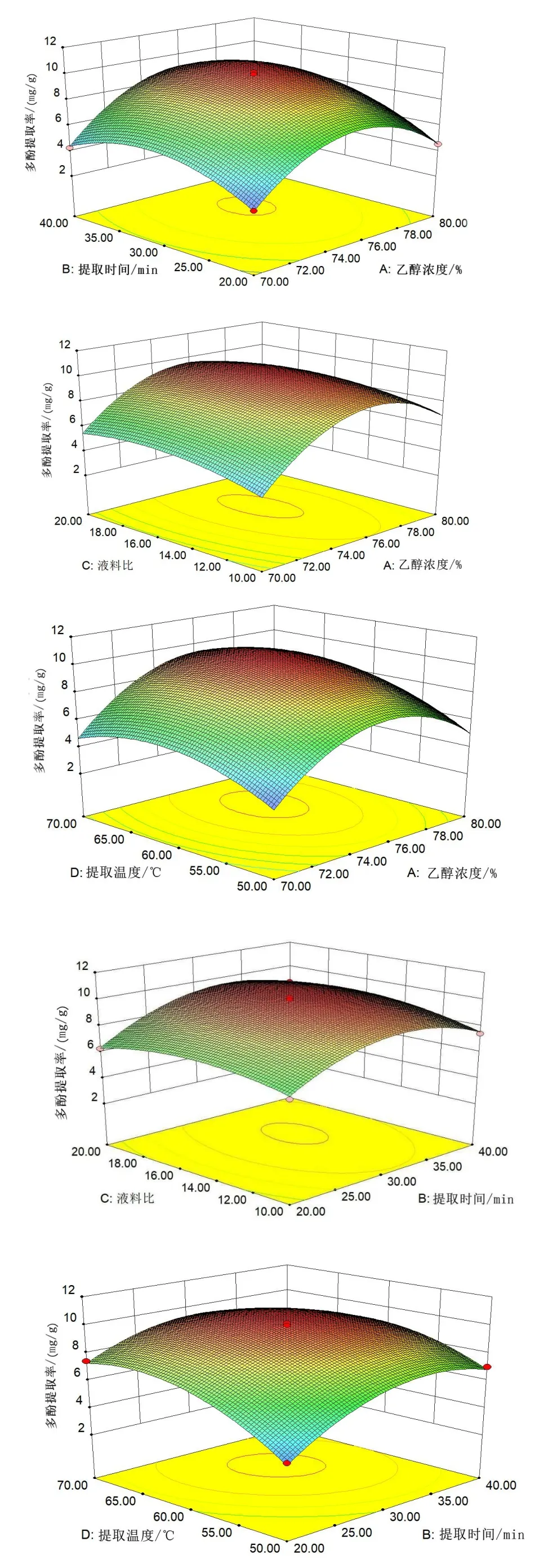

图6 丝瓜皮多酚对DPPH 清除效果Fig.6 Effect of luffa peels on the effect of DPPH removal
2.3.2 丝瓜皮多酚对羟基自由基的清除效果
丝瓜皮多酚溶液与VC 溶液对羟基自由基清除效果如图7所示,VC 与丝瓜皮多酚对羟基自由基具有清除效果,但通过数据对比发现,丝瓜皮多酚对羟基自由基的清除效果超过VC 对羟基自由基的效果。当丝瓜皮多酚浓度为0.6 mg/mL 时,对羟基自由基的清除率为88.17%。远高于邵安冉等[20]报道的胎菊多酚26.42%的羟基自由基清除率,可见丝瓜皮多酚对羟基自由基具有较好的清除效果。

图7 丝瓜皮多酚对羟基自由基清除效果Fig.7 Effect of luffa peels polyphenols on hydroxyfree radicals removal
3 结论
在构建资源节约型社会的进程中,农业生物废弃物的再利用越来越受到人们的重视。本文以丝瓜食用后丢弃的丝瓜皮作为原料,采用超声辅助乙醇提取的方法对丝瓜皮中的多酚进行提取,优化提取工艺参数,并对丝瓜皮多酚的抗氧化性进行了研究。得出丝瓜皮多酚超声辅助提取的最佳工艺条件为乙醇浓度76%、提取时间30 min、料液比1∶16(g/mL)、提取温度63 ℃。以此条件进行验证实验,得到丝瓜皮多酚得率为10.13 mg/g,与响应面模型预测值10.24 mg/g 相近。丝瓜皮多酚抗氧化性能研究发现,随着丝瓜皮多酚浓度增大,丝瓜皮多酚对DPPH 和羟基自由基的清除率均不断增加,丝瓜皮多酚浓度达到0.6 mg/mL 时,对DPPH 和羟基自由基的清除率分别为92.8%和88.17%,说明丝瓜皮多酚具有良好的抗氧化活性。丝瓜皮作为丝瓜烹饪或加工时产生的废弃物,但其含有丰富的多酚成分,丝瓜皮多酚具有良好的抗氧化性,在食品加工以及化妆品行业有广阔的应用前景,后续将对丝瓜皮多酚进一步纯化并对其组分研究,为其进一步应用提供基础。

