体素内不相干运动扩散加权成像在乳腺癌腋窝转移性小淋巴结中的研究价值
蒋伟,邓虹,张翔,贺绍云,赵雅琪,高明
0 前言
乳腺癌是女性群体最常见的恶性肿瘤之一,根据GLOBOCAN 2020 全球癌症数量统计结果,2020 年女性乳腺癌新增病例达226 万,占女性癌症总数的24.5%,乳腺癌首次超过肺癌成为世界第一大癌症[1-3]。腋窝淋巴结转移是乳腺癌早期病灶转移的主要方式,明确乳腺癌患者是否存在腋窝淋巴结转移,不仅关系到疾病治疗方案的制订,对治疗效果和预后的评估也极为重要[4-6]。有研究表明,发生腋窝淋巴结转移的乳腺癌患者预后比未发生腋窝淋巴结转移患者差[7]。选择高效且无创的检查方式评估乳腺癌患者淋巴结转移是目前研究关注的重点。
MRI 检查是乳腺癌患者诊断和术前评估主要的影像学方法,可以清晰显示病灶形态学特征、血流动力学特征及组织细胞水分子扩散情况等相关信息,具有安全及软组织分辨率高等优势。目前乳腺常规MRI 扫描序列对乳腺癌患者腋窝是否存在转移性淋巴结的诊断主要依赖于淋巴结大小、坏死及强化方式等形态学指标。从乳腺MRI 的常规增强扫描序列获得的图像中,难以鉴别直径≤5 mm 的腋窝转移性小淋巴结(small metastatic lymph nodes, SMLN)和腋窝良性淋巴结(benign lymph nodes, BLN)[8-10]。水分子在人体组织中的扩散特性可通过扩散加权成像(diffusion-weighted imaging, DWI)中的表观扩散系数(apparent diffusion coefficient, ADC)定量地反映,有研究表明DWI中的ADC值有助于在乳腺癌患者术前区分腋窝转移性淋巴结和非转移性淋巴结[11],但存在因化学位移和运动所致伪影敏感度高等因素的影响,对小淋巴结评估不准确。另一方面,在体素内不相干运动(intravoxel incoherent motion, IVIM)的理论中,认为人体内的水分子的微观运动不仅受到水分子的真的物理扩散,还受到毛细血管的微循环灌注等多方面因素的影响。因此,基于常规单指数模型计算的ADC值不能完全反映生物组织的扩散属性。IVIM-扩散加 权 成 像(diffusion-weighted imaging, DWI)是基于IVIM 双指数模型的DWI 新技术,通过IVIM 定量参数,可以分别反映水分子的真实物理扩散和毛细血管微循环灌注情况[12-13],MAO 等[14]学者认为IVIM 参数充足,在乳腺病变良恶性的鉴别方面明显优于ADC 值。本研究旨在探讨IVIM-DWI 中的定量参数在诊断乳腺癌腋窝SMLN 的临床价值,为临床提供预测腋窝SMLN 的方法,对乳腺癌患者治疗具有一定的指导意义。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经中山大学孙逸仙纪念医院伦理委员会批准,免除受试者知情同意(批准文号:SKSKY-2022-079-01)。回顾性分析2017年9月至2020年12月在中山大学孙逸仙纪念医院因乳腺结节就诊并经腋窝淋巴结穿刺活检术或手术病理证实的乳腺癌腋窝SMLN 患者80 例(8 例为经腋窝淋巴结穿刺活检术病理证实,72 例为手术病理证实,且均为术前由穿刺活检术或手术医生与影像科医生共同阅片协商确定的淋巴结)和乳腺良性病变患者55例的影像和病例资料。所有患者术前均行双侧乳腺和腋窝MRI 动态增强检查。80 例乳腺癌腋窝SMLN 组患者的年龄为18~72 岁,中位年龄45 岁。乳腺癌腋窝SMLN组纳入标准:(1)经腋窝淋巴结穿刺活检术或手术切除病理标本证实为乳腺癌腋窝淋巴结转移;(2)穿刺活检术或手术切除腋窝淋巴结前1周内行双侧乳腺及腋窝MRI动态增强检查;(3)病理标本的转移性淋巴结短径≤5 mm,且术前与MRI所示的淋巴结对应标记,患侧仅单个淋巴结短径≤5 mm;(4)双侧乳腺和腋窝MRI检查前未接受乳腺癌相关治疗;(5)采集的乳腺及双侧腋窝MRI图像无明显伪影,图像质量满足测量和分析要求。乳腺癌腋窝SMLN组排除标准:(1)双侧乳腺和腋窝MRI检查前行腋窝淋巴结穿刺活检手术。55 例乳腺良性病变BLN 组患者的年龄为21~64 岁,中位年龄44 岁。乳腺良性病变腋窝BLN 组纳入标准:(1)健康志愿者且既往史中无恶性肿瘤病史;(2)双侧乳腺和腋窝MRI 诊断为BLN,影像学随访时间超过6 个月且大小无变化;(3)腋窝淋巴结短径在5 mm 以下。乳腺良性病变腋窝BLN 组排除标准:(1)获得的MRI 图像伪影明显影响腋窝淋巴结分析;(2)志愿者随访时间内全身任何部位发生恶性肿瘤。
1.2 检查方法
采用德国Siemens Skyra 3.0 T 超导MR 扫描装置和原机自带的16通道乳腺专用相位阵列线圈进行乳腺MRI 常规序列和双指数模型IVIM-DWI 扫描。所有患者均采用俯卧位检查,双侧乳腺自然悬垂于线圈内,扫描范围包括双侧乳腺和腋窝。MRI 扫描参数包括:横断位T1WI-Vibe 结合Dixon 技术,TR 5.38 ms,TE 2.46、3.69 ms,层厚1.5 mm,层间距0 mm,分辨率0.5 mm×0.5 mm,矩阵384×384;横断位T2WI 采用STIR 抑脂序列,TR 7600 ms,TE 75 ms,TI 230 ms,层厚4 mm,层间距0.8 mm,分辨率0.8 mm×0.8 mm,矩阵358×448。乳腺动态对比增强MRI 采用TWIST-VIBE 序列,横断位成像,FA 12°,TR 3.25 ms,TE 1.22 ms,NEX 1,层厚2.5 mm,层间距0.5 mm,矩阵187×256,分辨率0.7 mm×0.7 mm。自由呼吸状态下行70 期不间断扫描,单个时相扫描时间为6 s,第4 期扫描开始经肘静脉注射Gd-DTPA,注射剂量为0.1 mmol/kg,注射速率为3.5 mL/s,注射完成后以20 mL 生理盐水冲管。IVIM 采用单激发自旋回波扩散加权平面回波读取序列,加载10 个b 值(0、10、30、50、100、200、400、600、800、1000 s/mm2),各b值对应NEX分别为1、2、3、3、3、3、2、2、2、4,TR 6600 ms,TE 68 ms,回波间隙0.5 ms,分辨率1.5 mm×1.5 mm,矩阵94×128,层厚4 mm,层间距0.4 mm。
1.3 图像分析及数据测量
使用MITK-Diffusion 软件对IVIM-DWI 原始数据进行后处理。由2名分别具有10年和15年工作经验的放射科主治医师及副主任医师独立进行阅片和病灶径线测量,在常规MRI序列图像和增强图像上选择淋巴结最大层面作为感兴趣区(region of interest, ROI)层面,ROI涵盖整个结节,且尽量与病灶的边缘保持一致且进行手动绘制ROI。取两人测量结果的平均值,用双指数非线性模型计算ROI的真实扩散系数(true diffusion coefficient, D)、灌注相关扩散系数(perfusion related diffusion coefficient, D*)、灌注分数(perfusion fraction, f)。使用单指数线性模型计算ADC值(b=0、800 s/mm2)。
1.4 统计学方法
采用SPSS 26.0 软件及MedCalc 15.2.2 软件进行统计学分析。使用组内相关系数(intra-class correlation coefficient, ICC)比较两位医师对两组患者双指数模型IVIM-DWI参数(D、D*和f值)和ADC值测量值间的一致性,ICC>0.75 为一致性良好,采用两位观察者测量数据的平均值进行后续的分析。正态分布的计量资料以±s表示。乳腺癌腋窝SMLN组与乳腺良性病变腋窝BLN 组的双指数模型IVIM-DWI参数(D、D*和f值)和ADC值的比较采用独立样本t检验。绘制双指数非线性模型参数(D、D*和f值)及ADC 值鉴别乳腺癌腋窝SMLN 组与乳腺良性病变腋窝BLN 组ROC 曲线,通过曲线下面积(area under the curve, AUC)分析乳腺癌腋窝SMLN 组和腋窝BLN 中各参数的诊断效果。根据约登指数确定各参数诊断乳腺癌腋窝SMLN 的阈值,并计算相应的敏感度和特异度。P<0.05 认为差异具有统计学意义。
2 结果
2.1 一般资料
纳入的80 例乳腺癌腋窝SMLN 组患者中,乳腺浸润性导管癌60 例,乳腺浸润性小叶癌7 例,乳腺黏液样癌3例,乳腺未分化癌3例,其他类型7例。纳入的55 例乳腺良性病变腋窝BLN 组患者中,乳腺纤维瘤35 例,乳腺硬化性腺病7 例,良性叶状肿瘤5 例,乳腺错构瘤4 例,乳腺脂肪瘤4 例。80 例乳腺癌患者共纳入80 个腋窝SMLN,其中左侧腋窝淋巴结34 例,右侧腋窝淋巴结46 例,55 例乳腺良性病变共纳入55 个腋窝BLN,其中左侧腋窝淋巴结28 例,右侧腋窝淋巴结27例。
2.2 两位观察者测量结果的一致性
两位观察者对两组患者双指数模型IVIM-DWI参数(D、D*和f值)和ADC值测量结果的一致性良好,ICC均>0.75,如表1所示。
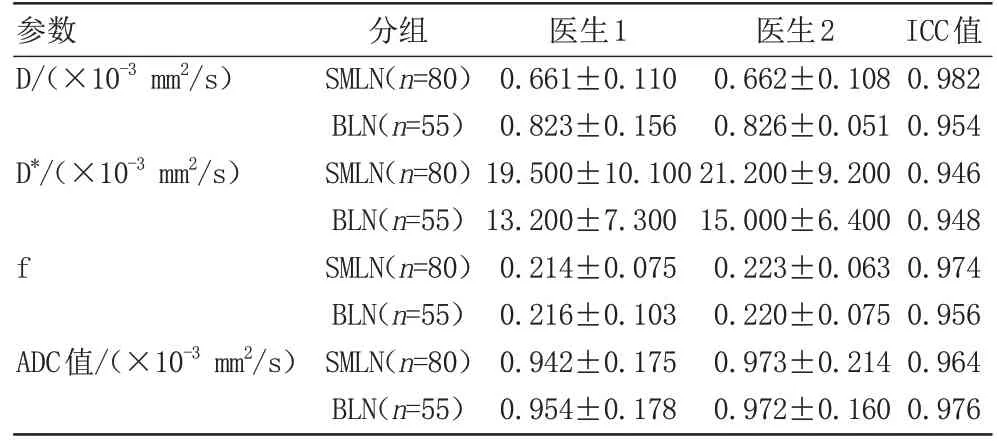
表1 D、D*、f值和ADC值的ICC检验Tab.1 ICC test of the D, D*, f and ADC value
2.3 各组IVIM-DWI参数及ADC值的比较
乳腺癌腋窝SMLN 组与乳腺良性病变腋窝BLN 组之 间D 值(F=6.975,P<0.01)、D*值(F=3.206,P<0.01)和ADC 值(F=5.117,P<0.01)差异均有统计学意义,两组之间的f值(F=-0.171,P>0.05)差异无统计学意义。乳腺癌腋窝SMLN 组的D 值和ADC 值均低于乳腺良性病变腋窝BLN 组(P<0.001),D*值高于乳腺良性病变腋窝BLN 组(P=0.002)。两组淋巴结IVIM-DWI 及ADC 值参数值见表2,两组淋巴结IVIM-DWI各参数图见图1和图2。
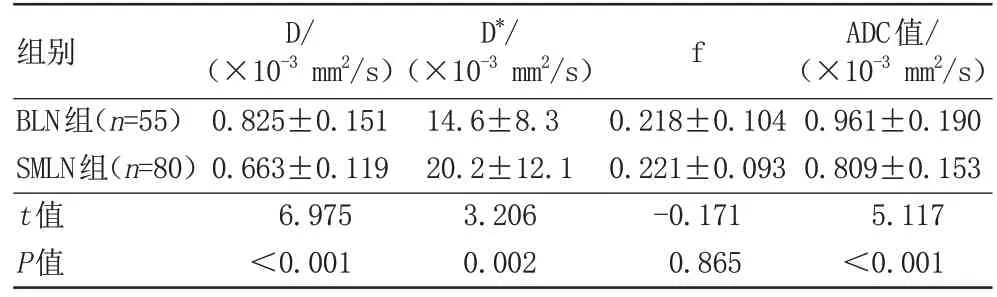
表2 两组淋巴结IVIM-DWI及ADC值参数值的比较Tab.2 Comaparison of parameter values of IVIM-DWI and ADC values in lymph nodes
2.4 IVIM-DWI 参数鉴别乳腺癌SMLN 组与BLN 组的ROC曲线
D 值、D*值、ADC 值及ADC 与D 联合预测在鉴别乳腺癌腋窝SMLN 与乳腺良性病变腋窝BLN 中差异具有统计学意义,AUC 分别为0.817、0.643、0.734 以及0.833。D 值、D*值和ADC 值的诊断阈值分别为0.750×10-3、17.5×10-3、0.836×10-3mm2/s,其 中D值的敏感度和特异度最高,分别为81.8%和80.0%。D 值、D*值、ADC 值和ADC 与D 联合预测用于鉴别乳腺癌腋窝SMLN 结果见表3 和表4。D 值、D*值、ADC 值ADC 与D 联合预测诊断乳腺癌腋窝SMLN 的AUC 值ROC曲线见图3。
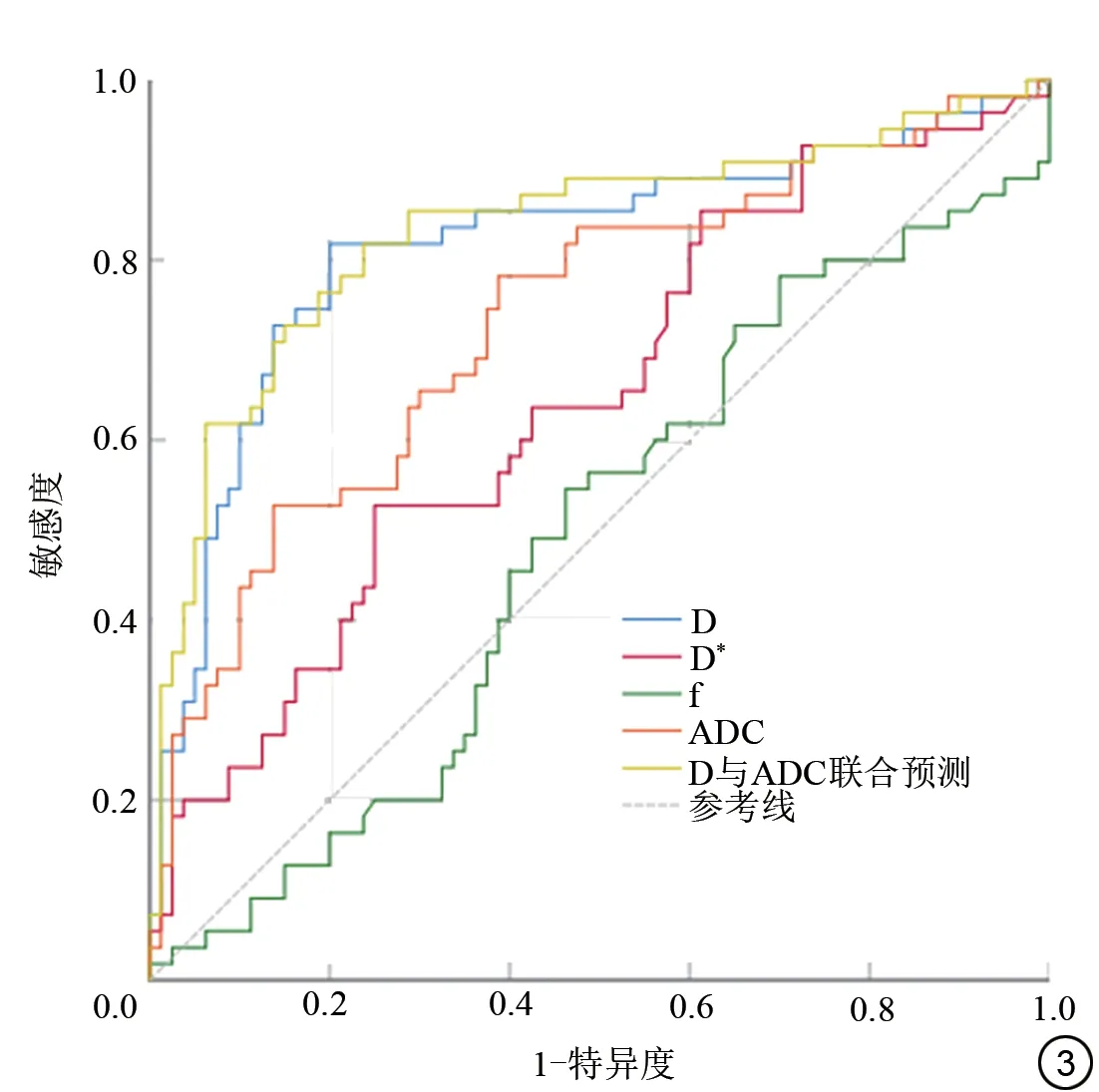
图3 D 值、D*值、ADC 值、ADC 与D 联合预测用于诊断乳腺癌腋窝SMLN 的ROC 曲线。D:真实扩散系数;D*:灌注相关扩散系数;ADC:表观扩散系数;SMLN:转移性小淋巴结。Fig.3 ROC curve of D value, D* value, ADC value, ADC and D combined prediction for the diagnosis of axillary SMLN in breast cancer.D: true diffusion coefficient; D*: perfusion related diffusion coefficient; ADC:apparent diffusion coefficient; SMLN: small metastatic lymph nodes.
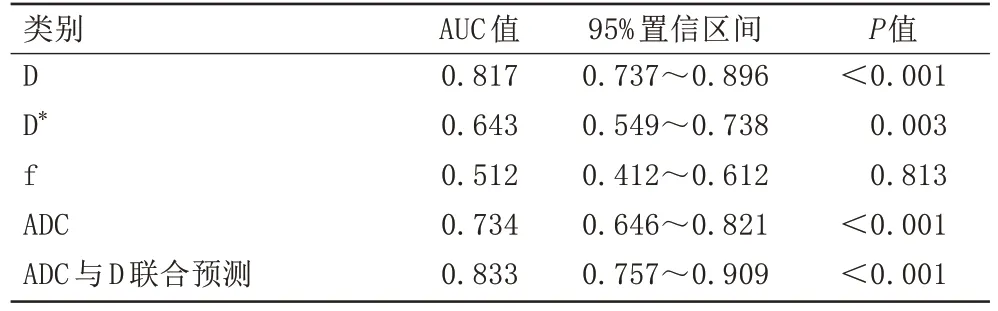
表3 D值、D*值、f值、ADC值、ADC与D联合预测用于鉴别乳腺癌腋窝SMLNTab.3 D value, D* value, f value, ADC value, ADC and D combined prediction were used to identify axillary SMLN of breast cancer
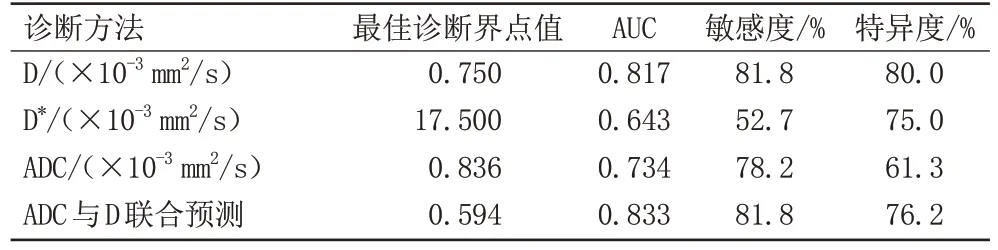
表4 D值、D*值、ADC值及ADC与D联合预测值的诊断效能Tab.4 Diagnostic efficiency of D value, D* value, ADC value, ADC and D combined prediction
3 讨论
腋窝淋巴结状态是对乳腺癌患者的诊断和治疗有重要影响的评价指标,在肿瘤的分期、治疗方案的选择和预后评估等方面起着非常重要的作用。本研究将乳腺癌双指数模型IVIM-DWI 参数(D、D*和f 值)及ADC值应用于乳腺癌腋窝淋巴结转移的鉴别诊断,结果显示乳腺癌腋窝SMLN组D值及ADC值均显著低于乳腺良性病变腋窝BLN组(P<0.01),乳腺癌腋窝SMLN组D*值高于乳腺良性病变腋窝BLN 组(P<0.01),ROC曲线分析结果表明D 值诊断乳腺癌腋窝SMLN 诊断效果优于D*值和ADC值。
3.1 IVIM-DWI在诊断恶性肿瘤性中的优势
DWI 是一种能够准确实时地反映生物体内细胞组织内的水分子细胞扩散特性的无创成像检测方法[15-17],不仅可以提高鉴别乳腺良恶性病变的特异度[18],还可以通过测量ADC 值来定量测量乳腺肿瘤内部水分子的运动情况,评估腋窝淋巴结并预测肿瘤的生物学行为[19]。但ADC 值在微观上不仅受水分子扩散的影响,还受毛细血管微循环灌注的影响。同时ADC 值的测量也会受到不同b 值的影响,从而导致ADC 值的测量误差。当b 值增大时,MRI 图像的信噪比减低,导致对小病变的漏诊。因此,ADC 值不能准确地反映组织的结构特点及生物信息[14]。
功能磁共振成像(functional magnetic resonance imaging, fMRI)技术近几年取得了快速的进展,尤其在以DWI 基础上产生的IVIM 模型较为突出,可为肿瘤定性诊断提供定量参数值[20-21]。本研究采用IVIM模型弥补了传统DWI技术的缺陷,将单纯水分子扩散和微循环灌注对于信号衰减的影响进行区分,可以更真实地反映淋巴结内部的情况。IVIM 的双指数模型中D 值主要反映了肿瘤细胞外水分子的真正分散运动。D*值表示血液微循环灌注引起的扩散系数,与组织的微血管密度、平均毛细血管的长度和平均血流速度密切相关[22]。f值是体素内微循环灌注效应引起的分散占整体分散效应的比例,是微血管血流量的分数体积(%),代表肿瘤的血容量,该值与正常血管数量呈正相关,包括血管完整性和通透性[20]。通常在恶性肿瘤中,肿瘤的恶性程度越高,血流灌注容量越大,f 值越高,高f 值常常提示肿瘤组织内有很多新生血[23-24]。本研究结果显示,IVIM模型中腋窝BLN组的D值和ADC值均高于SMLN组,且两者之间差异具有统计学意义,该研究结果与国内学者[25]对原发肿瘤的研究结果一致,这可能与肿瘤细胞增生活跃,单位体积内细胞密度增加,细胞间隙变小以及细胞内核浆比例增大有关,上述因素的叠加效应共同限制了细胞内水分子的扩散,从而引起D值和ADC值的降低。
3.2 IVIM-DWI各参数诊断乳腺癌腋窝SMLN的价值
本研究结果表明乳腺癌腋窝SMLN 组的D 值和ADC 值明显低于乳腺良性病变腋窝BLN 组,其原因可能是转移性淋巴结内肿瘤细胞增殖速度快、细胞密集度增高、排列紧密以及细胞外间隙缩小等限制了细胞外水分子的扩散,从而导致D值和ADC值降低,这与既往研究的结论[26-27]类似。因此,乳腺癌腋窝SMLN中水分子扩散受限比腋窝BLN更为明显,造成水分子扩散受限的主要原因是乳腺癌腋窝SMLN的肿瘤细胞排列紧密、核大深染、核分裂象明显等多种因素所致。
转移性淋巴结和非转移性淋巴结在组织中微循环之间存在较大差异,主要表现为微血管的流动特征、血流容积、微血管的密度和通透性的增加以及血管外细胞外间隙容积的增大等。KVISTAD 等[28]的研究结果表明乳腺癌腋窝转移性淋巴结与腋窝BLN 相比呈高灌注状态。本研究发现乳腺癌腋窝SMLN组微循环灌注D*值明显高于乳腺良性病变腋窝BLN 组,其病理学基础可能是转移性淋巴结中微血管的密度明显高于BLN,且转移性淋巴结内部含有大量新生毛细血管,其内皮细胞结合松散和基底膜发育不充分导致毛细血管通透性增加、血流速度加快[15-16]。但是,本研究显示使用D*值诊断乳腺癌腋窝SMLN 的AUC 为0.643,可能与本研究中纳入的淋巴结短径均较小(短径≤5 mm)有关。
一篇关于IVIM 成像定量鉴别乳腺肿瘤的Meta分析结果显示,与淋巴结阴性病变相比,淋巴结转移病变中可以观察到高的伪扩散系数(P=0.009)和灌注分数值(P=0.001)[29]。本研究中乳腺癌腋窝SMLN组与乳腺良性病变腋窝BLN 组之间淋巴结的f 值差异均无统计学意义,表明f值可能不是鉴别乳腺癌腋窝SMLN 和乳腺良性病变腋窝BLN 的敏感指标。本研究该结果可能与选用的b 值或者纳入淋巴结短径均较小相关,需要在后续的研究中进一步证实。
3.3 IVIM-DWI各参数间诊断乳腺癌腋窝SMLN的比较
目前临床确诊是否发生乳腺癌腋窝淋巴结转移主要取决于超声引导下腋窝淋巴结穿刺活检术和前哨淋巴结活检术的病理结果。然而,一些腋窝淋巴结可能会受到骨、肌肉和肺部气体的干扰,这可能降低超声对该部分淋巴结的显示和诊断敏感度[30]。临床术前未发现可疑腋窝淋巴结转移时,乳腺癌患者行前哨淋巴结活检术作为侵袭性检查,存在示踪剂过敏、荧光示踪剂放射性污染、术后局部血肿形成、淋巴水肿等并发症的风险[31]。其次,影像上转移性淋巴结常用的诊断标准是淋巴结短径是否超过10 mm[32-33],淋巴结穿刺活检术的目标病灶更是很少选择短径为5 mm 以下的腋窝淋巴结,本研究以短径为5 mm及以下的淋巴结作为研究对象对于鉴别腋窝SMLN 有重要意义。另外,关于使用IVIM-DWI 参数诊断乳腺癌腋窝淋巴结转移的研究较少,对使用IVIM-DWI 诊断乳腺癌腋窝SMLN 的研究结果仍有争议。陶国民等[34]发现使用IVIM-DWI 参数对乳腺癌腋窝淋巴结的诊断有局限性。但ZHU 等[23]的研究表明IVIM-DWI 定量参数有助于区分腋窝转移性和非转移性淋巴结,其中D 值的诊断效果最好。本研究中D、D*及ADC 值的AUC 分别为0.817、0.643、0.734,对乳腺癌腋窝SMLN 与乳腺良性病变腋窝BLN 的鉴别诊断效能差异具有统计学意义(P<0.01),其中D 值的敏感度为81.8%,特异度为80.0%,此时最佳诊断阈值为0.750×10-3mm2/s,大于该数值则腋窝BLN 可能性大,低于该值则倾向于腋窝SMLN。D*的敏感度为52.7%,特异度为75.0%,均低于D值,此时最佳诊断阈值为17.5×10-3mm2/s,大于该值则考虑腋窝SMLN 可能性大,反之则倾向于腋窝BLN。ADC 值的敏感度为78.2%,特异度为61.3%,最佳诊断阈值为0.836×10-3mm2/s,大于该值则考虑腋窝BLN,小于该值则提示腋窝SMLN 可能性大。D、D*及ADC 值的AUC 比较,其差异均无统计学意义(P>0.01),三者对乳腺癌腋窝SMLN 的鉴别均具有良好的诊断效果,但根据其AUC值、敏感度和特异度的数值比较,D 值鉴别诊断的效能更大。
3.4 本研究的局限性
本研究的局限性:(1)本研究的样本量仍然相对较少,样本数据存在偏差的可能;(2)纳入本研究健康志愿者的BLN 样本仅通过影像、临床及随访证实,未获得病理学证实,结果可能存在偶然性,需后续研究进一步验证;(3)本研究为单中心的研究,样本量有限,需要多中心、多型号及不同场强的MRI 仪器扫描进一步验证。
4 结论
综上所述,IVIM-DWI 可为乳腺癌腋窝SMLN 的诊断提供定量信息,IVIM-DWI参数的D值具有较高的诊断效能,在鉴别腋窝SMLN 和BLN 上,其敏感度及特异度均优于传统ADC 值。IVIM-DWI 为临床提供较为准确的预测腋窝SMLN 的方法,对乳腺癌患者的分期和治疗具有一定的指导意义。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:高明设计本研究的方案,对稿件重要内容进行了修改;蒋伟起草和撰写稿件,获取、分析或解释本研究的数据;邓虹、张翔、贺绍云、赵雅琪获取、分析或解释本研究的数据,对稿件重要内容进行了修改;张翔获得广东省自然科学基金的资助。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。