柏苓颗粒的降尿酸效果及其初步作用机制
丁飞艳, 郑茗冉, 吴振, 王立强, 侯志勇,3
(1. 华侨大学 生物医学学院, 福建 泉州 362021;2. 厦门大学 药学院, 福建 厦门 361102;3.中国人民解放军联勤保障部队第962医院, 黑龙江 哈尔滨 150086)
血清尿酸盐浓度过高是痛风发生的最重要因素,人的血尿酸饱和阈值是0.408 moL·L-1,临床诊断的高尿酸血症(HUA)即血尿酸浓度达到或超过饱和阈值.当血尿酸浓度持续超过饱和阈值,且没有及时治疗时,血浆中会析出尿酸钠晶体,高尿酸血症会进一步导致慢性痛风[1].在中药复方治疗HUA的应用中,不仅可以通过辨证下药给患者提供多元化治疗选择,而且配伍加减可以在很大程度上增强治疗效果,减少可能存在的副作用[2-3].柏苓汤剂是国内医院院内制剂,全方由黄柏、苍术、土茯苓、薏苡仁、鸡血藤、忍冬藤、甘草与牛膝组成,黄柏、苍术清湿热、除实火为君药,薏苡仁、土茯苓祛湿除痹为臣药,忍冬藤、鸡血藤祛风通络、清热活血为佐药,甘草、牛膝补益肝肾为使药.全方共奏祛风除湿、退痹通络之效,是治疗HUA与急性痛风性关节炎的复方制剂.为改善柏苓汤剂的应用性,本文对柏苓颗粒的降尿酸效果及其初步作用机制进行研究.
1 实验材料
1.1 实验试剂
柏苓颗粒(实验室自制);氧嗪酸钾(上海市颖心实验室生产);非布司他(浙江省杭州市朱养心药业有限公司);黄嘌呤氧化酶(XOD)试剂盒、腺苷脱氨酶(ADA)检测试剂盒、尿酸(SUA)试剂盒、肌酐(Cr)试剂盒、尿素氮(BUN)试剂盒(江苏省南京市建成科技有限公司);羧甲基纤维素钠(安徽省淮南市山河药辅有限公司);乙醚(上海市国药集团);质量分数为10%的水合氯醛、次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)试剂盒、有机阴离子转运体1(OAT1)抗体、尿酸阴离子转运体1(URAT1)抗体(广东省深圳市华诺生物科技有限公司);二喹啉甲酸(BCA)试剂盒、放射免疫沉淀(RIPA)裂解液(强)、5×蛋白上样缓冲液、增强型化学发光(ELC)试剂盒(河南省郑州市普利莱生物科技有限公司);快速SDS-PAGE凝胶制备试剂盒、脱脂奶粉、辣根过氧化物酶(HRP)标记的二抗(北京市庄盟国际生物基因科技有限公司).
1.2 实验仪器
TGL-16型台式高速冷冻离心机(上海市亚速旺公司);InfiniteM 200型多功能酶标仪(瑞士帝肯公司);DYY-74型电泳仪(北京市六一仪器厂);LC-SFJ-10型手持式高速匀浆机(上海市力辰邦西仪器科技有限公司);凝胶成像仪(北京市大龙仪器有限公司).
1.3 实验动物
SPF级雄性SD大鼠质量为(200±20) g(福建省福州市吴氏实验动物贸易有限公司),许可证号为SCXK(京)2019-0008.
2 实验方法
2.1 溶液的配制
柏苓颗粒的人用剂量为70.00 g·d-1,大鼠临床等效剂量为6.30 g·kg-1(根据体表面积等效剂量折算表[4]),柏苓颗粒高、中和低剂量组剂量分别按大鼠临床等效剂量的4,2和1倍进行设置,分别为25.20,12.60,6.30 g·kg-1.氧嗪酸钾与非布司他不溶于水,均使用质量分数为1.2%(称取6.00 g羧甲基纤维素钠,加热搅拌溶解于500 mL蒸馏水)的羧甲基纤维素钠溶液制成混悬液给药.称取3.00 g氧嗪酸钾,溶于100 mL的羧甲基纤维素钠溶液,制得氧嗪酸钾混悬液,以0.30 g·kg-1剂量给药.将非布司他研碎成细粉末,称取0.18 g非布司他粉末.溶于500 mL的羧甲基纤维素钠溶液,制得非布司他混悬液,以0.003 6 g·kg-1剂量给药.所有药物均当天现配.
2.2 分组与造模给药
将42只雄性大鼠随机分为7组,分别为空白组、模型组、阳性对照组(非布司他组)、柏苓汤剂组、柏苓颗粒高、中、低剂量组.大鼠HUA模型建立如下:给空白组大鼠灌胃蒸馏水,其余各组大鼠灌胃氧嗪酸钾混悬液,每天给药1次,连续造模10 d;最后一次灌胃1 h后,使用乙醚麻醉,对眼眶进行采血并检测SUA浓度;统计分析后,确定造模成功,即所有模型组大鼠的SUA浓度与空白组大鼠的差异有统计学意义(P<0.05),停止造模并开始给药;给空白组和模型组大鼠灌胃蒸馏水,给其余实验组大鼠灌胃相应剂量的药物,每天给药1次,连续14 d.
2.3 状况的观察
从实验造模开始,在第1,10,17,24天称取大鼠的体质量,同时观察大鼠的活动、行为状态,饮食饮水量及尿液粪便排泄情况.
2.4 血清尿酸浓度的测定
造模第10 d,给大鼠灌胃氧嗪酸钾1 h后,使用乙醚麻醉,采用0.05 mm毛细管取1 mL的眼眶血,常温条件下静置2 h,析出血清,于3 500 r·min-1低速离心10 min(4 ℃),分离得到血清,参照SUA试剂盒说明,每个样本设置3个复孔,平行测定3次血清给药前SUA浓度并取平均值.
末次分组灌胃给药后,各组大鼠禁食不禁水过夜,按大鼠体质量每100 g腹腔注射水合氯醛1 mL进行麻醉,心脏取血后,静置2 h,于3 500 r·min-1低速离心10 min(4 ℃),分离得到血清,参照SUA试剂盒说明,将每个样本设置3个复孔,平行测定3次血清给药后SUA浓度并取平均值.
2.5 血清ADA和XOD活性的测定
参照ADA和XOD试剂盒说明,每个样本设置3个复孔,平行测定3次血清ADA和XOD活性并取平均值.
2.6 肝脏ADA,XOD与HGPRT活性的测定
将肝组织用磷酸缓冲盐溶液(PBS缓冲液)洗去表面血渍,将肝组织与质量分数为0.9%生理盐水按质量体积比为1∶9的比例进行混合,在冰上充分匀浆,于3 500 r·min-1分离两次,每次5 min.取上清液,参照XOD,ADA与HGPRT试剂盒说明,分别测定肝组织上清液OD值,每个样本设置3个复孔,平行测定3次肝脏给药后XOD,ADA与HGPRT活性并取平均值.
2.7 血清Cr和BUN浓度的测定
参照肌酐(Cr)与尿素氮(BUN)试剂盒说明,每个样本设置3个复孔,分别平行测定3次血清Cr和BUN浓度并取平均值.
2.8 肾脏OAT1和URAT1蛋白相对表达水平的测定
将肾组织与裂解液按质量体积比为1∶10的比例混合,于冰上裂解,再使用匀浆机进行间隔10 s匀浆3~5 s的处理,充分裂解30 min,置于3 500 r·min-1(4 ℃)条件下离心两次,每次5 min,取上清液匀浆蛋白,总蛋白质量浓度使用BCA试剂盒测定.将各样品与蛋白上样缓冲液按质量体积比为4∶1的比例混匀,煮沸10 min,变性后,放于4 ℃保存.按照凝胶制备试剂盒的使用说明制胶,并以120 μg蛋白上样量进行蛋白凝胶电泳,并采用湿转法进行转膜.使用质量分数为5%的脱脂奶粉室温封闭膜1 h,加入一抗,于4 ℃下孵育过夜;再次洗膜后,加入HRP标记的二抗充分覆盖膜表面,室温孵育1 h;最后,使用 ECL进行发光显影,用ImageJ软件分析各目标条带的灰度值并进行统计分析,使用β-actin作为内参蛋白,观察并计算各组OAT1和URAT1蛋白相对表达水平.
2.9 统计学处理
3 实验结果与分析
3.1 大鼠状况
实验过程中,各组大鼠行为活泼,反应迅速,精神良好,毛发光洁干燥,进食、饮水量保持正常.造模期间,所有大鼠粪便软硬程度适中,除空白组外,灌胃氧嗪酸钾的大鼠尿液偏黄,尿液增多.在给药期间,所有大鼠粪便软硬程度适中,除模型组大鼠尿液偏黄外,其他组大鼠尿液颜色正常.实验期间,所有大鼠体质量有所增长.大鼠体质量的变化情况,如图1所示.图1中:m为大鼠质量;t为天数;高、中、低剂量组分别为柏苓颗粒高、中、低剂量组.由图1可知:在同一时间内,与空白组相比的模型组、非布司他组、柏苓汤剂组及柏苓颗粒高、中、低剂量组大鼠体质量差异不具有统计学意义(P>0.05),说明各实验组用药对大鼠的生存状况没有明显影响.

图1 大鼠体质量的变化情况Fig.1 Changes in body mass of rats
3.2 柏苓颗粒对给药前后血清尿酸浓度的影响
各组大鼠给药前、后血清SUA浓度,如表1所示.表1中:n为大鼠数量;c0(SUA)为给药前SUA浓度;c1(SUA)为给药后SUA浓度.
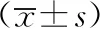
表1 各组大鼠的给药前、后血清SUA浓度Tab.1 Concentration of SUA in serum of each group of rats before and after administration
由表1可知:经氧嗪酸钾灌胃造模的其他组大鼠血清尿酸极显著高于空白组大鼠,说明HUA模型建立成功;模型组大鼠血清SUA浓度极显著高于空白组大鼠,说明结果有意义,具有参考价值;非布司他组大鼠及柏苓颗粒高、中剂量组大鼠的给药后SUA浓度极显著低于模型大鼠,柏苓汤剂组大鼠与柏苓颗粒低剂量组大鼠的给药后SUA浓度显著低于模型组大鼠,柏苓颗粒剂组大鼠的给药后SUA浓度呈剂量性降低趋势,说明柏苓颗粒与柏苓汤剂都具有显著的降尿酸效果,且高、中剂量柏苓颗粒的降尿酸效果比柏苓汤剂更显著,与非布司他相当.
3.3 柏苓颗粒对血清XOD和ADA活性的影响
各组大鼠的给药后血清XOD与ADA活性,如表2所示.表2中:zs(XOD)/nkat·L-1为给药后血清XOD活性;zs(ADA)/nkat·L-1为给药后血清ADA活性.

表2 各组大鼠的给药后血清XOD与ADA活性Tab.2 Activity of XOD and ADA in serum of each group of rats after administration
由表2可知:模型组大鼠的血清XOD和ADA活性极显著高于空白组大鼠,非布司他组大鼠的血清XOD活性的影响对比模型组大鼠极显著下降,而对血清ADA无明显影响;柏苓汤剂组、柏苓颗粒高、中剂量组大鼠的血清XOD,ADA活性对比模型组大鼠极显著下降,柏苓颗粒低剂量组大鼠的血清XOD,ADA活性显著下降,说明柏苓颗粒能显著抑制血清XOD和ADA活性.
3.4 柏苓颗粒对肝脏XOD,ADA和HGPRT活性的影响
各组大鼠的给药后肝脏XOD, ADA与HGPRT活性,如表3所示.表3中:zl(XOD)为给药后肝脏XOD活性;zl(ADA)给药后肝脏ADA活性;zl(HGPRT)为给药后肝脏HGPRT活性.
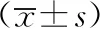
表3 各组大鼠的给药后肝脏XOD, ADA与HGPRT活性Tab.3 Liver XOD, ADA, and HGPRT activity in each group of rats after administration
由表3可知:模型组大鼠的肝脏XOD和ADA活性极显著高于空白组大鼠,其中,非布司他组、柏苓颗粒高、中剂量组大鼠的肝脏XOD活性对比模型组大鼠极显著下降,柏苓颗粒低剂量组大鼠的肝脏XOD活性显著下降;除非布司他组大鼠外,其他给药组大鼠的肝脏ADA活性均极显著低于模型组大鼠;模型组大鼠的肝脏HGPRT活性较空白组大鼠有下降趋势,但无统计学意义,柏苓颗粒组大鼠的肝脏HGPRT活性有呈剂量上升趋势,但与模型组大鼠相比,无统计学意义,说明柏苓颗粒能显著降低XOD与ADA活性,对HGPRT活性无明显影响.因此,柏苓颗粒对嘌呤代谢酶具有选择性,而XOD与ADA是其主要作用靶点,降尿酸作用也与XOD,ADA作用靶点有一定相关性.
3.5 柏苓颗粒对BUN和Cr浓度的影响
BUN和Cr是评估肾功能的两个指标,能反映肾小球的滤过率,当肾小球滤过功能损坏,肾功能降低时,血清BUN和Cr浓度会异常升高.各组大鼠的血清BUN和Cr浓度,如图2所示.图2中:c(BUN)为BUN浓度;c(Cr)为Cr浓度.由图2可知:各组大鼠的血清BUN和Cr的浓度差异无统计学意义,说明氧嗪酸钾造模方法不会损害大鼠肾脏,以及柏苓颗粒与柏苓汤剂对HUA 大鼠无肾损伤,安全性良好.

(a) BUN (b) Cr图2 各组大鼠的血清BUN和Cr浓度Fig.2 Concentrations of BUN and Cr in serum of each group of rats
3.6 柏苓颗粒对OAT1 和URAT1蛋白相对表达水平的影响
OAT1和URAT1蛋白免疫印迹条带图,如图3所示.各组大鼠的肾脏OAT1与URAT1蛋白相对表达水平,如图4所示.由图4可知:高剂量柏苓颗粒与非布司他、柏苓汤剂对比模型组能极显著上调肾脏OAT1蛋白相对表达水平,中剂量柏苓颗粒能显著上调OAT1蛋白相对表达水平,低剂量柏苓颗粒对OAT1蛋白相对表达水平的影响不显著;对比模型组,高、中剂量柏苓颗粒与柏苓汤剂均有极显著抑制效果,非布司他与低剂量柏苓颗粒对URAT1相对表达水平均无统计学意义.因此,高剂量柏苓颗粒对OAT1和URAT1蛋白相对表达水平的影响与柏苓汤剂相当,其促进尿酸排泄机制可能与促进尿酸的分泌与重吸收的OAT1及URAT1蛋白有关.
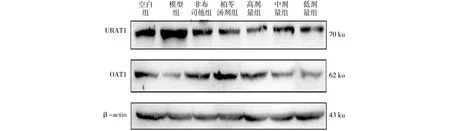
图3 OAT1和URAT1蛋白免疫印迹条带图Fig.3 Western blot band diagram of OAT1 and URAT1 proteins
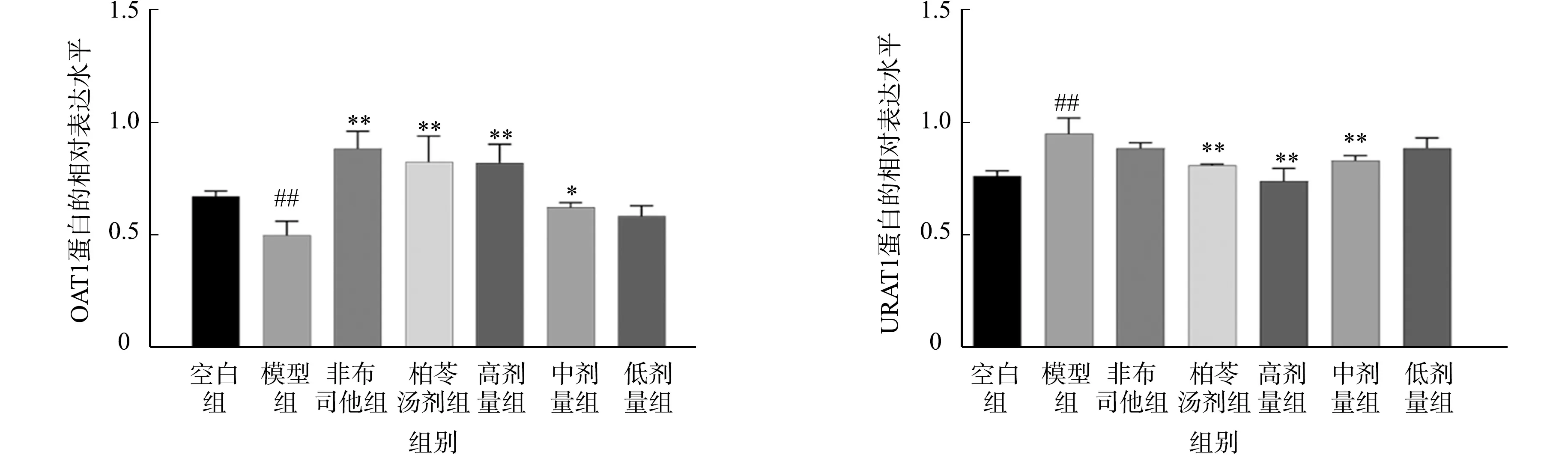
(a) OAT1 (b) URAT1图4 各组大鼠的肾脏OAT1与URAT1蛋白相对表达水平Fig.4 Relative expression levels of proteins of OAT1 and URAT1 in kidneys of each group of rats
4 结论
氧嗪酸钾作为尿酸酶的竞争性抑制剂,它能结合大鼠体内的尿酸酶并显著降低尿酸酶活性,从而阻碍尿酸分解.采用灌胃氧嗪酸钾持续10 d,建立HUA模型,效果显著.但由于后续14 d的给药期间停止造模,除空白组外其他组大鼠血尿酸都有所下降,说明结果有意义,具有参考价值.
肝脏是嘌呤合成及回收的主要部位,嘌呤碱基在肝脏中可直接合成产生尿酸的原料(嘌呤核苷酸).催化嘌呤分解代谢的酶主要分为抑制尿酸合成酶与促进尿酸合成酶两类,HGPRT是肝脏中一种抑制尿酸的生成的主要代谢酶,能促进鸟嘌呤与次黄嘌呤回收,防止嘌呤碱潴留[5].HGPRT参与嘌呤回收过程并控制尿酸的合成,HGPRT质量分数升高,可增加嘌呤碱回收量,进而减少尿酸合成的机会,相反地,HGPRT质量分数减少,嘌呤碱回收减少,尿酸合成的原料增多,血尿酸水平亦随之升高.ADA和XOD是嘌呤代谢过程中促尿酸合成的关键酶,分别限制着腺嘌呤与黄嘌呤形成尿酸的速率,其活性越高,尿酸合成水平随之升高.HGPRT,ADA与XOD的活性相对反应了鸟嘌呤、腺嘌呤与次黄嘌呤代谢生成尿酸的情况.柏苓颗粒对肝脏HGPRT浓度无显著影响,而抑制了ADA这一合成尿酸前产物次黄嘌呤核苷的关键酶活性,以及抑制了生成尿酸的XOD的活性,说明柏苓颗粒降尿酸的靶点可能与抑制XOD与ADA活性有关,而与HGPRT无关.
除了抑制尿酸生成的关键酶外,增加尿酸的排泄量是另一降尿酸的途径.大部分尿酸盐的排泄需经过肾小管上皮的尿酸重吸收与排泄转运蛋白[6].OAT1蛋白是肾脏中一个与尿酸分泌密切相关的蛋白[7],其相对表达水平增加可促使体内尿酸排出体外,而达到降低尿酸的作用.URAT1蛋白位于肾脏近曲小管,是介导大部分尿酸重吸收的蛋白,也是目前研究较为广泛的尿酸排泄蛋白[8].实验主要研究了柏苓颗粒对大鼠肾脏中控制尿酸盐重吸收及排泄的URAT1与OAT1蛋白的影响.在中医的理论中,湿热是痛风发作的致病因素,而清利湿热的方剂是用药首选,其中,利水祛湿的中药能显著增加尿酸排泄的效果[2],柏苓颗粒中的土茯苓、薏苡仁都有利水渗湿的功效,能促进尿酸经肾脏排泄,且对肾脏有一定保护作用[9-12].因此,柏苓颗粒降尿酸效果良好,无明显毒副作用,其作用机制与抑制ADA与XOD的活性及减少URAT1蛋白相对表达水平、增加OAT1蛋白相对表达水平相关.

