BRAF基因突变型甲状腺癌患者血清TSH TgAb MK表达及临床意义
刘培红, 安黎云, 邵茹彬, 陈 芳
(联勤保障部队第九八〇医院检验科, 河北 石家庄 050082)
甲状腺癌(Thyroid carcinoma,TC)在我国发病率约为19%~67%,且经过规范治疗后仍有5%~10%患者表现为极强侵袭性[1,2]。抗鼠科肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homologue B1,BRAF)基因突变可驱动TC发生发展,调查显示TC患者中BRAF基因V600E突变检出率约为83%[3]。细针穿刺细胞学活检是临床诊断BRAF基因突变型TC的金标准,但该检查会损伤身体,在TC发病前血清学指标已发生明显变化,并可能作为诊断TC的潜在标志物,因而血清学指标是否可作为BRAF基因突变型TC的诊断标志物成为研究重点。促甲状腺激素(Thyroid-stimulating hormone,TSH)是由垂体前叶分泌的生长因子,可调控自身下游或其他信号通路、基因突变等影响TC发生发展[4]。甲状腺球蛋白抗体(Anti-thyroglobulin antibodies,TgAb)是甲状腺组织或细胞分泌甲状腺球蛋白(Tg)时产生的,其水平升高可促进TC发生[5]。中期因子(Midkine,MK)属于分泌型细胞因子,可通过促血管生成、促分裂等形式参与TC发生发展过程[6]。目前TSH、TgAb、MK在BRAF基因突变型TC中应用研究尚未见报道,基于此,本研究主要探讨BRAF基因突变型TC患者血清TSH、TgAb、MK水平,分析其与BRAF基因突变相关性,并分析其对突变型TC的诊断价值。
1 资料与方法
1.1一般资料:选取2021年1月至2022年1月本院收治的BRAF基因突变型TC患者83例作为突变组,遵循1∶1分配原则选取同期BRAF基因野生型TC患者83例作为野生组。两组一般资料比较见表1。本研究符合《赫尔透辛基宣言》。纳入标准:符合甲状腺癌诊断标准[7],且经病理学活检证实;首次确诊者;未合并其他恶性肿瘤;未接受放化疗、免疫治疗者;近6个月内无手术治疗史;意识清楚且无沟通障碍;研究对象知情同意且签署知情同意书。排除标准:长期使用糖皮质激素类药物者;合并其他内分泌腺疾病;伴有甲状腺功能亢进、甲状腺弥漫性病变等其他甲状腺疾病者;既往有酗酒、吸毒史者。

表1 两组人口学资料临床病理特征血清TSH TgAb MK水平及相关性
1.2方 法
1.2.1收集临床资料:通过病历收集两组研究对象临床资料,包括性别、年龄、体质量指数(BMI)、吸烟史、慢性疾病史、肿瘤直径、肿瘤分期、肿瘤分化程度、肿瘤类型、肿瘤数目、被膜侵犯、颈部淋巴结转移、中央区淋巴结转移。
1.2.2PCR法检测BRAF基因突变:研究对象均行超声引导下甲状腺穿刺活检,获取甲状腺癌组织,采用石蜡包埋组织,参照DNA提取试剂盒(北京百奥莱博科技有限公司)提取组织DNA,依据荧光PCR试剂盒(厦门艾德生物公司)配置反应体系,PCR法扩增组织中BRAF基因第15外显子,应用3730/3730xl型自动化基因分析仪(美国ABI公司)进行测序,按照Chromas软件对比测序结果,标记出野生型、突变型基因序列,BRAF基因V600E(AGC)发生突变,即A→C,本研究中将V600E发生错义突变者纳入突变组,否则为野生组。
1.2.3检测血清TSH、TgAb、MK水平:抽取两组(入组时)静脉血5mL,应用XZ21K-T离心机(长少湘智公司)离心12min(5000r/min)后取血清,采用ELISA法检测血清MK水平,美国R&D公司提供检测试剂盒。采用全自动电化学发光免疫分析法检测血清TSH水平(上海罗氏制药有限公司),应用Unicel Dxi800 Access免疫分析仪(美国贝克曼库尔特公司)检测血清TgAb水平。
1.3观察指标:①对比两组(入组时)血清TSH、TgAb、MK水平,分析其与BRAF基因突变型相关性。②分析BRAF基因突变型TC影响因素。③评价(入组时)血清TSH、TgAb、MK对BRAF基因突变型TC的诊断价值,分析其对BRAF基因突变型TC危险度的影响。
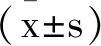
2 结 果
两组肿瘤分期、被膜侵犯、肿瘤数目、颈部淋巴结转移、中央区淋巴结转移及血清TSH、TgAb、MK水平比较差异有统计学意义(P<0.05),Spearman分析显示,血清TSH、TgAb、MK水平与BRAF基因突变呈显著正相关(r=0.639、0.715、0.593,P均<0.05),详见表1、表2;以TC患者BRAF基因是否突变为因变量,表1中具有统计学意义指标为自变量纳入Logistic回归方程,未调整模型和调整后模型1显示,随着血清TSH、TgAb、MK水平升高,TC患者BRAF基因突变风险也将增加,血清TSH、TgAb、MK水平是BRAF基因突变型TC高危因素(P<0.05),详见表3;以BRAF基因突变型TC为阳性标本,BRAF基因野生型TC为阴性标本绘制ROC曲线,结果显示,三者联合诊断BRAF基因突变型TC的AUC为0.947(95%CI:0.901~0.976),敏感度、特异度分别为86.75%、90.36%,明显优于血清TSH[AUC为0.739(95%CI:0.665~0.804)]、TgAb[AUC为0.798(95%CI:0.729~0.857)]、MK[AUC为0.737(95%CI:0.663~0.802)]单一诊断效能,详见表4、图1;以ROC曲线中血清TSH、TgAb、MK表达截断值为界限分为高表达和低表达。经RR检验可知,TSH、TgAb、MK高表达者BRAF基因突变型TC危险度是低表达者的1.500、1.625、2.617倍,详见表5。

图1 血清TSH、TgAb、MK单一及联合诊断BRAF基因突变型TC价值

表2 赋值情况
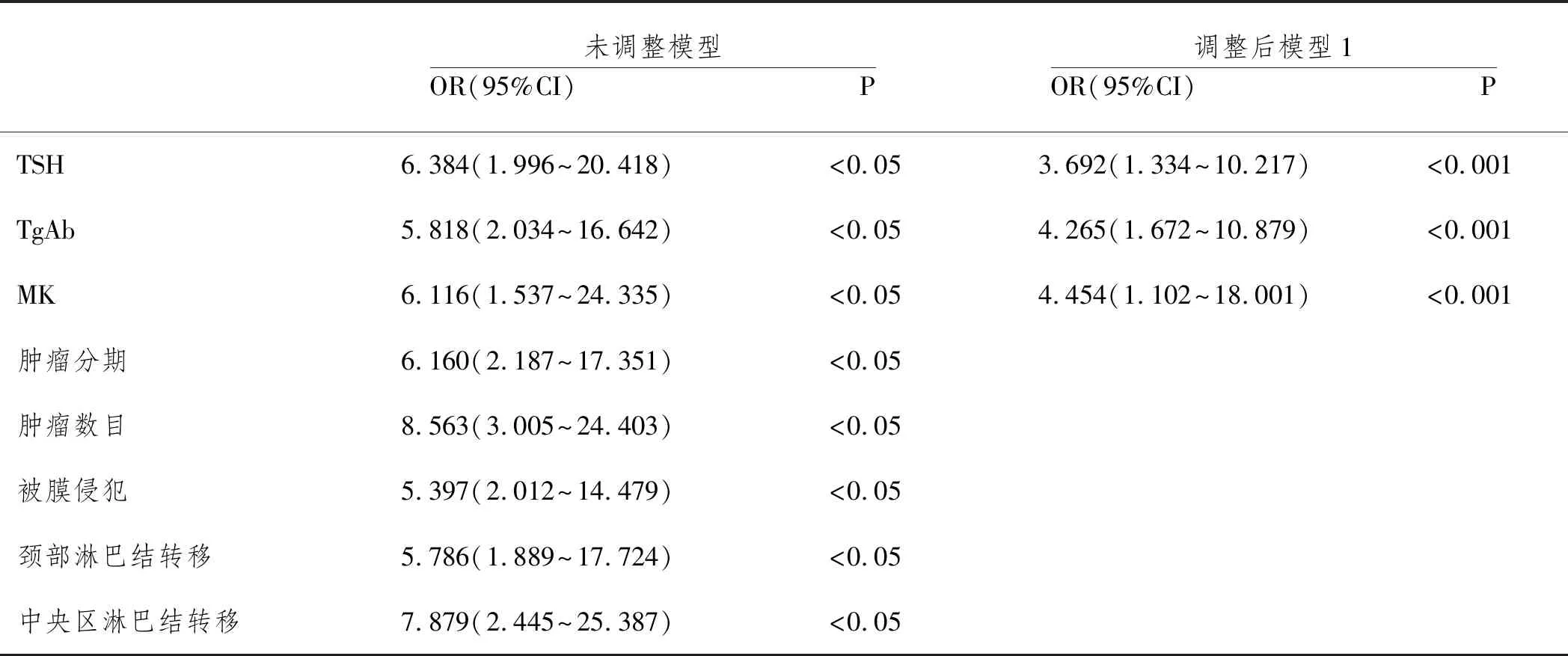
表3 BRAF基因突变型TC多因素分析

表4 ROC曲线对比
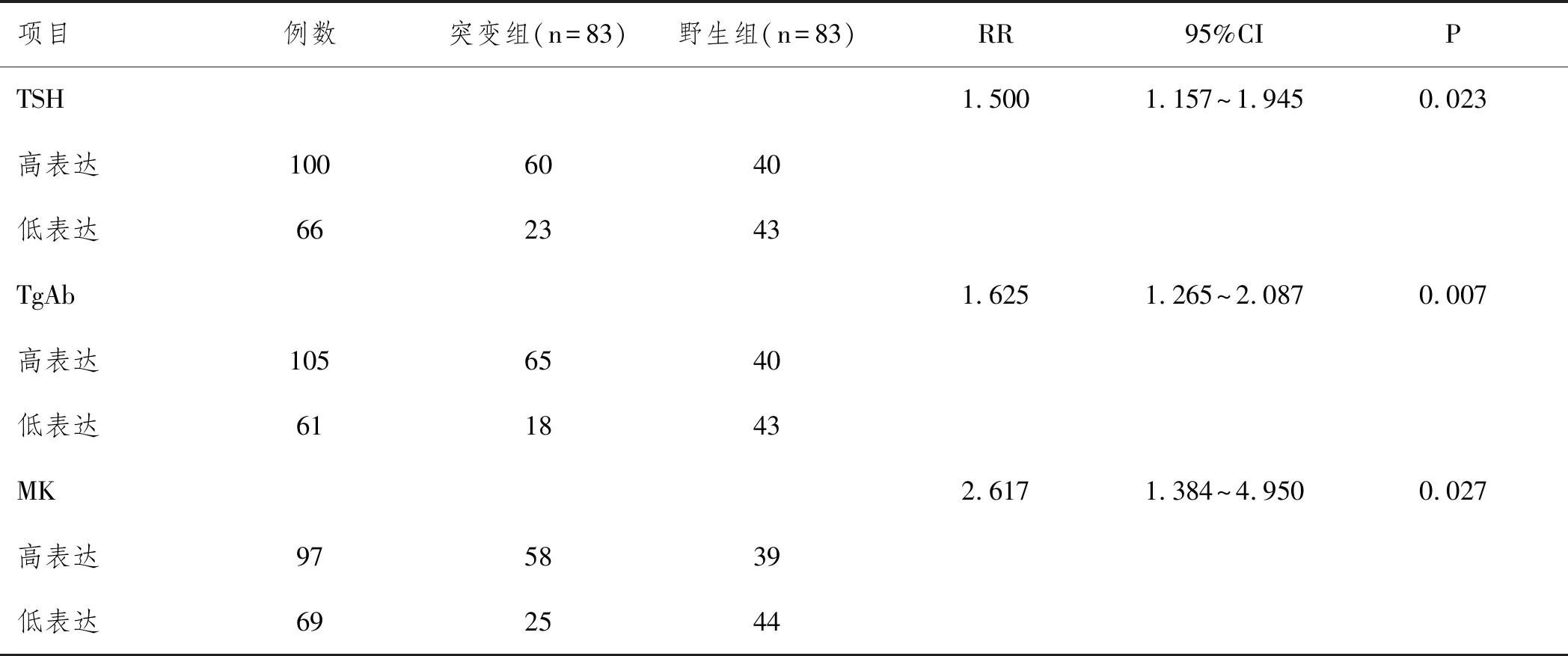
表5 血清TSH TgAb MK表达对BRAF基因突变型TC危险度的影响
3 讨 论
TC发病机制与碘缺乏、自身免疫缺陷、电离辐射、遗传因素、毛细血管形成、肿瘤细胞穿透性增高有关,BRAF基因突变主要为V600E氨基酸突变,可持续激活BRAF激酶,影响甲状腺生长[8,9]。BRAF基因突变型TC初期无典型症状,临床仅能在疾病出现明显症状后确诊,导致其错失最佳治疗时期,因而早期鉴别对BRAF基因突变型TC,对临床诊治、预后评估具有重要意义。
本研究结果显示,突变组血清TSH水平高于野生组,突变组TgAb水平高于野生组,且血清TgAb水平与BRAF基因突变呈正相关,提示TgAb水平升高与BRAF基因突变型TC发生发展密切相关。已知TSH水平升高与TC恶性程度有关,可增加TC淋巴结转移风险[10,11]。提示TSH水平升高可能参与BRAF基因突变型TC发生过程。分析认为TSH可增强过氧化物酶活性,促进甲状腺上皮细胞蛋白质合成,刺激癌变细胞生长,加快TSH进展。TgAb与Tg结合后可激活自然杀伤细胞,损伤甲状腺上皮细胞,参与TC发生发展过程[12]。由此推测TgAb水平升高可能通过损伤甲状腺细胞,参与BRAF基因突变型TC发生过程。
本研究结果显示,突变组MK水平高于野生组,且MK水平与BRAF基因突变呈正相关,提示MK高表达可能增加BRAF基因突变发生风险。MK在恶性肿瘤组织中呈高表达,可参与多个组织细胞分化、增殖、新生血管形成,且与肿瘤进展有关[13]。既往研究表明BRAF基因突变可能引起TSH、TgAb、MK表达异常[14]。本研究发现血清TSH、TgAb、MK水平升高是BRAF基因突变TC高危因素,分析其原因可能为BRAF基因突变可能导致甲状腺分泌不足,引起TSH水平升高、Tg分泌异常,刺激机体产生免疫应答释放TgAb,增加甲状腺细胞癌变风险;BRAF基因突变可能减弱MK与硫酸肝素的亲和力,促进嗜中性粒细胞、巨噬细胞等多种细胞移动,致使TC生长及转移。但TSH、TgAb、MK对BRAF基因突变型TC的诊断价值尚未可知,本研究结果显示,TSH、TgAb、MK联合诊断BRAF基因突变型TC的AUC明显优于单一诊断效能,提示联合检测TSH、TgAb、MK水平可提高BRAF基因突变型TC的诊断效能。
综上所述,BRAF基因突变型TC患者血清TSH、TgAb、MK水平升高,且与BRAF基因突变呈正相关,其水平升高可增加TC患者BRAF基因突变发生风险,联合检测其水平可用于鉴别诊断BRAF基因突变型TC,可为早期治疗干预提供参考依据。

