益生菌发酵饲料条件优化及营养价值评定
万 里,吴国芳,2,王 磊*,姚志芳,张志鹏,张俊峰
(1. 青海大学 畜牧兽医科学院/青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016;2. 青海省高原家畜遗传资源保护及创新利用重点实验室,青海 西宁 810016)
由于饲料的短缺和新冠疫情的影响,饲料原料价格持续上涨。如何寻找新型饲料来源以及解决抗生素禁用的问题成为现代养殖的研究热点[1]。利用微生物对饲料进行发酵可以使饲料产生较多的微生物代谢小分子[2]。目前使用最多的是固态发酵,原料经过微生物进行固态发酵后,其含有的多糖类化合物、脂肪、蛋白质等一些大分子物质被代谢为可以直接吸收运用的小分子物质,同时可以在一定程度上降低原料中抗营养因子含量,使发酵后的原料更易被动物机体消化和吸收。
毕赤酵母( Pichia pastoris) 是一类能够利用甲醇作为唯一碳源和能源生长的单细胞真核生物。毕赤酵母表达系统是近年来发展最为迅速的一种新型外源蛋白真核表达系统,被广泛应用于多种不同领域且成功表达了许多基因工程产品[3]。目前的研究表明,毕赤酵母已在食品以及饲料领域取得了一定的进展,如在食品领域果糖酶成功地被表达[5],在饲料领域植酸酶、木聚糖酶等被成功表达[6]。另外有研究表明,用毕赤酵母菌发酵豆粕,可以使豆粕产生酸香味,并可提高豆粕中CP的含量、降低NDF、ADF的含量,极大地改善豆粕的品质[7]。
由于目前毕赤酵母作为微生态制剂在畜牧养殖中的报道较少,因此本试验选用1株毕赤酵母菌对精补料进行发酵,从发酵饲料发酵条件优化、发酵品质来评价毕赤酵母菌的发酵效果,为毕赤酵母菌作为益生菌发酵饲料提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 菌种 毕赤酵母菌(Pichia yeast JZ10,菌种保藏号CCTCC M 2020843)。该菌株由青海大学畜牧兽医科学院动物营养与饲料科学试验室分离保藏。
1.1.2 培养基 YPD液体培养基(1L):酵母提取物10 g、蛋白胨20 g、葡萄糖20 g、超纯水1 000 mL。培养基在121 ℃下灭菌20 min。
1.1.3 饲料配方及营养水平 饲料配方及营养水平见表1。

表1 饲料配方及营养水平Table 1 Feed formula and nutritional level
1.1.4 仪器和设备 便携式pH计、培养箱、电子天平、高压立式蒸汽灭菌锅、洁净工作台、500 mL丝口试剂瓶、多功能酶标仪、超速离心机、SZC-101脂肪测定仪、SLQ-202半自动粗纤维测定仪、自动凯氏定氮仪。
1.2 方 法
1.2.1 菌种活化 将所筛毕赤酵母菌接入YPD固体培养基28 ℃培养48 h,挑取单菌落接入20 mL无菌YPD液体培养基28 ℃培养48 h(一级菌种),取20 mL一级菌种接入2 L无菌YPD液体培养基28 ℃培养48 h(二级菌种)。
1.2.2 发酵条件优化 使用正交设计3因素3水平进行优化,如表2所示。用电子秤称取2.0 kg精补料,按照正交设计表算出所需酵母菌以及所用水的体积数(扣除菌液总体积),将菌液倒入水中,摇匀,均匀地洒在精补料上,拌匀之后分别装入500 mL的丝口试剂瓶中,每组4个重复,压实、盖好盖子,按照正交设计的温度分别放入到3个对应的培养箱中,发酵5 d后取出,测定相应指标。以上一步优化条件得到的最优组合进行最优发酵时间的确定,发酵时间为:0、1、3、5、7、14 d,分别测定其营养成分和霉菌毒素含量。

表2 L9(34)正交表Table 2 Orthogonal test design of L9(34)
1.2.3 指标测定 氨态氮(NH3-N)、可溶性糖(SS)、淀粉(ST)(氨态氮、可溶性糖、淀粉含量检测试剂盒,购自北京索莱宝科技有限公司),pH(便携式pH计)。黄曲霉毒素B1(AFB1)、呕吐毒素(DON)、玉米赤霉烯酮毒素(ZEN)(ELISA检测试剂盒,购自众美生物),CP含量测定采用凯氏定氮法[8],NDF、ADF含量测定采用范氏分析法[9],EE含量测定采用索氏抽提法[10]。
1.2.4 数据统计与分析 正交设计结果采用极差分析法,饲料成分指标数据先用Excel 2010初步整理,然后使用SPSS 24.0软件中的Anova程序对数据进行单因素方差分析,用Duncan法进行多重比较,显著水平为0.05,结果以平均数±标准差表示。文章中的图片使用Origin 2018绘制而成。
2 结果与分析
2.1 正交设计参数结果
从表3中通过极差分析,pH、NH3-N、SS受因素的影响程度为B>C>A,ST为C>B>A,即pH、NH3-N、SS受因素B的影响最大,ST受因素C的影响最大,pH在B3水平下较低,因此pH的优化组为F3、F9,ST在C1水平下较高,因此ST的优化组为F1,NH3-N在B1、B2水平下较低,因此NH3-N的优化组为F1、F5,SS在B1水平下较高,因此SS的优化组为F1、F4,此时比较F1、F3、F4、F5、F9组,F1组pH太高,F3、F4、F9组NH3-N含量太高,均不符合要求,而F5组只有SS含量较低,其余指标都符合要求,因此最优组为F5组。

表3 正交结果表Table 3 Orthogonal result table
2.2 发酵天数对饲料指标的影响
2.2.1 对饲料常规养分的影响 如图1所示,饲料中CP含量随发酵天数的增加均显著高于第0天(P<0.05),其余天数之间蛋白含量差异不显著(P>0.05);发酵天数对EE的含量影响差异不显著(P>0.05);NDF、ADF的含量随发酵天数的增加而显著降低(P<0.05),以第7天最低。

图1 发酵天数对饲料CP、EE、NDF、ADF含量的影响Fig. 1 The effect of fermentation days on the content of CP, EE, NDF and ADF in feed
2.2.2 对饲料NH3-N、SS、ST及pH的影响 如图2所示,饲料NH3-N的含量随发酵天数的增加,除第1d外,均显著高于第0天(P<0.05),第1、3、5、7天之间两两差异显著(P<0.05),以第7天最高,第1天最低,第14天含量与第7天差异不显著(P>0.05);ST、SS含量随发酵天数的增加均显著高于第0天(P<0.05),以第5天最高,随后开始下降;pH除发酵第1天外,均显著低于第0天(P<0.05),第5天时达到最低,随后趋于稳定。
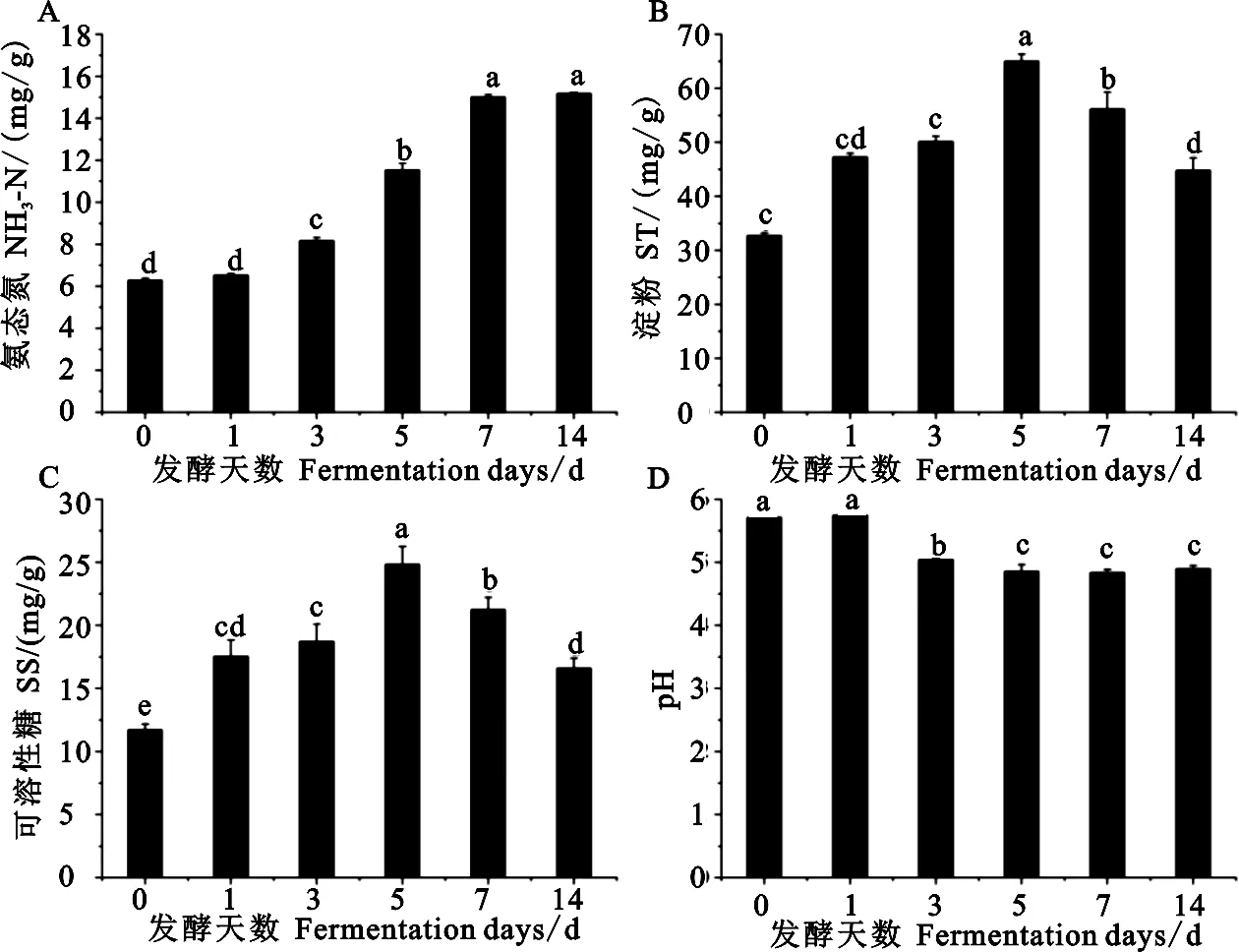
图2 发酵天数对饲料NH3-N、ST、SS含量及pH的影响Fig. 2 The effect of fermentation days on feed NH3-N, ST, SS content and pH
2.2.3 对饲料霉菌毒素的影响 如图3所示,AFB1的含量随发酵天数的增加,与第0天相比,除第1天差异不显著(P>0.05),其余天数含量都显著降低(P<0.05),以第5天含量最低;DON、ZEN的含量均随发酵天数的增加而显著降低(P<0.05),其中DON含量以第5天最低,ZEN含量以第7天最低。

图3 发酵天数对饲料霉菌毒素含量的影响Fig. 3 The effect of fermentation days on feed mycotoxin content
3 讨 论
3.1 最佳发酵条件的确定
接种量、温度、湿度及发酵时间是影响益生菌发酵效果的重要因素[11]。接种量通过改变益生菌的生长代谢来影响其发酵效果,适宜的益生菌接种量是发酵充分完全的前提条件,过多或过少均会降低益生菌发酵效果。接种量过多会使微生物在一定量的培养基中产生过多代谢物,导致环境内溶氧不足,发酵不充分,严重降低益生菌发酵效果;但接种量过少会因为微生物量小使培养基营养底物利用不完全,浪费部分营养底物,发酵不充分完全,降低发酵效果,升高发酵成本。因此,适宜的接种量是提高发酵效果的重要因素[12]。温度是益生菌生长过程中影响一系列酶和化学反应的主要因素,菌株来源和菌株种类不同则其最适生长温度有差异,在一定范围内,菌株生长繁殖速度会随温度的升高而加快。益生菌发酵时高温条件会提高酶促反应速率,增强呼吸强度,使益生菌生长代谢加快,但若提供过高的发酵温度,同时随着发酵过程不断产热,尤其在代谢旺盛期可能导致酶失活,酶促反应停滞,发酵周期随着缩短,降低最终发酵效果;反之,若温度过低,使酶促反应速率过慢,延长发酵周期,升高发酵成本[13]。因此,寻找益生菌适宜的发酵温度才能使菌株发酵达到最佳状态,提高发酵效果。
湿度也是在饲料发酵过程中具有重要影响地位的因素之一。过低的水分含量会导致发酵底物溶解性和底物膨胀程度较低,降低微生物对底物营养物质的利用率,影响微生物的生长代谢,使得发酵不充分;而过高的水分含量抑制发酵环境内氧气的流动性,影响微生物代谢,降低发酵效果,因此选择适宜的发酵湿度是提高发酵效果的重要方法[14]。发酵时间是益生菌发酵饲料过程中至关重要的影响因素。发酵时间与发酵菌株的生长特性密切相关,发酵时间过短会导致发酵进行的不完全,浪费发酵底物营养物质;而发酵时间太长致使微生物达到衰退期,其代谢物的堆积使后期发酵过慢且产生无用的副产物消耗培养基营养成分,造成不必要的浪费,同时随时间过长,杂菌生长的可能性增加,也浪费时间成本,降低发酵效果。因此,适宜的发酵条件是保证优良发酵效果的根本保证[15]。
饲料中可溶性糖、淀粉含量较高为宜,NH3-N、pH、霉菌毒素含量较低为宜。影响指标的主次序与极差的大小呈正相关,结合极差分析的结果可得到F5组最符合要求,即接种量10%,温度25 ℃,水料比1∶1。吝常华等[16]用芽孢杆菌、植物乳杆菌和酿酒酵母发酵豆粕时,得到最优条件为:接种量15%、水料比1∶1、温度31 ℃,用枯草芽孢杆菌单菌发酵时最优条件为:接种量10%、水料比1.2∶1、温度40 ℃。刘政等[17]研究表明:用酵母菌发酵豆粕的最佳条件为接种量11%、水料比1.25∶1、温度30 ℃。本实验所得到的条件部分与上述研究相一致,部分有差别,可能与测定指标、菌种不一致有关。
3.2 发酵天数对饲料营养成分的影响
饲料中的NDF、ADF 和 CP 含量是评价饲料品质最重要的指标,NDF 和 ADF 含量越低,CP 含量越高,表明饲料品质越好[18]。本试验中发酵到第7天,粗蛋白、粗脂肪含量最高,NDF、ADF含量最低,说明发酵7 d,饲料的常规品质较好。NDF、ADF含量降低的原因可能与发酵过程中产生分解纤维的酶类将植物细胞壁中的纤维降解为水溶性碳水化合物有关[19]。蛋白质含量升高可能是因为发酵初期,毕赤酵母菌作为兼性厌氧菌消耗大量氧气,使得乳酸菌大量繁殖,抑制了有害微生物的繁殖, 减少了发酵初期植物呼吸作用对蛋白质的水解[20]。淀粉含量较高的原因可能是由于加入的是酵母菌,饲料内部乳酸菌的数目较少,同型发酵乳酸菌在发酵前期快速产酸不需要消耗太多能量来维持自身生长,发酵过程中较少淀粉被利用[21]。本试验中氨态氮含量升高的原因可能是酵母菌在发酵过程中产生了少量乳酸菌,乳酸发酵过程中产生的乙酸也抑制了酵母菌等其他微生物的活动,pH维持在较高水平而使得蛋白酶活性部分受到抑制,从而氨态氮的含量较高[22]。可溶性糖含量升高可能与发酵期间乳酸菌数目较少有关,活动不够旺盛,消耗的可溶性糖较少。pH降低的原因是酵母菌在发酵过程中产酸导致酸度增加。益生菌发酵也可有效提高母猪配合饲料中粗蛋白的含量,显著降低粗纤维含量[23]。研究表明,酵母菌在发酵饲料时可显著增加饲料中CP和EE含量[24]。王小平等[25]用酵母菌和乳酸菌的复合菌剂对玉米青贮发酵,结果显示玉米青贮的CP含量显著升高、NDF、ADF含量显著下降。孙培利等[26]采用酿酒酵母和嗜酸乳杆菌复合菌种进行青稞发酵,结果淀粉含量整体提高。本试验中,所筛毕赤酵母菌JZ10发酵饲料时显著提升了饲料CP、EE、NH3-N、ST、SS含量,降低了NDF和ADF的含量,与前人研究结果相一致,因此可以说明该酵母菌可提高饲料营养价值。
3.3 发酵天数对饲料霉菌毒素的影响
饲料在制备的过程中不可避免地会感染到少数霉菌,这些霉菌通过代谢会分泌霉菌毒素,如AFB1、ZEN、DON等,动物进食饲料后健康遭受危害。已有研究表明,益生菌发酵可以降低饲料中霉菌毒素含量[27]。发酵过程中酵母菌通过消耗氧气使得乳酸菌大量繁殖,通过消耗营养物质使得酵母菌生长变慢。与乳酸菌不同的是,酵母菌的吸附产物更稳定,不太可能再次释放毒素,其原因是毒素与酵母菌细胞壁上的甘露糖形成了特定的互补结构[28]。研究结果表明,酵母菌吸附ZEA是因为其细胞壁中的功能性碳水化合物(葡甘聚糖聚合物)[29]。张丽霞[30]研究了酿酒酵母细胞壁中β-d-葡聚糖含量与霉菌毒素结合能力的关系,发现β-d-葡聚糖在ZEA吸附中起主要作用。Wang等[30-31]发现,酿酒酵母能降解ZEN。Repeckiene等[32]发现酿酒酵母对DON有良好的吸附能力,产朊假丝酵母发酵饲料时降低了饲料原料中96%的AFB1[33],利用芽孢杆菌、乳酸菌和酵母菌混合发酵可使豆渣生物饲料中呕吐毒素含量符合国家饲料卫生的限量标准[34]。本试验中发酵到第5天AFB1、DON含量降低,发酵到第7天ZEN含量降低,符合上述研究,因此可认为毕赤酵母菌可降低霉菌毒素的含量。
4 结 论
毕赤酵母菌JZ10发酵全价料的最佳条件为:接种量10%,温度25 ℃,水料比1∶1,发酵时间5~7 d,可提高饲料的营养成分,降低霉菌毒素的含量。

