幕下弥漫性胶质瘤患者预后相关因素分析
吴鸿择,亢建民
(1.天津医科大学神经内外科及神经康复临床学院,天津 300350;2.天津市环湖医院神经外科,天津 300350)
颅内原发性恶性肿瘤是难治疗的癌症之一,其5年生存率一般不超过35%;最常见的原发性颅内恶性肿瘤是胶质瘤,在中枢神经系统肿瘤中,胶质瘤占比为26.5%,占成人恶性脑肿瘤的75%[1],全世界每年约有10 万人诊断为弥漫性胶质瘤,占所有新诊断癌症的1%以下,但其发病率和死亡率均高。我国上海近30 年统计的发病率约为7/10 万~8/10 万。2007年WHO 以肿瘤组织学为标准对弥漫性胶质瘤进行分类。胶质瘤的预后与WHO 分级密切相关,但是分级下同种胶质瘤的生物学行为和预后仍有较大差异。近十年来,肿瘤分子学的研究为胶质瘤形成和发展的遗传机制、染色体和表观遗传学变化提供了新的研究方向。本研究对幕下胶质瘤患者的临床及病理学特征进行单因素和Cox 多因素回归分析,以探讨影响预后的独立因素,为患者的预后判断提供依据。
1 对象与方法
1.1 研究对象 收集2016 年6 月—2020 年6 月在天津市环湖医院就诊的幕下弥漫性胶质瘤患者35 例为研究对象,中位年龄为47.7 岁(3~72);其中男性患者23 例,女性患者12 例。临床症状多表现为头晕、行走不稳的共济失调症状(63.6%),头痛(41.8%)以及恶心、呕吐(36.4%)症状亦不少见,另外还有肢体活动障碍(18.2%)和感觉异常(16.3%)。其中卡氏功能状态评分标准(KPS 评分)<70 共21 例,KPS 评分≥70 分共14 例。本次研究收集资料不涉及患者的个人信息。纳入标准:确诊为胶质瘤的初次就诊患者,之前未经治疗;经影像学及手术中探查显示肿瘤位于小脑幕下;术后病理证实为弥漫性胶质细胞瘤。排除有原发或附加幕上病变及失访的病例。
1.2 病例资料的收集 通过电子病例系统回顾性收集患者的年龄、性别、主要临床症状、术后KPS 评分、肿瘤切除程度、α 地中海贫血伴智力低下综合征X 染色体相关蛋白(ATRX)基因突变状态、是否存在O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)甲基化。其中肿瘤切除程度依照术后增强核磁分为3 组,切除范围大于或等于90%为全切及近全切组,≥10%且<90%为部分切除组,少于10%为活检组。采用电话随访的方式,了解患者病情进展状况,以术后患者疾病进展或复发记为事件发生时间点,以手术时间至此事件发生时间点记为无进展生存期(PFS),以患者手术时间至死亡时间记为总生存期(OS)。
1.3 统计学处理 采用SPSS26.0 统计软件进行数据分析,以P<0.05 为差异有统计学意义。采用Kaplan-Meier 法绘制生存曲线,利用log-rank 检验,单因素分析临床因素对幕下弥漫性胶质瘤PFS 和OS 的影响,将单因素分析中P<0.15 的相关因素纳入Cox 回归模型,分析多因素对PFS 及OS 的影响。
2 结果
2.1 幕下弥漫性胶质瘤的临床特征 ATRX 突变27 例(77.1%),无ATRX 突变8 例(22.9%);存在MGMT 甲基化14 例(40.0%),不存在MGMT 甲基化21 例(60.0%)。Ki-67 指数最低值3.8%,最高值65%,平均为27.6%。PFS 平均值为13.28 个月(95%CI:10.14 ~16.42),OS 平 均 为15.97 个 月(95%CI:12.43~19.52)。
2.2 幕下胶质瘤PFS 及OS 的相关因素 分析如表1,单因素分析结果表明肿瘤切除程度(P=0.000)、术后KPS 评分(P=0.000)是影响OS 的因素(图1)。肿瘤切除程度(P=0.000)、术后KPS 评分(P=0.025)、MGMT 甲基化状态(P=0.001)是影响PFS 的因素(图2)。
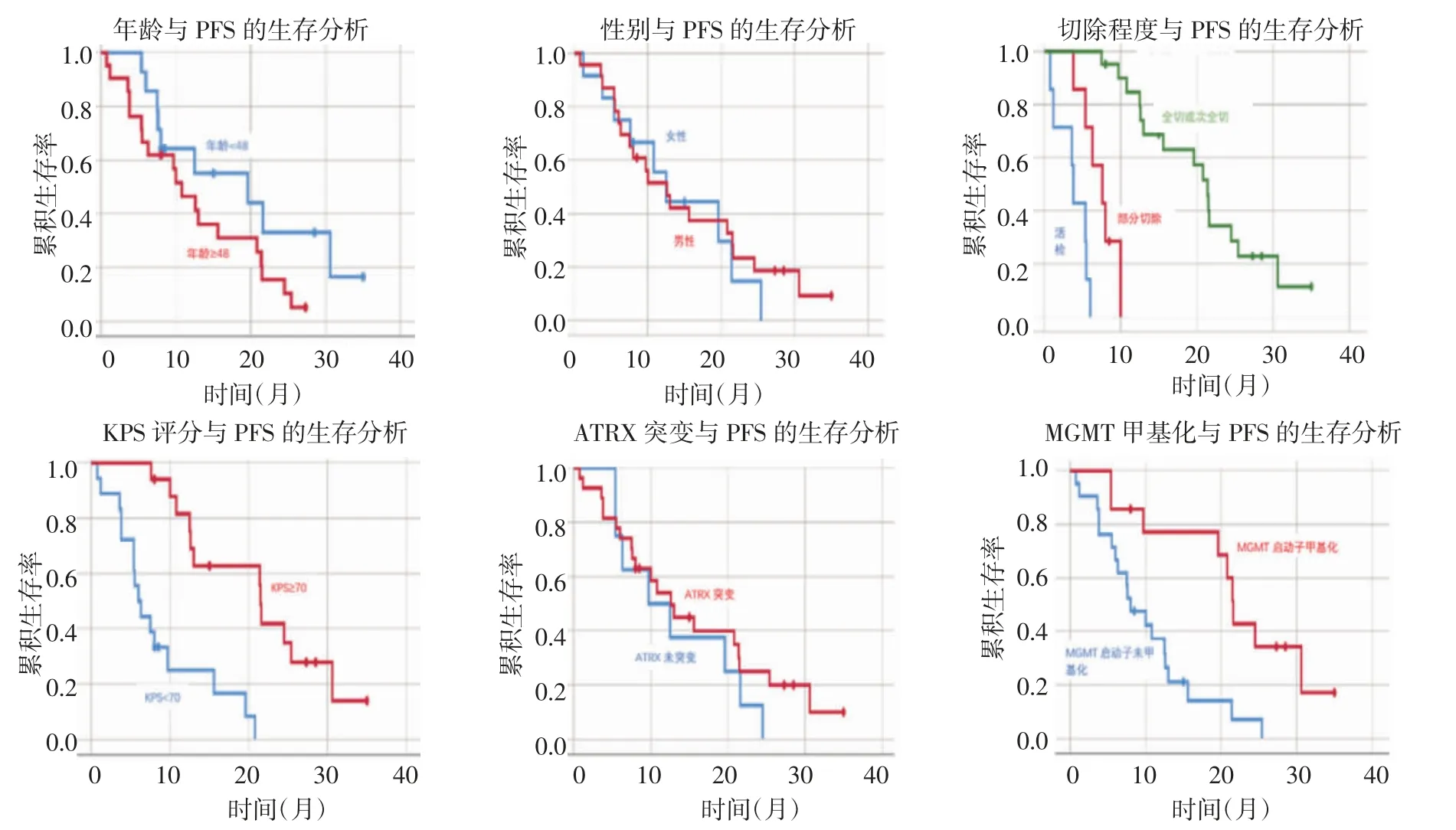
图2 单因素对PFS 的生存曲线图Fig 2 Survival curves of each single factor against PFS
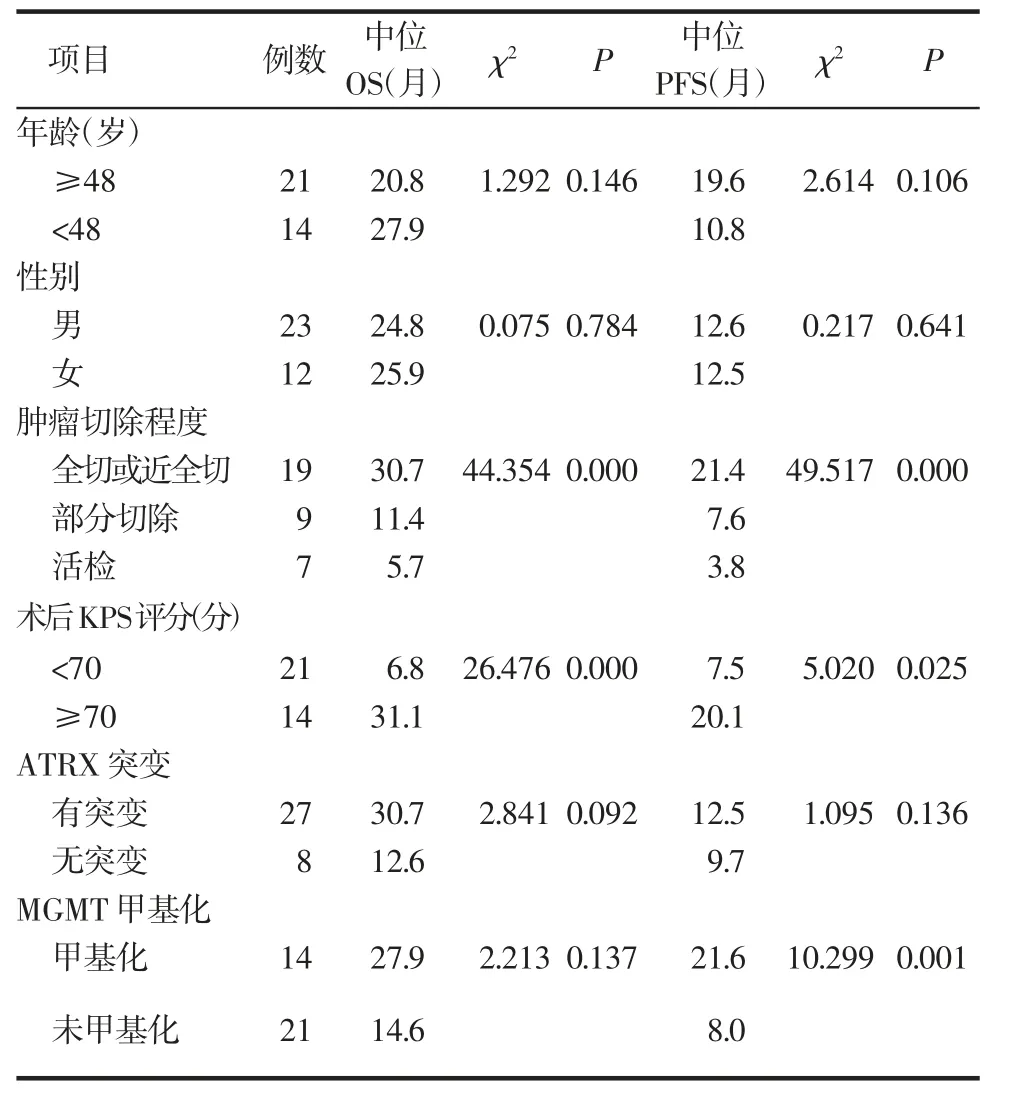
表1 单因素分析临床因素对OS 及PFS 的影响Tab 1 Univariate analysis was used to analyze the influence of different factors on OS and PFS
2.3 Cox 回归模型多因素分析 Cox 回归模型多因素分析结果显示,切除程度、术后KPS 评分、ATRX 突变、MGMT 甲基化是影响幕下胶质瘤患者PFS 独立因素(表2)。肿瘤切除程度、术后KPS 评分、ATRX 突变、年龄是影响幕下胶质瘤患者OS 独立因素(表3)。
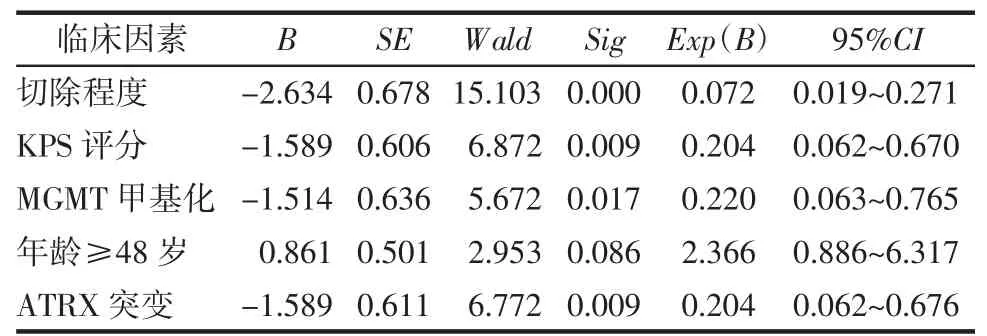
表2 影响幕下弥漫性胶质瘤PFS 的多因素Cox 回归分析Tab 2 Multivariate Cox regression analysis influencing PFS in subtentorial diffuse glioma

表3 影响幕下弥漫性胶质瘤OS 的多因素Cox 回归分析Tab 3 Multivariate Cox regression analysis influencing OS in subtentorial diffuse glioma
3 讨论
脑胶质瘤是常见颅内原发性恶性肿瘤,发病率和致死率均较高,严重影响患者生活质量甚至危及患者生命安全[2-3]。目前,胶质瘤治疗包括手术、放疗、化疗、靶向治疗等手段。具体治疗应综合考虑患者功能状态、预期疗效、肿瘤所在脑区、恶性程度等因素,并作出综合考虑和判断,从而制定个性化治疗方案。通常脑胶质瘤首选手术切除治疗[4]。手术不仅能提供病理诊断,还可以快速切除大部分肿瘤细胞,缓解患者症状,便于开展下一步治疗。目前主流观点是在尽可能保证安全情况下最大程度切除肿瘤。安全一般指术后KPS 评分≥70 分。本研究患者PFS 及OS 与KPS 评分相关,术后KPS 评分≥70 分利于延长PFS及OS。研究认为,年龄较小者对手术耐受情况较好,有利于术者对肿瘤最大范围切除,同时利于术后恢复,预示术后较好的功能状态,患者往往有更长的PFS 和OS[5-8]。针对胶质母细胞瘤的系统分析提示,PFS 与确诊年龄呈负相关[8],这与本研究结果相符。而在性别方面,一般认为男性胶质瘤的发病率偏高[7]。而关于性别对胶质瘤PFS 的影响,大多数研究认为两者并无相关性[9-10],但也有研究认为女性患者的PFS与男性相比偏长[11],这可能与雌激素受体β(ERβ)是肿瘤抑制因子有关[12-13]。本研究中性别对幕下胶质瘤患者的PFS 与OS 无显著影响。
ATRX 首次在针对X 连锁智力障碍综合征的研究中被发现[14],针对胶质瘤的研究显示,ATRX 与1p/19q 共缺失比较少见,其在WHOⅡ级和Ⅲ级星形细胞瘤及继发性胶质母细胞瘤中较常见,约占80%,而在WHOⅡ级和Ⅲ级少突胶质细胞瘤和原发性胶质母细胞瘤中罕见[15-16]。在第5 版神经系统肿瘤分类里,星形细胞瘤、IDH 突变型中ATRX 突变型往往同时合并P53 突变出现。ATRX 在H3.3-ATRX-DAXX 信号通路中有重要作用,可以和组蛋白伴侣蛋白DAXX(death-associated protein 6)结合形成复合物,从而促进H3.3 单体以掺入染色质的方式来维持染色体结构的稳定[17],本研究中ATRX 突变是幕下弥漫性胶质瘤PFS 及OS 延长的有利因素。
MGMT 是一个有DNA 修复功能的蛋白,能移除DNA 中鸟嘌呤的烷化从而阻止细胞凋亡,避免烷化剂引起的基因突变、细胞死亡和肿瘤形成。而替莫唑胺导致胸腺嘧啶和鸟嘌呤烷化对DNA 造成伤害,从而导致细胞凋亡。因此MGMT 对烷化剂有一定的抵抗能力,MGMT 甲基化的细胞中O6-鸟嘌呤-DNA 甲基化转移酶表达减少,从而使细胞对替莫唑胺更加敏感,使得烷化剂取得更好的治疗效果[18]。多项研究表明,在使用替莫唑胺化疗期间,肿瘤细胞的MGMT 表达会增加,从而使化疗的效果降低[19]。MGMT 甲基化是预后良好的因素,有研究提出通过MRI 的影像特点来预测肿瘤是否存在MGMT甲基化,其结果准确性接近组织学和分子检测方法[20]。MGMT 甲基化对胶质瘤的影响并未完全清楚,与其他生物学标志物之间的联系也有待进一步研究。有研究发现MGMT 甲基化的患者如果存在IDH1/2 突变则预后偏好[21]。还有研究发现MGMT 甲基化的患者术后并发癫痫的概率偏高[22]。本研究表明,MGMT甲基化是弥漫性胶质瘤预后良好的因素,其与其他生物学标志物之间的联系及对胶质瘤发病机制的影响有待进一步研究。本研究样本量较小,为单中心研究,后续笔者将进一步扩大样本量,寻找新的临床预后因素,力求实现患者生存和生活质量利益最大化。
综上所述,应在尽可能保证患者术后生存质量的前提下最大程度的切除胶质瘤,有利于患者生存期的延长;存在ATRX 突变可延缓患者术后复发及进展的时间;年轻的患者往往会有更长的生存期;不同性别的幕下弥漫性胶质瘤患者的预后差别不大。

