不同接种顺序条件下3株酵母属菌株生长及酿造特性研究
张 霞,雷学俊,王晓妹,赵 东,2,杨康卓,陈小文,郑 佳,2*
(1.宜宾五粮液股份有限公司,四川 宜宾 644000;2.中国轻工业浓香型白酒固态发酵重点实验室,四川 宜宾 644000)
白酒发酵是一个复杂的多种微生物协调作用的过程,参与作用的微生物主要有霉菌、酵母菌、细菌和放线菌四大类菌群[1]。酵母菌是十分重要的功能微生物,在白酒发酵过程中主要参与产生酒精、糖化淀粉、产生香味物质等重要环节,对白酒最终品质的形成起着关键作用[2-3]。根据酵母功能的不同,主要分为产酒酵母和产香酵母。产酒酵母主要将葡萄糖转化为乙醇,酵母属(Saccharomyces)就属于此类[4];产香酵母则与酯化酶产生协同作用,将有机酸、醛类、糖、盐等物质作为底物合成酯类,形成白酒的特征风味[5]。
有关酵母菌的混菌发酵主要集中在酵母菌和细菌、酿酒酵母(Saccharomyces cerevisiae)和产香酵母之间协同或拮抗作用研究,如酿酒酵母和速生梭菌(Clostridium celerecrescens)同时接种为己酸菌合成己酸提供底物—乙醇[6];酿酒酵母和乳酸菌同时接种能显著抑制乳酸菌的生长和乳酸合成[7]。DEVANTHI P V P等[8]分别在同时接种和顺序接种方式下利用嗜盐四联球菌(Tetragenococcus halophilus)和鲁氏接合酵母(Zygosaccharomyces rouxii)共发酵制备酱醪,通过固相微萃取(solidphasemicroextraction,SPME)结合气相色谱-质谱联用(gaschromatgraphy-massspectrometrometry,GC-MS)对其挥发性风味成分进行分析,结果表明,鲁氏酵母能够促进醇类物质的形成,并在与嗜盐四联球菌共同培养下产生更复杂的香气谱;吴健等[9]研究了不同接种方式和不同接种比例下酿酒酵母与产香酵母之间的相互作用规律,结果表明,酿酒酵母会抑制产香酵母的生长,不同接种方式及比例也会影响共培养之间的相互作用关系;范光森[10]研究发现,在不同接种方式和不同接种比例下,利用一株高产乙醇的酿酒酵母和一株高产乙酸乙酯的异常威克汉姆共培养发酵高粱酶解液培养基可大大提高乙酸乙酯的产量;白梦洋等[11]通过改变外界环境因素将酿酒酵母和毕赤酵母(Pichia pastoris)进行混合培养,结果表明,不改变外界环境条件下毕赤酵母对酿酒酵母产生明显的抑制作用,但随着发酵液中乙醇含量的增加,毕赤酵母受到抑制,酿酒酵母则处于相对优势地位;颜兵等[12]通过对酿酒酵母和异常汉逊酵母(Hansenula anomala)共培养的研究发现,异常汉逊酵母在混合培养中生长受到抑制,而酿酒酵母生长正常。已报道的研究主要集中在酵母属间的耐受性、发酵性能和生理代谢等对比性方面[13-14],还鲜见Saccharomyces不同种之间混菌发酵的报道。
酵母菌(Saccharomyces)是浓香型白酒酿造的重要种属,尤其是酿酒酵母,酿酒酵母发酵力强,主要进行发酵产乙醇[15-16]。有研究发现,多种酵母菌共同作用参与白酒的发酵,其中酿酒酵母是优势酵母[17]。浓香型白酒酿造原料由5种不同粮食混合而成,研究不同接种顺序下酵母菌(Saccharomyces)在五粮粉糖化液中混合培养的酿造特性,对将来研究同属酵母菌之间的酿造特性提供一种研究方式,为进一步认识酵母菌(Saccharomyces)在浓香型白酒发酵过程中的作用有重要意义。酿酒酵母(Saccharomycescerevisiae)、卡斯泰利芽殖酵母(Saccharomyces castellii)和单孢酵母(Saccharomyces unisporus)是浓香型白酒糟醅中丰度较高的3种酵母菌,也是浓香型白酒糟醅已分离到的可培养酵母菌[18]。因此,本研究以浓香型白酒糟醅中分离筛选得到的以上3株酵母菌属(Saccharomyces)不同种的酵母菌株,分别以纯培养为对照,固定接种比例,通过同时接种和顺序接种两种方式研究不同接种顺序下此3株酵母菌在五粮粉糖化液中混合培养时的酿造特性,为进一步了解此3株酵母菌在浓香型白酒发酵过程中的作用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)Y134、卡斯泰利芽殖酵母(Saccharomyces castellii)Y141、单孢酵母(Saccharomyces unisporus)Y140:均分离自浓香型白酒发酵糟醅。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[7]:蛋白胨20.0 g/L,酵母膏10.0 g/L,葡萄糖20.0 g/L,pH自然。121 ℃高压蒸汽灭菌15 min。YPD固体培养基:YPD液体培养基中添加琼脂20.0 g/L。
五粮粉糖化液[19]:粉碎后的五种粮食(高粱36%、大米22%、糯米18%、小麦16%和玉米8%)∶水=1∶10,浸泡,煮沸糊化40 min,加1.6%α-淀粉酶65 ℃液化3 h,再加1.6%糖化酶62 ℃糖化3 h,将过滤液糖度调至12~13°Bx。121 ℃高压蒸汽灭菌15 min。
1.1.3 试剂
葡萄糖(分析纯):国药集团化学试剂有限公司;氯化钠(分析纯):四川西陇化工有限公司;乙醇(纯度99.8%):美国Honeywell公司;4-辛醇(色谱纯):美国Sigma-Aldrich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
TG-WAX毛细管色谱柱(30.0 m×0.25 mm×0.25 μm):美国Thermo公司;固相微萃取手柄、50 μm CAR/DVB/PDMS纤维萃取头:美国Supelco公司;7890B-5977B气相色谱-质谱联用仪(GC-MS):美国Agilent公司;5810R离心机:德国Eppendorf公司;FE28 pH计:梅特勒托利多(中国)有限公司;BPC-250F生化培养箱:上海一恒科技仪器有限公司。
1.3 试验方法
1.3.1 酵母菌株活化
取一环酵母菌斜面培养物接种于YPD液体培养基,28 ℃活化培养16 h到对数生长期。
1.3.2 纯培养酵母菌的酿造特性
将活化好的菌液分别以105CFU/mL接入50 mL五粮粉糖化液中,纯培养体系包括酵母菌Y134、Y141和Y140,于28 ℃静置培养7 d,发酵0 h、12 h、24 h、36 h、48 h、72 h、120 h、168 h时取样。由于3株酵母菌在YPD平板上的菌落形态不同,采用稀释平板法测定发酵过程中3株酵母菌的活菌数[20],同时测定发酵液理化指标,并测定发酵12 h后发酵液中的特征挥发性风味成分。
1.3.3 混合培养酵母菌的酿造特性
同时接种混合培养:将活化好的菌液同时分别以105CFU/mL接种于50 mL五粮粉糖化液中,混合培养体系包括Y134&Y141、Y134&Y140、Y141&Y140和Y134&Y141&Y140,后续培养及样品处理同1.3.2。
顺序接种混合培养:将活化好的菌液以105CFU/mL接种于50 mL五粮粉糖化液中,接种顺序为0 h接入菌株Y140,12 h接入菌株Y141,24 h接入菌株Y134,混合培养体系也包括Y134&Y141、Y134&Y140、Y141&Y140和Y134&Y141&Y140,后续培养及样品处理同1.3.2。
1.3.4 理化指标的测定
pH:采用pH计测定;还原糖含量:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定[21];乙醇含量:使用顶空固相微萃取(HS-SPME)-气相色谱法测定[22]。
1.3.5 挥发性风味成分的测定
使用顶空固相微萃取(HS-SPME)萃取挥发性风味物质,并利用气相色谱-质谱联用(GC-MS)检测挥发性风味物质的含量,具体方法参照文献[23]。
1.3.6 数据处理
同一处理的样品做3组平行,结果以“平均值±标准差”表示;使用Origin2021软件处理发酵液活菌数和理化指标的变化;利用R语言中的Pheatmap程序包绘制热图,进行挥发性风味成分分析。
2 结果与分析
2.1 3株酵母菌纯培养发酵生长特征
由图1可知,3株酵母菌株纯培养时的生长趋势相似。其中,菌株Y134生长速度最快,最先达到稳定期(24 h),且活菌数最高(8.0×106CFU/mL);菌株Y141培养36 h时,活菌数达到最高(7.5×106CFU/mL),菌株Y140生长速度较慢,培养48 h时,活菌数达到最高(6.5×106CFU/mL)。
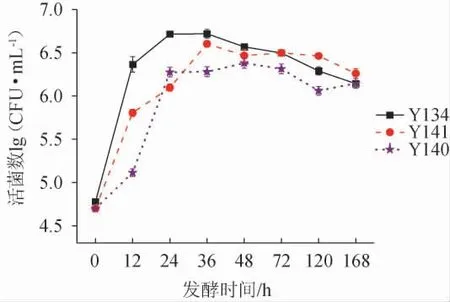
图1 3株酵母菌纯培养活菌数的变化情况Fig.1 Change of viable counts of 3 yeast strains during pure culture
2.2 不同接种顺序对3株酵母菌株生长特征的影响
不同接种顺序混合培养3株酵母菌活菌数的变化情况见图2。由图2可知,由于有限的营养物质和生存空间以及菌种之间的相互竞争,无论接种顺序如何,混合培养时各菌株的最大活菌数都低于纯培养的水平,与唐洁等[24]的研究结果类似。
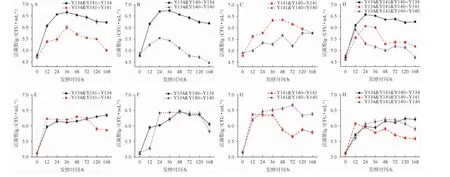
图2 不同接种顺序条件下混合培养3株酵母菌的活菌数变化情况Fig.2 Change of viable counts of 3 yeast strains during mixed culture with different inoculation sequence
同时接种时,混合培养条件下菌株Y134的活菌数和纯培养的活菌数相近,说明菌株Y134的生长几乎不受其他两株菌的影响,而菌株Y140和Y141则受菌株Y134的竞争影响较大。在Y134&Y141、Y134&Y140混合培养条件下,菌株Y141和Y140最大活菌数分别仅达到9.0×105CFU/mL和5.0×105CFU/mL,且两者活菌数在达到稳定期后迅速降低;在Y141&Y140混合培养条件下,两菌株互相影响,菌株Y141略占优势,但最大活菌数(4.0×106CFU/mL)比纯培养时降低了47%;在Y134&Y141&Y140混合培养条件下,菌株Y134对菌株Y141和Y140的抑制作用明显,菌株Y141和Y140分别在24 h和12 h达到最大活菌数后快速下降。说明同时接种条件下,3株菌混合培养时,Saccharomyces cerevisiaeY134竞争优势显著,严重抑制Saccharomyces castelliiY141和Saccharomyces unisporusY140的生长,而SaccharomycescastelliiY141对Saccharomyces unisporusY140又有一定的抑制作用。
顺序接种时,在Y134&Y141混合培养条件下,菌株Y134抑制菌株Y141生长的同时自身生长受到影响,最大活菌数明显降低。在Y134&Y140混合培养条件下,两株菌的最大活菌数均略低于纯培养,菌株Y134对菌株Y140的抑制作用明显减弱。48 h后随着菌株Y134活菌数的增加,菌株Y140活菌数极速下降,这可能是菌株Y134对菌株Y140的竞争优势和营养条件的限制所致。在Y141&Y140混合培养条件下,菌株Y141没有表现出如同时接种时对菌株Y140的竞争优势,反而其生长受到限制,不仅提前进入稳定期,而且最大活菌数也比纯培养时降低了30%。在Y134&Y141&Y140混合培养条件下,活菌数均未达到纯培养时最大活菌数,可能是一方面由于营养物质和生存空间的限制,另一方面由于3株菌互相竞争抑制。由此可见,顺序接种条件下,Saccharomyces cerevisiaeY134的竞争优势被削弱,而Saccharomyces castelliiY141对Saccharomyces unisporusY140的抑制作用消失。
2.3 不同接种顺序发酵五粮粉糖化液理化指标的变化
2.3.1 pH的变化
纯培养及不同接种顺序混合培养发酵五粮粉糖化液pH的变化见图3。

图3 同时接种(A)及顺序接种(B)发酵五粮粉糖化液pH的变化Fig.3 Change of pH of five grains powder saccharification liquid fermented by simultaneous inoculation (A) and sequential inoculation (B)
由图3可知,所有样品的pH变化趋势都一致,发酵前36 h下降迅速,同时接种混合培养发酵五粮粉糖化液的pH值从6.10降至5.32~5.65。顺序接种混合培养发酵五粮粉糖化液的pH值从6.10降至5.22~5.42,之后保持稳定或略微升高。酵母在发酵初期会产生乙酸等酸性物质,使得发酵液pH下降迅速,进入稳定期后,酵母发酵主要产乙醇以及积累代谢产物,随着发酵液中酒精度的升高,一些酸类物质被利用合成酯类,因此发酵中后期pH值稳定或略微升高[25-26]。这说明接种顺序对3株酵母菌混合培养发酵五粮粉糖化液pH的变化趋势无显著影响。
2.3.2 还原糖含量的变化
微生物的生长需要碳源,酵母菌可以利用还原糖作为碳源进行繁殖代谢[27]。纯培养及不同接种方式混合培养发酵五粮粉糖化液中还原糖含量的变化见图4。由图4可知,所有样品发酵前36 h还原糖含量下降迅速,之后趋于平稳。同时接种条件下,菌株Y134纯培养及其所有混合培养发酵液中还原糖含量下降较快,在24 h均已达到最低值(2.18~2.22 g/L),而菌株Y141和Y140的纯培养及其混合培养发酵液中还原糖含量则在发酵36 h达最低值(2.23~2.30 g/L);顺序接种条件下,只有菌株Y134纯培养发酵液中还原糖含量在24 h达到最低值(2.27 g/L),其他发酵液中还原糖含量均在36 h达到最低值(2.17~2.35 g/L)。说明顺序接种会延迟菌株Y134与其他菌株混合培养对还原糖的利用,而对Y140和Y141混合培养无影响。
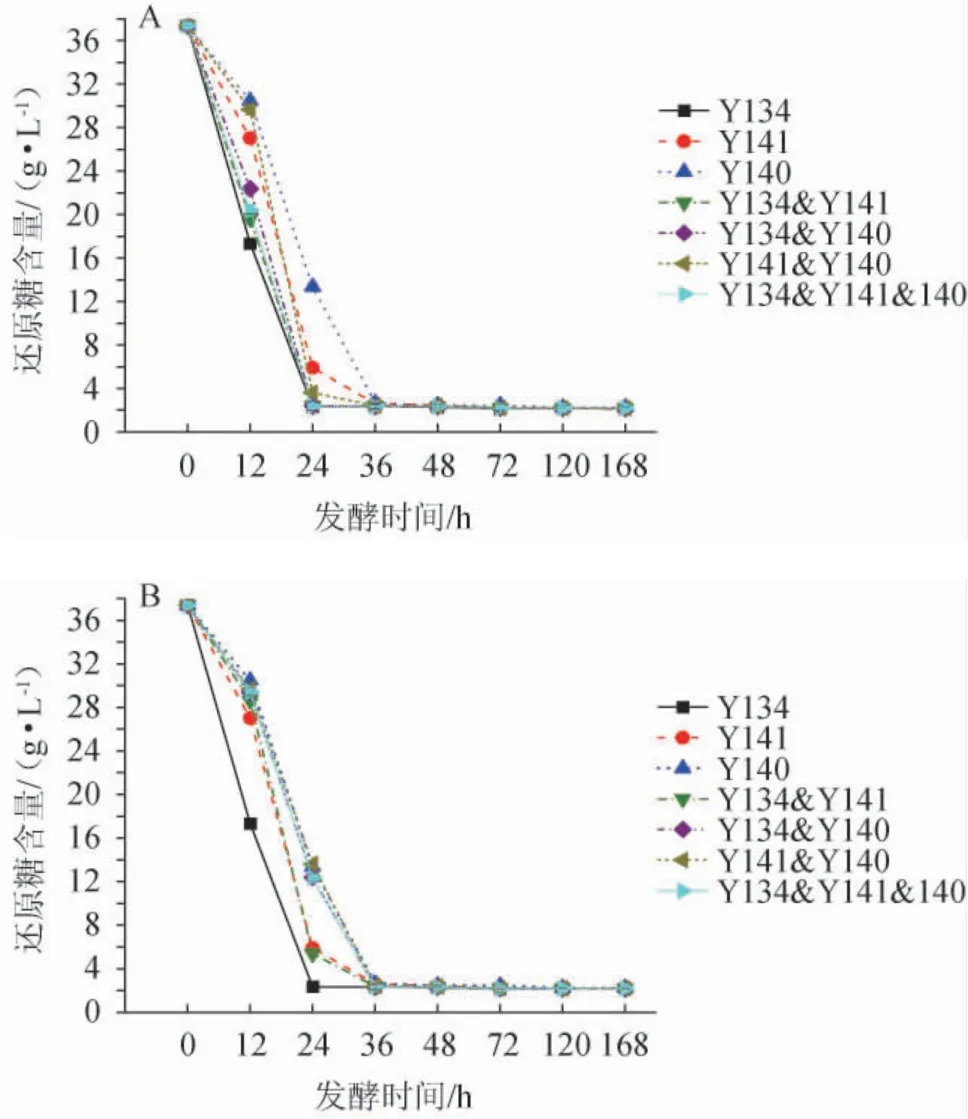
图4 同时接种(A)及顺序接种(B)发酵五粮粉糖化液中还原糖含量的变化Fig.4 Change of reducing sugar content of five grains powder saccharification liquid fermented by simultaneous inoculation(A) and sequential inoculation (B)
2.3.3 乙醇含量的变化
浓香型白酒发酵离不开酵母菌的作用,特别是发酵产乙醇的酿酒酵母[28],本研究中的3株酵母菌均能够发酵产乙醇[29-30]。纯培养及不同接种方式混合培养发酵五粮粉糖化液乙醇含量的变化见图5。由图5可知,同时接种时,除菌株Y141和Y140纯培养发酵液中乙醇含量在168 h达最大值,其他所有发酵液中的乙醇含量均在发酵24 h时达到最大值,之后趋于稳定,其中菌株Y134纯培养发酵液中乙醇含量最高,达5.6%。顺序接种条件下,Y134&Y141和Y134&Y140发酵液在发酵24 h时乙醇含量达最大值(分别为4.3%和4.4%),Y141&Y140和Y134&Y141&Y140发酵液在发酵48 h时乙醇含量达最大值(3.9%),这和发酵液中还原糖含量变化相反,这是因为酵母菌消耗还原糖代谢产生了乙醇[31]。顺序接种条件下混合培养发酵体系中乙醇含量最大值比同时接种条件下的乙醇含量最大值均有所降低,其中顺序接种时Y141&Y140发酵液中乙醇含量最大值下降最多,高达28%,说明顺序接种降低了混合培养发酵时3株酵母菌产乙醇能力。
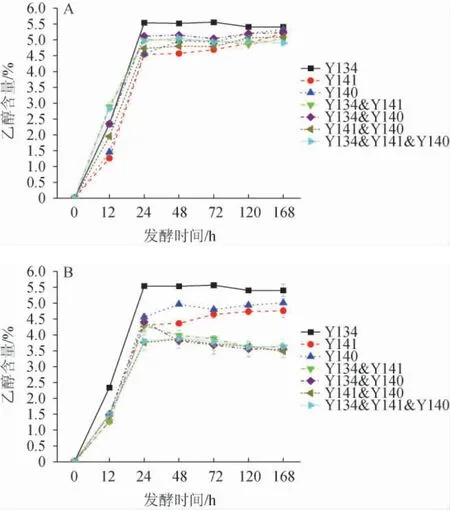
图5 同时接种(A)及顺序接种(B)发酵五粮粉糖化液中乙醇含量的变化Fig.5 Change of ethanol content of five grains powder saccharification liquid fermented by simultaneous inoculation (A) and sequential inoculation (B)
2.4 不同接种顺序对五粮粉糖化液挥发性特征风味成分的影响
乙酸乙酯、异丁醇和异戊醇均为酵母菌在酒精发酵时的副产物[32],对白酒影响比较大,与白酒骨架成分相关[33]。因此,关注酵母发酵液中乙酸乙酯和高级醇(异丁醇、异戊醇)含量的变化有助于酵母菌的代谢调控,使其朝着有利于增加白酒香味成分的方向代谢。纯培养及不同接种方式混合培养发酵五粮粉糖化液中特征挥发性风味成分见图6。
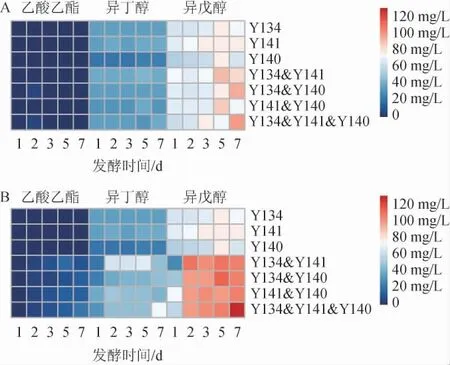
图6 同时接种(A)及顺序接种(B)发酵五粮粉糖化液中特征风味物质的变化Fig.6 Change of characteristic flavor substances content of five grains powder saccharification liquid fermented by simultaneous inoculation (A) and sequential inoculation (B)
由图6可知,无论接种顺序如何,纯培养和混合培养发酵液中挥发性特征风味物质含量均为乙酸乙酯<异丁醇<异戊醇。纯培养条件下,菌株Y141纯培养发酵液中乙酸乙酯含量在第5天达最大值,菌株Y134和Y140纯培养发酵液中乙酸乙酯含量在第2天达最大值。同时接种条件下,所有混合培养发酵液中乙酸乙酯含量均在第2天达最大值;顺序接种条件下,除Y134&Y141发酵液中乙酸乙酯含量在第5天达最大值,其余混合培养发酵液均在第7天达最大值,且Y134&Y141&Y140发酵液中乙酸乙酯含量最高,达到22 mg/L。顺序接种条件下混合培养发酵液中乙酸乙酯含量高于纯培养和同时接种,说明顺序接种延长了酵母菌产乙酸乙酯的时间,使得顺序接种混合培养时发酵液中乙酸乙酯含量增加。
关于异丁醇、异戊醇含量的变化,菌株Y134纯培养发酵液中异丁醇含量在第3天达最大值(37.67 mg/L),菌株Y141纯培养发酵液中异丁醇含量第2天达最大值(39.68 mg/L),菌株Y140纯培养发酵液中异丁醇含量在第5天达最大值(25.06 mg/L),3株酵母菌纯培养发酵液中异戊醇含量均在第5天达最大值,且菌株Y141纯培养发酵液中含量最高(79.14 mg/L)。除顺序接种的Y141&Y140发酵液在发酵第2天时异丁醇含量达最大值(49.60 mg/L)外,其余混合培养发酵液中异丁醇和异戊醇含量都是在第5天或第7天达最大值。所有顺序接种条件下混合培养发酵液中异丁醇、异戊醇含量均高于纯培养及同时接种条件下混合培养发酵液,说明在混合培养发酵中菌株之间互相促进产高级醇类。猜测原因是混合培养发酵时3株酵母互相影响,改变了乙醇发酵路径,使得混合培养时促进乙醇发酵时副产物高级醇的产生,这还有待于进一步研究其菌株间代谢途径。有研究表明,适量的高级醇有利于酒体的和谐,但含量稍高则会破坏酒体风格,影响白酒口感[34]。由此可见,同时接种有利于控制发酵液中高级醇含量,更适合浓香型白酒发酵,也符合浓香型白酒窖池中微生物的发酵方式。
3 结论
本研究以分离自浓香型白酒糟醅中的3株酵母菌(酿酒酵母Y134、卡斯泰利芽殖酵母Y141、单孢酵母Y140)为研究对象,研究接种顺序对3株菌在五粮粉糖化液中生长及酿造特性的影响。结果表明,接种顺序对此3株酵母菌混合培养发酵中菌株的生长特征影响较大,同时接种时菌株Y134占绝对优势,菌株Y141对菌株Y140有一定程度的抑制作用;顺序接种时菌株Y134的竞争优势明显减弱,菌株Y141和菌株Y140降低了菌株Y134的最大活菌数,菌株Y141失去对菌株Y140的抑制作用。接种顺序对3株酵母菌混合培养发酵五粮粉糖化液的pH无明显影响,而顺序接种会延迟Y134混合培养时菌株对还原糖的利用,降低菌株产乙醇能力,提高乙酸乙酯、异丁醇和异戊醇含量,说明同时接种有利于控制发酵液中乙酸乙酯和高级醇含量,更适合浓香型白酒发酵,也符合浓香型白酒窖池中微生物的发酵方式。接种顺序影响了3株酵母菌混合培养发酵下的酿造特性,这对将来研究酵母菌在白酒发酵过程中的作用奠定基础,而同时接种更利于此3株酵母菌酿造特性的体现,这对研究酵母菌混合培养以及此3株酵母在白酒发酵过程中的作用提供一定的指导意义。

