壳寡糖对2型糖尿病小鼠免疫功能及炎症因子释放的调节作用
李程呈 马春宇
(1锦州医科大学附属第一医院检验科,辽宁 锦州 121000;2锦州市妇婴医院检验科)
2型糖尿病是由于胰岛素抵抗导致糖代谢紊乱,引起的内分泌代谢障碍疾病,具有遗传倾向,患者血糖及尿糖长期异常增高,常伴有心脑血管、肾脏、神经、易发感染等多种严重并发症〔1,2〕。壳寡糖(COS)为壳聚糖降解产物,研究报道其可改善机体免疫力、抗肿瘤〔3〕、抗氧化〔4〕、调节炎症反应及调节血脂等〔5〕。依据改良姜骊等〔6〕前期研究,本实验成功建立2型糖尿病小鼠模型,并首次探讨不同剂量COS对2型糖尿病小鼠脾脏指数、胸腺指数及小鼠免疫功能及炎症因子释放的调控作用。
1 材料与方法
1.1实验动物 SPF级昆明小鼠60只,体质量18~25 g,鼠龄2~3个月,雌雄皆有,由云南省天然药物研究中心动物室提供。动物生产许可证号:SCXK(云)2018-0002。
1.2药物与试剂 COS购于济南海得贝生物公司;链脲佐菌素(STZ)购于美国Sigma公司;血糖试剂盒购于上海酶联生物科技有限公司;CD4/CD8/CD3检测试剂盒(流式细胞仪法-FITC/PE/PerCP)购自安捷伦生物(杭州)有限公司;流式细胞仪购于美国BD生物科技公司;肿瘤坏死因子(TNF)-α、C反应蛋白(CRP)、白细胞介素(IL)-6、IL-1β、单核细胞趋化蛋白(MCP)-1酶联免疫试剂盒购于上海酶联生物科技有限公司;酶标仪购于美国伯腾仪器有限公司。
1.3模型构建 健康昆明小鼠于实验室稳定饲养1 w,再于实验室高脂饮食4 w后,禁食16 h,将STZ溶于柠檬酸缓冲液中,以100 mg/kg的剂量给各剂量组小鼠腹腔注射0.1 mol/L柠檬酸缓冲液,对照组注射等量柠檬酸缓冲液。为了保证STZ引起的低血糖不导致小鼠死亡,小鼠腹腔注射STZ后6 h灌胃给予50%葡萄糖溶液,1 d内小鼠自由饮用5%葡萄糖溶液及正常摄食。1 d后给予无菌处理过的自来水,3 d后采用尾静脉采血技术,使用血糖试剂盒检测并记录小鼠血糖值。糖尿病小鼠建模成功的标准是其空腹血糖≥11.1 mmol/L,对于建模成功的小鼠给予基础饲料喂养,保证充足水和食物,并每天更换笼盒和垫料。
1.4建模成功标准 模型组及高、中、低剂量给药组小鼠表现出典型的“三多一少”:尿量增多、饮水增多、摄食增多及体质量下降,血糖升高。且小鼠反应变得迟钝、精神状态不佳、毛发竖立且失去光泽度、弓背捲体、动物变得缓慢等糖尿病症状。建模成功的糖尿病小鼠再随机分为模型组和各剂量壳聚糖组。
1.5分组和给药方法 选取60只SPF级昆明小鼠,随机取12只作为对照组,48只小鼠用高脂饮食结合小剂量腹腔注射STZ的方法成功建立2型糖尿病小鼠模型,随机分为模型组、低剂量组、中剂量组及高剂量组,每组12只。对照组和模型组每天用0.9%生理盐水灌胃处理,低、中、高剂量COS组分别每天用100、200、400 mg/kg COS灌胃给药,连续30 d,最后1次给药2 h后处死小鼠。给药剂量根据COS的人体(体质量60 kg)推荐最大摄入量0.5 g/d的10、20、40倍设置小鼠的低、中、高剂量组。给药期间给予实验小鼠无菌的自来水、基础饲料,每日更换小鼠笼内的垫料。
1.6观察指标 (1)体质量和血糖:最后1次灌胃给药前禁食12 h,最后1次给药后2 h处死小鼠前称量体质量,并测量通过尾静脉采血的方式,测量血糖水平。(2)脾脏和胸腺指数:称量解剖取出的脾脏和胸。记录脾脏/胸腺的质量(mg)/体质量(g)值,此值即对应的小鼠脾脏或胸腺指数。(3)免疫指标:于小鼠处死前使用毛细采血管进行眼球后静脉丛取血,使用肝素防止血液的快速凝结,再利用流式细胞仪测定小鼠眼眶血中CD4+、CD8+表达水平,并计算CD4+/CD8+比值。(4)炎症因子:取血方式如上所述,离心收集上清液,使用酶联免疫试剂盒测定炎症因子TNF-α、CRP、IL-6、 IL-1β、MCP-1的表达水平。
1.7统计学方法 采用SPSS24.0软件进行单因素方差分析。
2 结 果
2.15组体质量和血糖比较 与对照组相比,模型组体质量显著下降(P<0.05),血糖水平显著升高(P<0.05),各剂量组体质量有所升高,血糖水平下降,且与模型组相比,中、高剂量组体质量明显增加,血糖水平显著降低(P<0.05)。见表1。
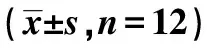
表1 5组体质量、血糖水平脾脏指数、胸腺指数、免疫功能指标比较
2.25组脾脏指数和胸腺指数比较 相较于对照组,模型组,低、中剂量组胸腺和脾脏指数显著降低(P<0.05),高剂量组低于对照组,但差异无统计学意义(P>0.05);低、中、高剂量组显著高于模型组(P<0.05)。见表1。
2.35组免疫功能指标比较 模型组,高、中、低剂量组CD4+表达水平显著低于对照组(P<0.05);各剂量组显著高于模型组,且中、高剂量组明显高于低剂量组(P<0.05);5组CD8+表达水平差异无统计学意义(P>0.05)。见表1。
2.45组炎症相关因子比较 模型组炎症因子TNF-α、CRP、IL-6、IL-1β及MCP-1表达量显著高于对照组(P<0.05);高、中、低剂量组显著低于模型组(P<0.05);且高剂量组明显低于对照组(P<0.05)。见表2。
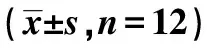
表2 5组炎症因子比较
3 讨 论
糖尿病是一种长期慢性疾病,可引发多种并发症,发病率和致死率逐年升高〔7〕。据统计我国糖尿病人群中2型糖尿病占90%以上〔8〕,糖尿病早期患者免疫功能显著下降〔9〕,而目前患者对环孢霉素、硫唑嘌呤等免疫抑制剂治疗有严重的不良反应〔10,11〕。因此国内外迫切寻求新的天然药物作为降糖药。COS是壳聚糖的降解产物,其分子量小,可溶于水,具有比壳聚糖更强的生物活性,且有较好的生物相容性及生物可降解性〔12〕。COS因其对机体免疫的调节作用、对抗肿瘤作用、调节炎症反应〔13〕、改善血糖血脂〔14〕、促进组织再生、降低胆固醇等生物活性已受到国内外的大量关注。
胸腺是机体最大淋巴器官,其不仅是T淋巴细胞分化及发育成熟的场所,也是对血源性抗原发生免疫效应的场所〔15〕。脾脏参与机体造血、贮血和过滤等作用,也是T细胞产生免疫应答的重要场所,参与机体免疫反应,脾脏受损增加2型糖尿病发病风险〔16〕。因此对胸腺/脾脏指数的检测可以间接判断机体的免疫功能状态。本研究发现,糖尿病小鼠胸腺和脾脏萎缩,免疫功能抑制,且各剂量COS组对糖尿病小鼠的免疫抑制有所改善。T淋巴细胞亚群也是评价机体免疫功能状态的重要指标,CD4+/CD8+比值越低,提示机体的免疫功能下降。糖尿病患者CD4+与CD8+表达失衡,易诱发感染。本研究结果证实,糖尿病小鼠免疫力下降,COS能够剂量依赖性明显改善糖尿病小鼠免疫功能抑制现象。
研究显示,炎症反应在糖尿病病变及发生发展中起重要作用,炎症因子的高表达导致病程的加重及更高的并发症发生率〔17〕。IL-1β是IL-1在体液中的主要存在形式,与TNF-α均为血管炎症的标志性炎症相关因子,研究发现糖尿病患者体内TNF-α、IL-1β及IL-6表达水平显著高于正常组〔18,19〕。CRP是机体受到外界刺激时在肝脏大量合成的急性蛋白质〔20〕,TNF-α、IL-1β及IL-6的产生将会刺激CRP的急性合成,导致机体炎症反应失衡,将形成和促进胰岛素抵抗〔21〕。MCP-1是近年来广受学者关注的趋化细胞因子,当机体炎症相关因子表达升高,将刺激单核-巨噬细胞大量分泌MCP-1,导致炎症反应的产生或加重〔22,23〕。因此,抑制该分子的表达有助于对糖尿病的治疗。本文结果显示,通过COS的干预,糖尿病小鼠炎性相关指标TNF-α、CRP、IL-6、IL-1β、MCP-1的表达量显著降低,且COS剂量越大,降低愈明显。
本实验通过成功构建的2型糖尿病小鼠模型进一步证明COS可剂量依赖性提高糖尿病小鼠的免疫功能、抑制炎症反应,进而可能增强小鼠抗炎抗感染能力。提示COS具有可观的2型糖尿病临床应用前景,但其构效关系及具体抗炎机制还需要更进一步研究确定。

