有氧运动对糖尿病大鼠血管内皮功能的影响及网膜素的作用
田清华 孙培帅 刘霞 金其贯 胡润东
(1湖南师范大学体育学院,湖南 长沙 410012;2扬州大学体育学院;3聊城幼儿师范学校)
糖尿病是由于胰岛素分泌缺陷或作用障碍所致的,以高血糖为特征的代谢性疾病,可由多种细胞和分子途径异常引发。机体长期处于高血糖环境,可引发多种组织,特别是眼、肾、心脏、血管、神经的慢性损害及功能障碍〔1〕。Brownlee〔2〕认为机体长时间处于高糖的刺激下,会产生相应的氧化应激,进而引起组织损伤。血管内皮结构是维持血管内环境稳定的重要屏障,其结构缺陷和功能障碍是各种心血管疾病产生的病理基础。糖尿病血管内皮功能障碍主要由氧化应激与炎症引起,引起途径主要是一氧化氮(NO)生产障碍和NO激活障碍〔3〕。刘菊等〔4〕研究表明,机体的血同型半胱氨酸(Hcy)产生过多时,会降低机体的抗氧化能力,影响血管内皮细胞正常代谢,进而破坏内皮细胞的功能发挥,加速了微血管病变的进程。
网膜素(omentin)是近年发现的新型特异性脂肪因子,实验表明omentin-1在维持能量代谢平衡,提高胰岛素致敏性,抑制机体炎症反应和降低心血管发病概率等扮演关键角色。omentin通过不同调节机制参与调节炎症反应、氧化应激反应和增加NO的生成。就内皮功能而言,网膜蛋白可通过激活一氧化氮合酶(eNOS)加强血管舒张功能,并且可以经omentin-1/三磷酸腺苷结合盒转运体(ABC)A1途径,降低主动脉粥样硬化的发展〔5〕。omentin水平与内皮功能之间有很大的关系,特别是高危糖尿病患者,omentin对内皮功能障碍具有显著性保护作用〔6〕。Wang等〔7〕指出,omentin可以促进eNOS的表达,刺激蛋白激酶B(Akt)-eNOS信号通路,机体NO的生成增加,从而促进缺血反应中的内皮细胞功能和血运重建能力。Liu等〔8〕指出,omentin-1通过抑制氧化应激并通过激活腺苷酸活化蛋白激酶/过氧化物酶体增殖物激活受体(AMPK/PPAR)γ途径增加NO的产生来预防高糖诱导的血管内皮功能障碍。
研究表明,12 w有氧运动可以明显降低体重和胰岛素抵抗,同时omentin表达水平显著提高〔9〕。有氧运动是否通过增加omentin来改善糖尿病血管内皮功能,其机制又如何。本研究将探讨糖尿病大鼠血管内皮功能、有氧运动及omentin之间的关系及在运动干预下omentin/AMPK/eNOS通路对糖尿病血管内皮的作用。
1 材料与方法
1.1动物分组与建模 将40只6周龄SPF级雄性SD大鼠,每笼5只分笼饲养。光照为自然光,环境温度湿度适宜,并每天早上更换垫料。保持动物房通风、干净。在进行实验前适应喂食3 d,喂养结束后将大鼠随机分为2组,分别为对照组(NC组,n=10)和糖尿病建模组(DM组,n=30)。 对照组用普通饲料进行喂养,糖尿病建模组用高脂质饲料进行喂养(配合:基础饲料占比72.5%,猪油占比12%,蔗糖占比9%,大豆粉末占比3%,胆固醇占比2%,胆汁盐占比1.5%)。进行4 w饲养后,糖尿病建模组的大鼠进行12 h的禁食,并且在腹部注射链尿佐菌素(STZ)溶液40 mg/kg。1 w后测定糖尿病组大鼠尾静脉中的血糖浓度,血糖浓度>11.1 mol/L,而且明显出现三多一少的症状,说明成功建立了糖尿病组的模型。一共有27只大鼠建模成功,将建模成功后27只大鼠分为糖尿病对照组(DMC组,n=9)和糖尿病运动组(DME组,n=18),DME组实施设计好的运动方案进行运动干预。
1.2运动方案 糖尿病运动组运动持续时间为8 w,训练内容为无负重游泳训练,每周进行6 d的训练,训练时间为1 h/次,在方案执行过程中应注意:(1)观察大鼠运动中状态,防止大鼠溺亡。(2)保持泳池卫生和最佳温度,为大鼠运动提供适宜环境。每周大鼠休息日测体质量、快速血糖仪测血糖以备统计。
1.3动物取材及处理 大鼠最后一次运动后,禁食不禁水。第二天(12 h后)将大鼠进行麻醉注射,注射完成后对大鼠的静脉进行取血。取血完成后,将取得的血液放入血清促凝管中进行静置保存,保存时间为30 min,30 min后将血液进行离心操作,随后吸取血清并将其保存在-20 ℃冰箱,用来准备测量血液中的各项指标〔空腹血糖(FBG)、omentin、NO、血清胰岛素(INS)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)〕。取2 cm干净胸主动脉血管组织放入2.8%的戊二醛溶液中固定,以备后期电镜扫描。另取胸主动脉血管组织长度为2 cm,并将其固定放入10%的甲醛溶液中,目的是准备苏木素-伊红(HE)染色。将余下的主动脉组织保存在温度为-80 ℃的冰箱内,目的是准备用来测蛋白、mRNA和含量。胰岛素抵抗指数(HOMA-IR)=INS×FBG/22.5。
1.4血管组织HE染色 采集固定的胸主动脉血管组织并脱水,用包埋机包埋蜡浸过的组织,制造蜡并冷却。冷却结束后修正冷却后的蜡块,随后将蜡块进行切片、捞片,最后用烘干箱将其烘干,用来准备进行HE染色。经过洗脱、透明、封片后镜下观察其显微结构并摄影,观察其血管内皮组织结构的变化。
1.5血管组织扫描电镜观察 取完大鼠血液,用棉球将腹腔遗留血液擦拭干净后,取米粒大小胸主动脉血管组织,马上将其放入提前准备好的2.8%戊二醛中,环境温度为4 ℃,固定时间为2 h以上。在此之前2.8%戊二醛固定2 h以上,4 ℃冰箱,用0.1 mmol/L磷酸盐缓冲液(PBS)来清洗,一共将其清洗3~4次,每次的清洗时间为15 min,随后1%的鹅酸固定2 h,用0.1 mmol/L PBS来清洗,共将其清洗3~4次,每次的清洗时间为15 min,随后放入乙醇中进行梯度脱水,其中乙酸乙戊酯与乙醇比例为1∶1,梯度脱水时间为0.5 h,随后将其放入纯乙酸乙戊酯中时间为0.5 h,接下来进行CO2临界点干燥、黏样、镀膜等步骤,完成后将其放在镜下进行观察。
1.6大鼠血清指标测试 血清中FBG含量用葡萄糖氧化酶法测定,血清中NO含量用硝酸还原酶法测定,血清中HDL、LDL、TC、TG含量用分光光度法测定。
1.7大鼠胸主动脉omentin、AMPK、 eNOS 、肿瘤坏死因子(TNF)-α含量的测定 采用二喹啉甲酸(BCA)方法测定大鼠胸主动脉总蛋白浓度。采用酶联免疫吸附试验(ELISA)测试血清胰岛素、胸主动脉组织中omentin、ΑMPK和eNOs含量。实验过程:准备预包被微板,依次加入大鼠蛋白,标准品进行孵育,随后加入抗体生物素,辣根过氧化物酶(HRP)标记的检测抗体在孵育完全后加入,随后进行彻底的洗涤。最后发现洗涤后的样板底物在过氧化酶和酸的作用下显现出黄色,放入酶标仪中,以波长450 nm进行OD值测定并计算样品浓度。
1.8大鼠主动脉组织中c-Jun氨基末端激酶(JNK)mRNA、环氧化酶(Cox)-2 mRNΑ的测定 逆转录聚合酶链反应(RT-PCR)法测主动脉组织JNK mRNA、Cox-2 mRNΑ,从大鼠主动脉中提取总RNA,吸光度值用分光光度计测定,测定完成后计算相对浓度,判断所提取RNA纯度。PCR仪(美国)中,cDNA的合成过程严格按照cDNA合成试剂盒说明书进行合成,合成后的cDNA的保存条件为-20 ℃。以cDNA为模板,以GAPDH为内参,在PCR仪中反应。反应结束后,计算得到目的基因Ct值的相对转录水平。
在上海生物工程有限公司选购JNK、Cox-2 的引物,引物序列:JNK上游引物:TCCCAGTCTTCGATGCTCTT 50%GC〔指引物的碱基充列中含有鸟嘌呤(G)和胞嘧啶(C)碱基的百分比〕,引物的溶解温度(M)59.27 ℃、下游:TTACAAGCCAGGTGTGAACG 50%GC,M 60.13 ℃,COX-2上游引物:CTGGAAACCTAGCACCTTCG 50%GC,M 60.65 ℃、下游:TGAAAGAGGCAAAGGGACAC 50%GC,M 60.00 ℃,GAPDH上游引物:ACAGCAACAGGGTGGTGGAC 60%GC,M 60.62 ℃、下游:TTTGAGGGTGCAGCGAACTT 50%GC,M 60.47 ℃。
1.9统计学处理 采用SPSS20.0软件进行t检验。
2 结 果
2.13组血清FBG、INS及HOMA-IR 与NC组比较,DMC组血清FBG和HOMA-IR水平显著增加(P<0.05),血清INS水平无明显变化(P>0.05);与DMC组比较,DME组血清FBG水平显著下降(P<0.05),见表1。

表1 各组血清FBG、INS、HOMA-IR、TG、TC、HDL、LDL含量比较
2.2各组血清中血脂的变化 与NC组比较,DMC组血清TG,TC均显著升高(P<0.05);与DMC组比较,DME组血清TG水平显著降低(P<0.05),见表1。
2.3各组血清NO、主动脉eNOS含量的变化 与NC组比较,DMC组NO、eNOs水平均显著下降(P<0.05,P<0.01);与DMC组比较,DME组NO、eNOS含量均显著增加(P<0.05),见表2。

表2 各组血清NO、主动脉组织eNOS含量的变化
2.43组主动脉HE染色、扫描电镜下观察结果 通过HE染色观察血管内皮发现,NC组血管内皮细胞光滑,组织排列紧密,细胞核排列整齐分布均匀。DMC组血管内皮的组织出现疏松现象,并且出现了不同程度的隆起。DME组与DMC组相比其血管内皮的隆起部分有所减小,血管内皮组织排列较紧密,细胞核的分布形态呈线状。 通过扫描电镜下观察发现,NC组血管内皮表面光滑平整、结构清晰,可观测到少量微绒毛;细胞饱满,充满光泽,呈条带状有序分布;细胞间形态和大小基本一致,且界限明晰,连接紧密。DMC组内皮形态显著异常,在内皮表面出现褶皱,并且其结构杂乱,内皮表面绒毛也已消失;内皮细胞萎靡,没有光泽,紊乱排列且间隙增大;表面可观测到明显的细胞膜缺损及附着在表皮上脱落的细胞碎片和纤维。DME组内皮表面形态出现异常但不明显,膜表面结构及排序混乱无序,褶皱部分不明显,有些许的细胞碎片附着在细胞表面,隐约可见表面微绒毛。见图1。
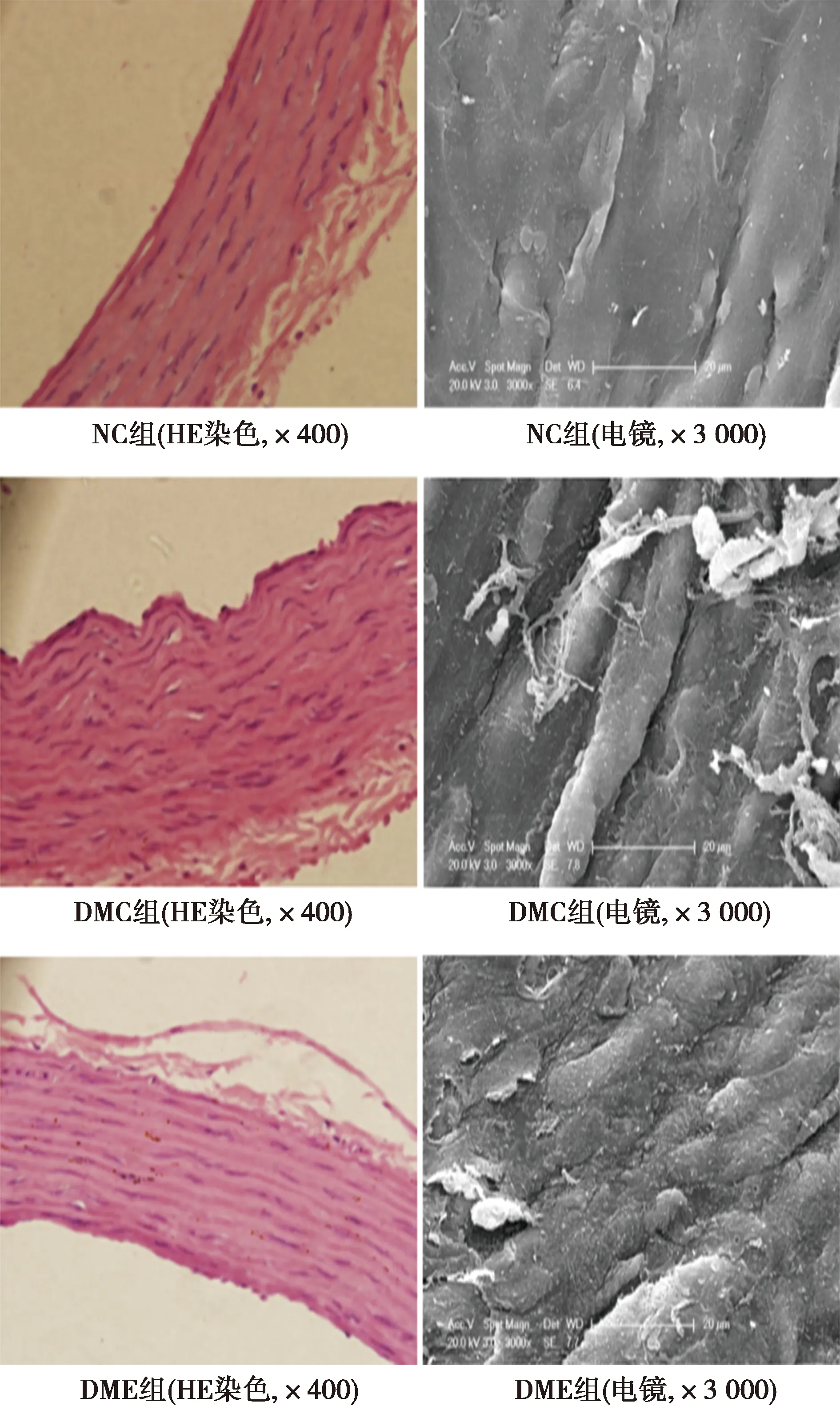
图1 各组主动脉血管形态
与NC组比较:1)P<0.05,2)P<0.01;与DMC组比较:3)P<0.05,4)P<0.01
2.5各组血清和主动脉血管网膜素及AMPK含量 与NC组比较,DMC组血清omentin水平、血管omentin表达水平、主动脉血管AMPK含量均显著下降(P<0.05,P<0.01);与DMC组比较,DME组血清和组织omentin水平及AMPK含量均显著升高(P<0.05),见表2。
2.6各组主动脉组织TNF-α含量、JNK、Cox-2 mRNΑ表达 与NC组比较,DMC组TNF-α含量、JNK、Cox-2 mRNΑ表达量均显著升高(均P<0.01);与DMC组比较,DME组TNF-α含量、JNK、Cox-2 mRNΑ表达量显著降低(P<0.05,P<0.01),见表2。
3 讨 论
血管内皮在受到生物体的血糖、血脂代谢异常产物和炎症因子等有害物质的刺激,其稳态会受到破坏,进而导致血管内皮功能障碍〔10〕。血管内皮细胞功能障碍是产生糖尿病及其并发症的病理基础〔11〕。临床和基础研究表明,糖尿病合并并发症的产生是由于糖尿病患者机体糖脂代谢异常导致氧化应激和炎症反应,进而引起血管内皮细胞分泌内皮依赖性调节蛋白失衡从而造成大血管、微血管病变〔12〕。Babbitt等〔13〕发现,运动能有效改善T2DM血管内皮功能障碍、提高机体胰岛素敏感性、降低糖尿病心血管并发症发生概率。本实验研究表明,8 w有氧运动后,DME组主动脉血管内皮轻微隆起,表皮附着些许碎片,组织厚度减小;细胞核排列紧凑,细胞之间间隙变小,较DMC组均有所改善。
糖尿病产生内皮功能障碍的主要因素之一就是血管舒张因子NO的生物-合成减少〔14~16〕。eNOS通过介导NO的合成,进而参与血管内皮形态和功能的调节。正常生理状态下,机体内NO主要受内皮细胞中eNOS及其上游因子调节〔17〕。在病理状态下,由于氧化应激等各种原因会解耦eNOs合成NO路径且直接灭活NO,而运动可通过蛋白磷酸化机制提高机体eNOs的表达,从而平衡NO的产生与利用〔18〕。研究发现,在高血糖,高血脂等影响下,2型糖尿病患者的eNOS磷酸化水平降低,内源性NO释放受到抑制,造成血管舒缩两端失衡,内皮通透性改变,进而引起血管内皮功能紊乱〔19~21〕。张鹏程等〔22〕通过研究发现:在进行有氧运动联合抗阻运动干预8 w后,显著增加eNOS表达量,促进NO、VEGF的分泌。本实验结果提示,长期的有规律的有氧运动可增加eNOS和NO的含量,从而保护血管内皮功能。
omentin是一个在内脏脂肪组织中选择性高表达的新型脂肪源性脂肪因子,omentin可以分为omentin-1和omentin-2,通过研究发现,omentin-1在血液循环中的表达远远大于omentin-2〔23〕。omentin具有抑制炎症反应、抑制胰岛素的敏感性等作用。omentin不仅通过调节血管功能和降低环氧合酶-2的表达来抑制血管炎症,还参与了糖脂代谢的能量转换过程〔24〕。有研究发现,omentin可以有效反映血管内皮功能是否发生障碍,可以作为测试内皮功能的生物指标〔25〕。张霞〔26〕研究发现,糖尿病患者体内血浆omentin水平显著降低与本研究结果一致。
omentin-1的内皮保护作用通过调节NO实现的,omentin可增加皮瓣成活面积百分比、表皮厚度、新生血管数量、eNOS活性〔27〕。有研究发现大鼠血管omentin重组后,omentin/eNOS/NO通路可以改善大鼠血管舒张功能障碍〔28〕。Xu等〔29〕和Kazama等〔30〕发现,在体内外,omentin-1可诱导AMPK和Akt的活化,一方面通过AMPK/Akt信号通路抗动脉钙化,另一方面omentin可通过AMPK/NO信号通路,使血管舒张弹性得以增加,血管舒缩平衡得以改善。TNF-α水平在糖尿病小鼠的心脏的血管系统的内皮增加,已被鉴定为沉淀血管功能障碍的关键介导物。omentin可以通过AMPK/eNOS/NO途径从而减轻炎症反应,糖尿病血管内皮功能障碍的发生发展进程从而得到延缓〔31〕。Yamawaki等〔32〕认为,omentin可以激活蛋白激酶/eNOS信号通路从而来抑制JNK、TNF-α等炎性因子的产生。本实验也表明,omentin水平和AMPK、eNOS水平呈正相关,因此能够促进NO的产生,改善内皮功能障碍。另外,NO与JNK、TNF-α含量呈显著负相关。通过实验研究发现,DMC组大鼠血管中omentin的表达水平明显低于NC组大鼠和DME组大鼠,AMPK和eNOS水平随着糖尿病血管内皮病变的程度相应减少。推测,在糖尿病血内皮功能的变化过程中,omentin与AMPK/eNOS/NO通路有很大的关系,并与阻止JNK通路、抑制TNF-α诱导的炎症有关。
耐力训练或饮食干预后,网膜蛋白和心脏代谢特性得到了改善〔25〕。因此,可以认为网膜蛋白由于体重减轻或肥胖相关因素的改善而增加。Madsen等〔33〕证明,每周进行8次剧烈运动和中度运动可促进卵巢切除大鼠的血清网膜蛋白增加。周琳等〔34〕实验研究发现,有氧联合抗阻训练能够改善糖尿病病症,与此同时,血清omentin的水平呈显著性升高,提示有氧运动改善糖尿病病症可能与血清omentin水平升高有关。动物实验证实,在对肥胖大鼠进行8 w游泳训练后,大鼠体质量与血清omentin呈现出明显的负相关,大鼠omentin水平呈现出明显的下降趋势〔35〕。Nikseresht等〔36〕也证实,NRT和AIT不同程度的促进omentin-1的分泌进而降低心脏代谢的危险因素。omentin几乎参与了整个2型糖尿病发病及血管内皮病变的全过程,而有氧运动可以通过刺激omentin的分泌改善糖尿病血管并发症。本实验结果提示,omentin可能通过AMPK/eNOS通路来促进舒血管因子NO的分泌,TNF-α、JNK等炎性因子的激活得到抑制,抑制炎症介质的产生及氧化应激反应,达到改善糖尿病血管内皮功能障碍的作用。

