β-环糊精基金属有机框架材料的制备及其对重金属离子的吸附
王宸杨, 贾 洁, 李发学
(东华大学 纺织学院, 上海 201620)
随着纺织工业高水平竞争的日益加剧,各种纺织材料、染化料与助剂被大量投入到纺织品的创新开发中,与此同时带来大量的废水排放。印染废水中含有大量的有毒重金属离子,常见的有Sb、Pb、Cr等离子。这些重金属离子来源复杂,Sb离子主要来源于涤纶中的催化剂醋酸锑、乙二醇锑以及相关的阻燃剂三氧化二锑[1];Pb离子主要来自印花工艺中采用的含Pb着色剂[2];Cr离子(主要为六价)主要来自铬媒染料的使用。由于这些重金属离子难以生物降解且易在生物体内富集对环境和人体造成危害,因此在排放印染废水之前必须要对其进行处理。目前常见的去除重金属离子的方法主要有化学沉淀法[3]、离子交换法[4]、膜分离法[5]、电解法以及吸附法[6]。化学沉淀法存在沉淀剂用量大,易造成二次污染的缺点,在实际工业生产中存在较多弊端;离子交换法工艺复杂,成本高且持久性差;膜分离法成本高,能耗大,使用寿命短;电解法在处理大量废水时也存在电耗和电极金属的消耗量较大等缺点;而吸附法因投资小、操作简单、效率高、节能环保等优点被广泛采用。目前常见的吸附剂有活性炭[7]、沸石[8]、壳聚糖基吸附剂[9]、纤维素基吸附剂[10]以及环糊精聚合物[11]等。由于印染污水量通常较大,低成本、制备简单、吸附容量大、易脱附和再生效果好的吸附剂已成为该领域的研究热点。
金属有机骨架材料(MOFs)是一种具有周期性网络结构的新型有机-无机杂化多孔材料[12-13],它是由金属离子或金属簇和有机配体通过自组装配位形成的。其多样的结构和可修饰的位点使得MOFs非常适用于水处理领域。β-CD是由淀粉经微生物酶作用后提取制成的由7个葡萄糖残基以β-1,4-糖苷键结合构成的环状物,具有来源广泛、天然绿色、生物相容性好和价格低廉等优点,其结构中含有疏水的空腔,可与尺寸以及极性匹配的有机物分子发生主客体包合作用[14],与金属离子产生螯合、配位;周围和表面存在大量羟基,具有很高的极性和亲水性,有利于交联反应及改性,改性后表面的修饰基团可对重金属离子产生静电吸引和络合作用等[15]。这些优点使得β-CD及其衍生物可用来吸附废水中的各种污染物。同时,以β-CD作为有机配体合成MOFs也符合吸附剂绿色环保、成本较低和吸附性能优异的原则,克服了传统MOFs材料价格昂贵、制备过程复杂等弊端。但β-CD基MOFs在水中易溶解,其晶体结构易坍塌导致吸附性急剧降低,因此需对其进行后处理以提高其在水中的稳定性。利用 β-CD 空腔外缘残余的活泼羟基进行交联反应使MOFs晶体结构稳定,进而提高MOFs在水中的稳定性是一种常用方法。常见的交联剂有环氧氯炳烷(EPI)[16]、 柠檬酸[17]、乙二胺四乙酸(EDTA)[18]等。柠檬酸(CA)作为一种价廉易得的绿色交联剂,利用其对MOFs进行交联处理得到的水稳定性吸附剂具有丰富的活性位点,对重金属离子具有高效的吸附性能[19-20]。
本文以β-CD作为有机配体,通过水热法合成了β-CD基MOFs材料(β-CDMOF),并选取CA作为交联剂,制备了一系列具有良好水稳定性的β-CD基吸附剂(β-CDMOF/CA),并以Sb(Ⅲ)、Pb(Ⅱ)为吸附对象,探讨了所制备的吸附剂对2种重金属离子的吸附性能。所制备的吸附剂具有成本低、绿色环保、吸附容量大的特点,为印染废水重金属离子的处理提供了新的路径,具有较好的应用前景。
1 实验部分
1.1 实验材料与设备
材料:酒石酸锑钾(C4H4KO7Sb·0.5H2O),CP级,纯度为99%,国药集团化学试剂有限公司;硝酸铅(Pb(NO3)2),AR级,纯度≥99%,国药集团化学试剂有限公司;氯化钾(KCl),AR级,纯度≥99.5%,国药集团化学试剂有限公司;β-环糊精(β-CD),纯度为98%,上海麦克林生化科技有限公司;柠檬酸(CA),AR级,纯度≥99.5%,上海麦克林生化科技有限公司;磷酸二氢钾(MKP),AR级,纯度≥99.5%, 国药集团化学试剂有限公司;甲醇(MeOH), 纯度≥99.5%,上海泰坦科技有限公司;1,4-二氧六环,AR级,纯度为99%,上海麦克林生化科技有限公司;盐酸(HCl),AR级,上海凌峰化学试剂公司;氢氧化钠(NaOH),AR级,纯度≥96%,国药集团化学试剂有限公司。
设备:pH计(希玛仪表集团有限公司),DS-2510DTH型超声波清洗器(上海生析超声仪器有限公司),DF-101 S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),S-4800型场发射扫描电子显微镜(日本日立公司);Nicolet8700型傅立叶红外光谱(FT-IR)仪(美国Nicolet公司),D/max-2550VB+/PC型X射线衍射仪(日本理学株式会社),Prodigy型电感耦合等离子体原子发射光谱仪(美国Leeman有限公司),Zeta电位分析仪。
1.2 β-CDMOF/CA的制备
β-CD表面含有大量的羟基,可作为有机配体与钾离子按照一定的比例结合形成β-CD基金属有机骨架晶体;CA表面含有大量羧基,β-CD基金属有机骨架晶体材料表面含有大量羟基,在140 ℃下,选用MKP作为催化剂,二者可发生酯化反应从而制备得到CA交联的β-CD基金属有机骨架材料β-CDMOF/CA,具体制备过程如下:
1)分别称取1.13 g β-CD、0.45 g KCl、0.23 g CA于50 ml 烧杯中,加入10 mL去离子水并超声使其完全溶解,加入5 mL甲醇并置于10 ℃下结晶 12 h, 用甲醇清洗晶体,60 ℃下烘干12 h得到β-CD基金属有机骨架晶体(β-CDMOF);
2)分别称取5 g β-CDMOF置于3个烧瓶中,各加入0.025 g MKP;再称取5、10、15 g CA置于3个烧杯中,分别加入25、50、75 ml 1,4-二氧六环,超声溶解完毕后分别加入到3个烧瓶中,加热至140 ℃下反应3 h;将产物抽真空,除去残留的溶剂,洗涤,于60 ℃下干燥12 h,得到3种不同交联比例的 β-CD 基金属有机骨架材料β-CDMOF/CA(1∶1)、β-CDMOF/CA(1∶2)、β-CDMOF/CA(1∶3)。
1.3 性能测试与结构表征
1.3.1 表面形貌观察
利用场发射扫描电子显微镜(SEM)观察吸附剂的表面形貌。
1.3.2 化学结构测试
采用傅里叶红外光谱仪(FT-IR)分析样品的化学组分,研究CA交联前后材料的结构变化以及吸附剂吸附重金属的机制。
1.3.3 结晶结构测试
采用X射线衍射(XRD)仪分析样品的晶型结构。
1.3.4 水稳定性测试
在室温条件下,将等量的β-CDMOF和β-CDMOF/CA分别加入到相同体积水中充分溶解,将剩余固体过滤并充分干燥后称量。根据溶解前后的质量差计算样品在水中的溶解度,如式(1)所示。
S=(M0-M)/V
(1)
式中:S为溶解度,g/L;M0为β-CDMOF和3种吸附剂的初始质量,g;M为未溶解部分的质量,g;V为水的体积,L。
1.3.5 金属离子浓度测试
采用电感耦合等离子体原子发射光谱(ICP)仪测定经吸附剂吸附后的重金属离子溶液中金属离子的浓度。
1.4 重金属离子吸附实验
采用硝酸铅和酒石酸锑钾分别配制1 000 mg/L的Sb(Ⅲ)和Pb(Ⅱ)溶液,分别稀释成5、10、50、100、200、300、400、500、600、800和1 000 mg/L用于吸附实验。分别称取等量的3种吸附剂加入到配制好的Sb(Ⅲ)和Pb(Ⅱ)溶液中进行批量吸附实验。采用1 mol/L的HCl和1 mol/L的NaOH溶液调节重金属离子溶液的pH值。吸附剂对重金属离子的吸附量和去除率由式(2)、(3)计算得到。
(2)
(3)
式中:Qe为吸附平衡时的吸附量,mg/g;C0为重金属离子溶液吸附前的浓度,mg/L;Ce为吸附后的平衡质量浓度,mg/L;V为溶液的体积,mL;m为吸附剂的添加量,mg;D为重金属离子去除率,%。
分别配制10 mg/L不同pH值的Sb(Ⅲ)和Pb(Ⅱ) 模拟溶液,以研究溶液pH值对重金属离子吸附性能的影响。同时,配制不同浓度的Sb(Ⅲ)和Pb(Ⅱ)溶液,以研究吸附剂对二者的等温吸附性能,设置不同的吸附时间(10 s ~ 12 h)研究二者的吸附动力学(初始浓度为10 mg/L)。对于循环吸附实验,分别将5 mg的吸附剂添加到10 mL质量浓度为10 mg/L的2种离子溶液中进行吸附,将溶液过滤并将滤出的固体浸入50 mL的1 mol/L盐酸溶液中进行脱附,水洗干燥后进行下一次吸附实验。共进行5 次循环吸附-解吸附实验,以研究吸附剂的循环使用性。
2 结果与讨论
2.1 表面形貌分析
图 1为β-CDMOF和添加不同CA交联处理的β-CDMOF/CA的SEM照片。可以看出,β-CDMOF呈现出不规则的形态,而经过CA交联后,β-CDMOF/CA 的外观结构则较为规整,且随着CA添加量的增加,吸附剂的外观形态几乎不发生变化,说明经过CA交联处理,β-CDMOF的形态稳定性有了明显提高。

图1 CA交联前后β-CDMOF的SEM照片Fig. 1 SEM images of β-CDMOF beforeand after cross-linking with different proportions of CA
2.2 化学结构分析


图2 β-CDMOF和β-CDMOF/CA的FT-IR图Fig. 2 FT-IR spectra of β-CDMOF and β-CDMOF/CA
2.3 结晶结构分析
图 3示出β-CDMOF和β-CDMOF/CA的XRD曲线。由图 3(a)可知,β-CDMOF组分中晶相含量较高,主要为晶体结构。而从图 3(b)可看出,经交联后β-CDMOF/CA的衍射峰数量和强度均明显降低,且随着CA用量的增加,30°处衍射峰的强度逐渐减弱。这进一步说明CA与β-CDMOF成功交联发生了反应,导致原有的结晶区含量不断减少,晶体结构逐步发生了变化。
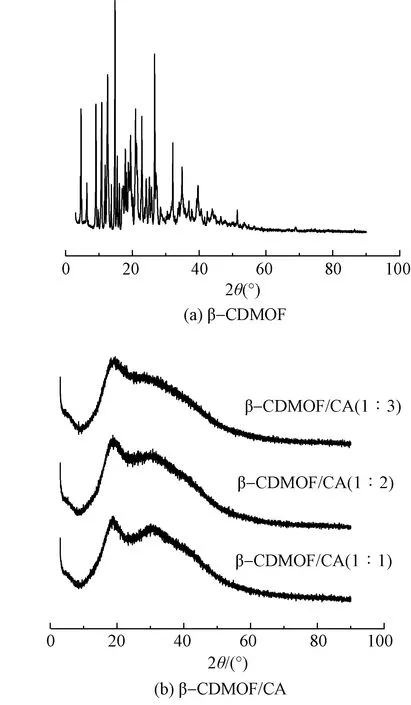
图3 β-CDMOF和β-CDMOF/CA的XRD曲线Fig. 3 XRD patterns of β-CDMOF and β-CDMOF/CA
2.4 水稳定性分析
在室温下,分别称取50 mg的β-CDMOF、β-CDMOF/CA(1∶1)、β-CDMOF/CA(1∶2)和β-CDMOF/CA(1∶3)添加到250 ml去离子水中进行溶解,溶解度测试结果如表 1所示。
由表1可知,3种吸附剂在水中的溶解度远小于β-CDMOF,表明所制备的吸附剂β-CDMOF/CA具有水不溶性的优点,有利于吸附重金属离子后回收再利用。

表1 β-CDMOF和β-CDMOF/CA水中溶解度测试结果Tab. 1 Water solubility of β-CDMOF and β-CDMOF/CA
2.5 β-CDMOF/CA对重金属离子的吸附性
2.5.1 溶液pH值对吸附剂吸附性能的影响
根据金属氢氧化物的溶度积,将Sb(Ⅲ)溶液的pH值范围调节为2 ~ 6;由于Pb(Ⅱ)在pH值大于5时会产生沉淀,将Pb(Ⅱ)溶液的pH值范围调节至1 ~ 5,探究2种金属离子溶液的pH值对吸附剂吸附性能的影响,实验结果如图4所示。
从图4可以看出,当金属离子溶液的pH值较低时,β-CDMOF/CA对2种金属离子的去除率均较低,随着pH值的升高,去除率随之增加。这是因为当pH值较低时,β-CDMOF/CA表面的—COOH和—OH都将质子化形成—COOH2+和—H2O+基团,与溶液中的Sb(Ⅲ)和Pb(Ⅱ)产生静电排斥作用,因此去除率较低;但随着pH值的增加,吸附剂表面的—COOH2+和—H2O+中的H+逐渐电离出来,从而使材料表面带负电荷,同时溶液中金属离子绝大部分以二价或者三价阳离子形式存在,因此吸附剂与带正电的Sb(Ⅲ)和Pb(Ⅱ)产生静电吸引,因而去除率增加。此外还可看出,Sb(Ⅲ)在pH=6时去除率较高,Pb(Ⅱ)则在pH = 5时去除率较高,因此后续对2种金属离子的吸附实验分别在其溶液pH值为5和6时进行。
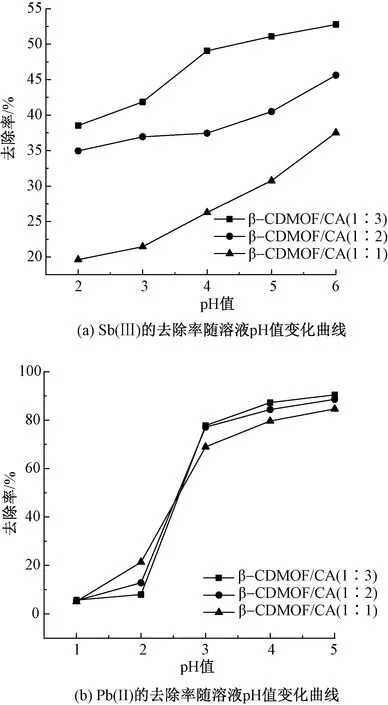
图4 β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)的去除率随溶液pH值变化曲线Fig. 4 Changes of removal rate of Sb(Ⅲ)(a) and Pb(Ⅱ)(b) by β-CDMOF/CA versus pH values of ion solutions
2.5.2 吸附动力学研究
通过测定吸附剂在不同接触时间内对Sb(Ⅲ)和Pb(Ⅱ)的吸附能力来研究吸附动力学。分别用准一级和准二级动力学模型对实验数据进行拟合,2个动力学方程如式(4)、(5)所示,相关模拟曲线和参数分别如图5和表2所示。
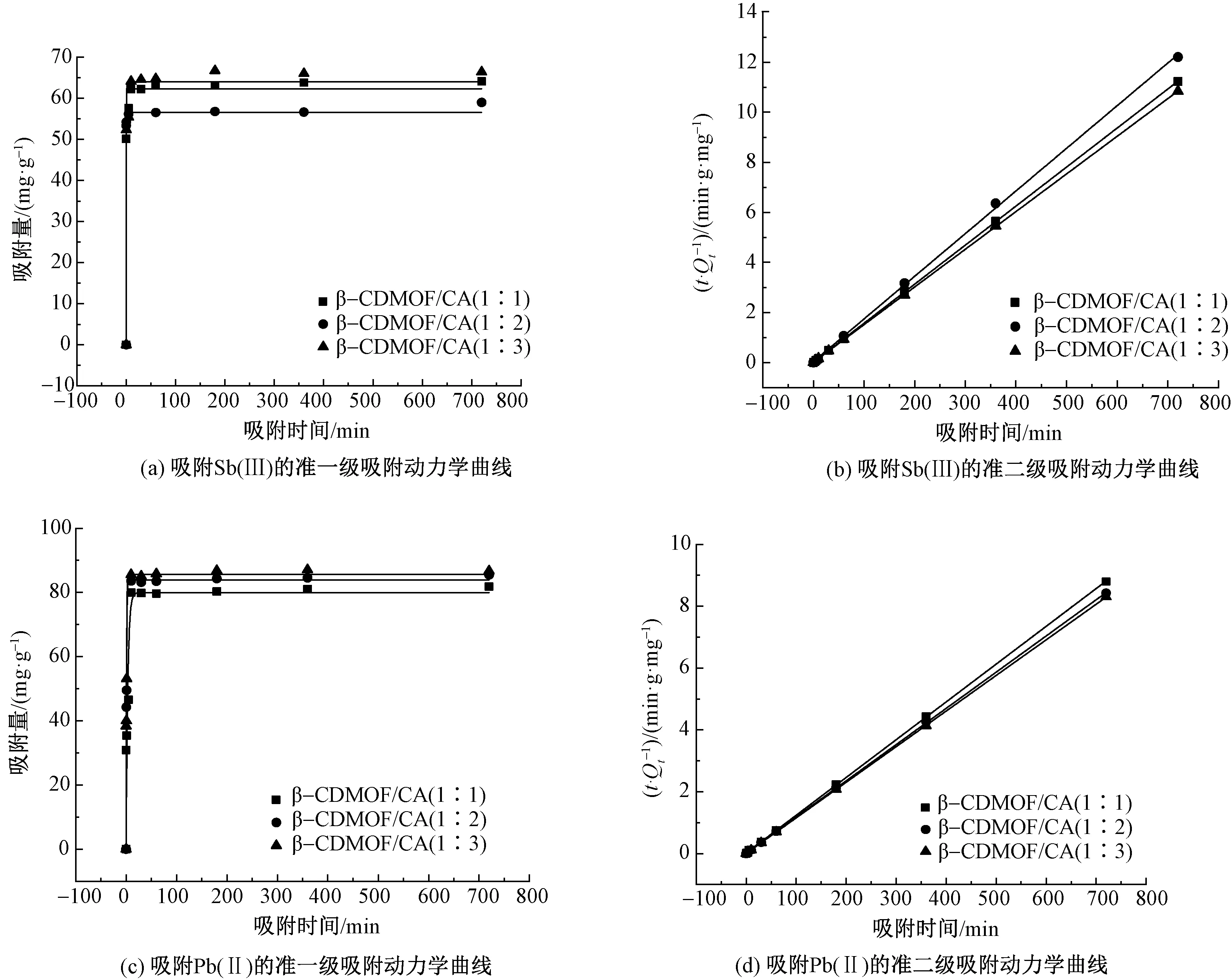
图5 β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)的吸附动力学曲线Fig. 5 Adsorption kinetic curves of Sb(Ⅲ) and Pb(Ⅱ) on β-CDMOF/CA. (a) Pseudo-first-order adsorption kinetic curve on Sb(Ⅲ); (b) Pseudo-second-order adsorption kinetic equation on Sb(Ⅲ); (c) Pseudo-first-order adsorption kinetic curve Pb(Ⅱ); (d) Pseudo-second-order adsorption kinetic curve Pb(Ⅱ)
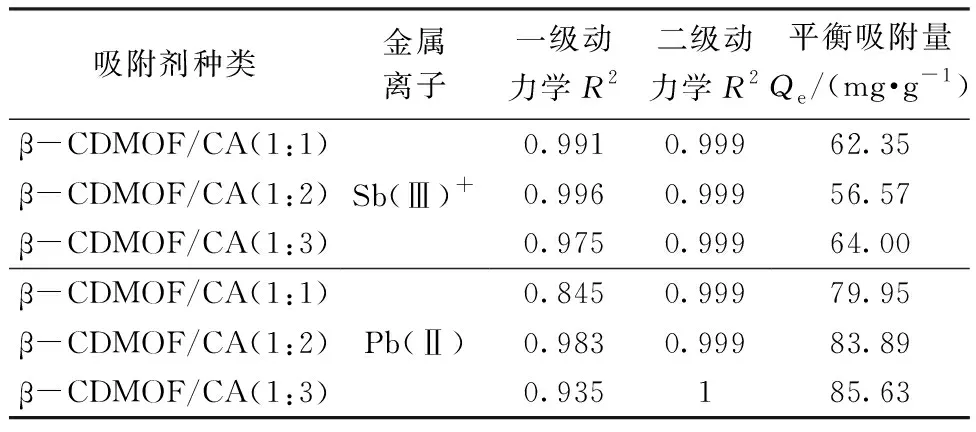
表2 β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)吸附动力学参数Tab. 2 Adsorption kinetic parameters of β-CDMOF/CA for Sb(Ⅲ) and Pb(Ⅱ)
Qt=Qe(1-e-k1t)
(4)
t/Qt=1/k2Qe2+t/Qe
(5)
式中:t为吸附时间,min;Qt为t时吸附剂对金属离子的吸附量,mg/g;Qe为吸附平衡时吸附剂的平衡吸附量,mg/g;K1和K2分别为准一级和准二级的速率常数。
由吸附准一级动力学模型可知,在吸附的初始阶段,3种吸附剂对Sb(Ⅲ)和Pb(Ⅱ)2种金属离子的吸附速率较快,而后吸附速率随着时间的延长逐渐变慢,当吸附时间为3 h时,吸附剂对金属离子的吸附逐渐趋于平衡。吸附12 h后,β-CDMOF/CA(1∶1)、 β-CDMOF/CA(1∶2)和β-CDMOF/CA(1∶3)对Sb(Ⅲ)的吸附量分别为62.35、56.57和64.00 mg/g,对Pb(Ⅱ)的吸附量分别为79.95、83.89和85.63 mg/g。这可能是由于在吸附的初期,吸附剂表面存在大量的羧基活性位点,因此吸附速率较快;随着吸附时间的增加,吸附剂表面的羧基活性位点逐渐被金属离子所占据,因此吸附速率变慢。而β-CDMOF/CA(1∶3)表面所含羧基的数量最多,因此其对2种金属离子的平衡吸附量大于另外2种吸附剂。由此可见,3种吸附剂吸附2种金属离子的机制可能为吸附剂表面活性点羧基的化学吸附以及 β-CD 空腔与金属离子的螯合、配位共同作用的结果。根据准一级和准二级动力学方程对实验数据的拟合可知,吸附过程的准二级动力学模型拟合相关系数R2均大于准一级动力学模型拟合相关系数,说明吸附过程较好地符合准二级动力学模型,吸附机制为化学吸附。
2.5.3 等温吸附研究
研究不同浓度的Sb(Ⅲ)和Pb(Ⅱ)溶液在一定温度下的吸附平衡来分析吸附剂对2种金属离子的等温吸附性。分别采用Langmuir模型和Freundlich模型对吸附实验数据进行拟合,2个模型方程如式(6)、 (7)所示,相关模拟曲线和参数分别如图6和表3所示。
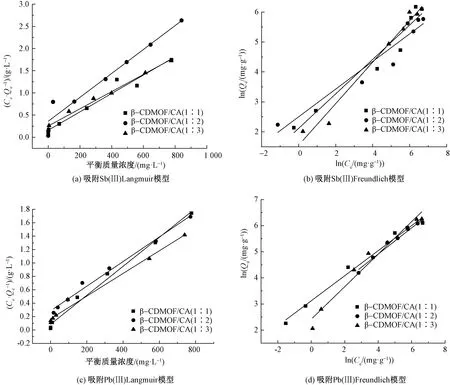
图6 β-CDMOF/CA对Pb(Ⅱ)和Sb(Ⅱ)的等温吸附模型拟合曲线Fig. 6 Adsorption isotherms of β-CDMOF/CA Sb(Ⅱ) and Pb(Ⅱ). (a) Langmuir adsorption isotherm model of β-CDMOF/CA on Sb(Ⅲ); (b) Freundlich adsorption isotherm model of β-CDMOF/CA on Sb(Ⅲ); (c) Langmuir adsorptionisotherm model of β-CDMOF/CA on Pb(Ⅱ); (d) Freundlich adsorption isoltherm model of β-CDMOF/CA on Pb(Ⅱ)
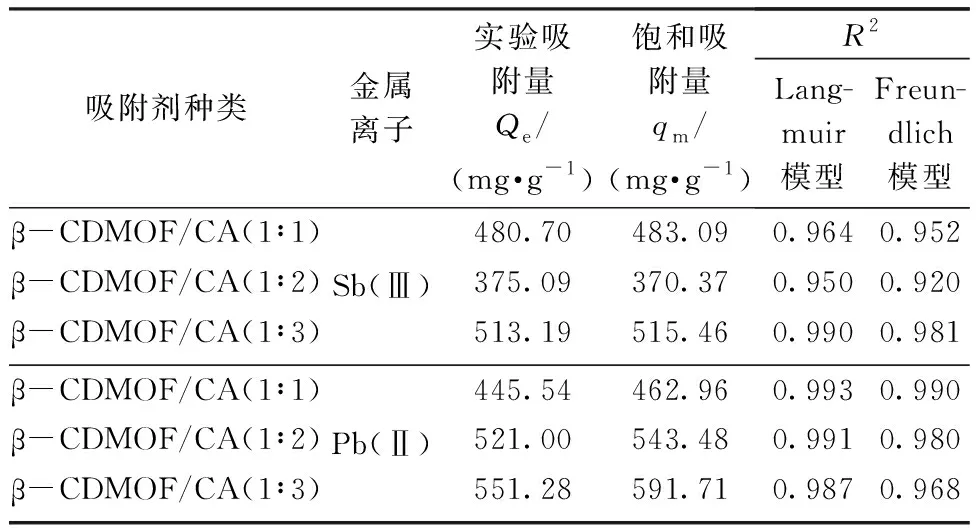
表3 β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)的等温吸附参数Tab. 3 Isothermal adsorption parameters of β-CDMOF/CA for metal ions for Sb(Ⅲ) and Pb(Ⅱ)
Qe=QmKLCe/(1+KLCe)
(6)
Qe=KfCe(1/n)
(7)
式中:Ce为吸附平衡时金属离子溶液的浓度,mg/L;Qm为最大吸附容量,mg/g;KL和Kf分别为Langmuir模型和Freundlich模型的常数;1/n反映了吸附过程的吸附强度。
根据拟合结果相关系数R2的大小可知,3种吸附剂对Sb(Ⅲ)和Pb(Ⅱ)的吸附过程符合Langmuir模型,即为单层、均匀吸附。3种吸附剂对Sb(Ⅲ)和Pb(Ⅱ)的吸附量均随着初始金属离子浓度的增加而增加,当浓度达到一定值时吸附量逐渐趋于稳定。3种吸附剂对Sb(Ⅲ)和Pb(Ⅱ)的饱和吸附量分别为483.09、370.37、515.46 mg/g和462.96、543.48、591.71 mg/g,与实验吸附量也较为接近。β-CDMOF/CA(1∶3) 的吸附量均高于另外2种吸附剂,展现出更为优异的吸附性能。
2.5.4 循环吸附性能研究
为了研究β-CDMOF/CA的循环使用性能,将 Sb(Ⅲ) 和Pb(Ⅱ)溶液初始质量浓度设置为 10 mg/L, 每次吸附后的吸附剂用浓度为1.0 mol/L的盐酸进行脱附,脱附时间为30 min,经过脱附后再投入到下一轮的吸附实验,进行循环吸附研究,实验结果如图7所示。可以看出,经过5 次吸附-解吸附循环后,β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)的吸附率仍分别保持在75%和80%以上,其中β-CDMOF/CA(1∶3)的循环吸附性最为突出。这一结果表明,β-CDMOF/CA对2种金属离子具有优异的循环使用性能,为降低纺织印染废水的处理成本创造了必要条件。
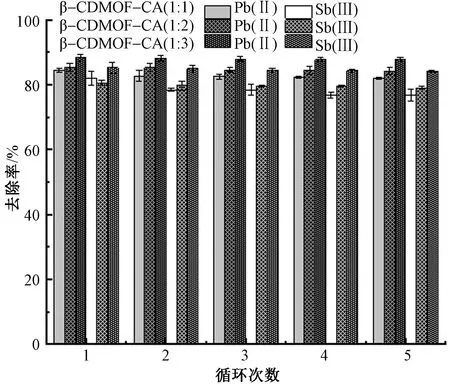
图7 β-CDMOF/CA对Sb(Ⅲ)和Pb(Ⅱ)的循环吸附结果Fig. 7 Cyclic adsorption of β-CDMOF/CA to Sb(Ⅲ) and Pb(Ⅱ)
2.5.5 吸附机制研究
为研究吸附剂对Sb(Ⅲ)和Pb(Ⅱ)的吸附机制,用zeta电位分析仪测定了不同pH值下β-CDMOF/CA表面的电荷,结果如图8所示。可以发现,β-CDMOF/CA(1∶1)、β-CDMOF/CA(1∶2)和β-CDMOF/CA(1∶3)的零电位点(Pzpc)分别在pH值为3.5、3.6和3.8出现,表明在染液pH值分别小于3.5、3.6和3.8时,3种吸附剂表面主要带正电荷。这是因为当染液pH值较低时,β-CDMOF/CA的—COOH发生质子化反应使得吸附剂带正电,同时在该pH值范围内Sb(Ⅲ)和Pb(Ⅱ)主要以正电荷的形式存在,因此吸附剂与带正电的重金属离子之间产生静电排斥,阻碍了金属离子在吸附剂上的吸附,吸附剂主要通过表面的羟基与金属离子形成螯合作用来实现吸附。而当染液pH值大于3.5、3.6和3.8时,3种吸附剂表面带负电荷,这是因为随着染液pH值的逐渐增加,β-CDMOF/CA逐渐脱质子化使表面的—COOH发生电离,表面从而呈现电负性,与重金属离子之间形成静电引力,促进吸附剂对重金属离子的吸附,故β-CDMOF/CA吸附剂对2种重金属离子的吸附率随染液pH值的增加而逐渐增大。综上,β-CDMOF/CA对Sb(Ⅲ)和 Pb(Ⅱ) 的吸附主要通过静电作用和螯合作用来共同实现的。

图8 β-CDMOF/CA的Zeta电位随pH值变化曲线Fig. 8 Zeta potential of β-CDMOF/CA versus pH value
3 结 论
本文以β-环糊精(β-CD)、KCl为原料,采用水热法合成了β-CD基金属有机骨架晶体(β-CDMOF),然后通过添加柠檬酸(CA)进行交联处理制备出具有较好水稳定性和重金属离子吸附性的吸附剂 β-CDMOF/CA, 并对其结构性能进行了系统研究。研究结果表明,所制备的吸附剂为尺寸较为均匀的晶体,水中溶解度低于0.034 g/L,易于从废水中过滤分离;吸附实验结果表明,β-CDMOF/CA对 Sb(Ⅲ) 和Pb(Ⅱ)最大吸附容量分别为 515.46 mg/g 和591.71 mg/g;吸附动力学研究结果表明,β-CDMOF/CA 对2种金属离子的吸附过程符合拟二级动力学模型,是一个化学吸附过程;经过5 次吸附-解吸附循环后,β-CDMOF/CA对两种金属离子的去除率仍超过75%,具有较好的循环使用性能。本文研制的吸附剂具有成本较低、制备简便、绿色环保、吸附性能优异的特性,对纺织印染废水中重金属离子的处理呈现出较好的应用前景。

