基于VEGF/PI3K/Akt/eNOS 信号通路探讨木犀草素干预A 型流感病毒的作用机制
黄家望,王康宇,马心悦,刘卓琳,冯芷莹,尹抗抗*,李 玲,4*
1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.湖南中医药大学中医学院,湖南 长沙 410208;3.湖南中医药大学科技创新中心,湖南 长沙 410208;4.中西医结合病原生物学湖南省重点实验室,湖南 长沙 410208
流行性感冒是一种由流感病毒诱发的累及上呼吸道和下呼吸道的急性呼吸系统感染性疾病,以发热、咳嗽、出汗、肌肉酸痛不适等为主要症状,具有较高的传染性、易感性、发病率和死亡率,其病原体主要包括A、B、C 3 种亚型病毒,其中A 型流感病毒(influenza A virus, IAV)是对全球健康影响最大的病毒亚型[1]。 目前,流行性感冒防治策略主要是每年接种疫苗和使用抗病毒药物,但由于IAV 对原有变异的高易感性对抗,使得IAV 在接种疫苗后可以逃避抗体介导的免疫[2]。 此外,抗病毒药物一般只在流行性感冒感染早期有效,而流感早期与普通上呼吸道感染症状类似,在大多数情况下未引起患者重视,从而错过流感早期就医。 许多IAV 毒株也已经对目前的抗病毒药物产生了耐药性[3],很大程度上限制了临床抗病毒药物的应用。 中医学将流行性感冒归入“时行感冒”“咳嗽”“肺炎喘嗽”范畴,中医具有丰富的临床诊疗经验,在缓解症状、缩短治疗时间、减少病情发展等方面具有独特的优势,同时,越来越多的证据表明,对流行性感冒患者早期予以中医药干预,能够提高治愈率、缩短病程、延缓疾病进展和降低死亡率[4]。
木犀草素的化学名为3',4',5,7-四羟基黄酮,是一种可从多种中草药中分离出的常见的生物活性类黄酮类多酚化合物,其基本结构为两个苯环中间以含氧环和一个碳双键相连,即C6-C3-C6 结构[5]。木犀草素具有调节氧化、抗炎、抗菌、抗纤维化、抗凋亡和抗癌等药理作用[6]。
本研究根据木犀草素的化学结构特征,探索药物与机体的相关性以及木犀草素治疗流行性感冒的潜在作用机制,以期为木犀草素治疗流行性感冒的临床应用提供理论基础。
1 材料与方法
1.1 细胞和病毒株
小鼠肺上皮MLE-12 细胞购自美国细胞培养物收藏中心(批号:CRL-2110),传代保存于本实验室。IAV 病毒株(A/PR/8/34)为湖南师范大学病毒研究室惠赠。将半数致死量(median lethal dose, LD50)病毒尿囊液以灭菌PBS 缓冲液稀释50 倍干预细胞[感染复数(multiplicity of infection, MOI)=0.2]。
1.2 主要试剂
RPMI-1640 基础培养基、磷酸缓冲液、青霉素-链霉素混合液(武汉普诺赛生命科技有限公司,批号:W0022E241、WH0022K191、WHAB23N201);胎牛血清(美国Gibco 公司,批号:2232241);CCK-8 细胞毒性检测试剂盒、小鼠白细胞介素-6(ininterleukin-6, IL-6)ELISA 试剂盒、小鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA 试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:FU2082F83788、E-EL-M0044C、E-EL-M0049c);木犀草素、奥司他韦(美国MedChemExpress 公司,批号:HY-N0162、HY-17016);Trizol 试剂(杭州新景生物试剂开发有限公司,批号:5301100);逆转录试剂盒、荧光定量PCR 试剂盒(上海近岸科技有限公司,批号:E047-01B、E096-01B);细胞核染料DAPI 试剂、Triton X-100 试剂(北京索莱宝科技有限公司,批号:Coo65、T8200);FITC 荧光二抗(美国Proteintech Group 公司, 批号:SA00003);GAPDH 抗体、VEGF 抗体、Akt抗体、PI3K 抗体、eNOS 抗体、山羊抗兔IgG(美国Abcam 公司,批号:ab8245、ab46154、ab38449、ab278545、ab300071、ab150077)。
1.3 主要仪器
台式高速冷冻离心机、微量冷冻离心机、CO2细胞培养箱(赛默飞世尔科技公司, 型号:ST8R、Fresco21、3111);微量移液器(波兰High Tech Lab 公司,型号:LM20);电热恒温水浴锅(上海精宏实验设备公司,型号:DK-S22);实时定量PCR 仪、超微量分光光度计、SDS-PAGE 电泳及转膜设备[伯乐生命医学产品(上海)有限公司,型号:CFX96TOUCH、Take3、JY300HE+JY-SCZ2+JY-ZY5];倒置显微镜(麦克奥迪实业集团有限公司,型号:AE2000-T);多功能酶标仪(美国博腾仪器有限公司,型号:CYTATION3);倒置荧光显微镜(日本OLYMPUS 公司,型号:IX73)。
1.4 细胞培养及造模方法
MLE-12 细胞于37 ℃、5%CO2培养箱内,用含有10%胎牛血清的RPMI-1640 培养液培养,待细胞增殖至培养瓶约90%时,再用0.25%胰酶消化传代。 根据本课题组之前的研究工作[7],病毒感染细胞造模条件如下:待细胞贴壁后,病毒工作液干预细胞2 h 后去细胞上清液,换含药物的病毒维持液干预8 h后收集细胞,处理样本。
1.5 CCK-8 法检测药物细胞毒性
取对数生长期的MLE-12 细胞重悬,按每孔5 000 个细胞接种至96 孔板,待细胞贴壁后进行病毒感染,造模方法同“1.4”。 为探究药物最佳作用浓度,病毒感染2 h 后,按木犀草素的药物浓度(20、10、5、2.5、1.25、0 μmol/L),共设置6 组,每组设置5个重复孔,药物干预时间为8 h。8 h 后将CCK-8 试剂加入96 孔板内,在37 ℃,5%CO2的培养箱中继续孵育2 h,用酶标仪在450 nm 处测量每个孔的吸光度。 计算各组细胞的增殖率和EC50,确定最佳药物作用浓度。
1.6 ELISA 法检测细胞上清液中IL-6、TNF-α 含量
取对数生长期的MLE-12 细胞重悬,按每孔5×105个细胞接种至6 孔板,待细胞贴壁后进行病毒感染,造模方法同“1.4”。 实验设置正常组、模型组、奥司他韦组、高剂量组和低剂量组,奥司他韦组组加入5 μmol/L药物[8],高剂量组和低剂量组根据CCK-8 实验结果分别加入5 μmol/L 和2.5 μmol/L 药物。 药物干预8 h 后收集各组细胞上清液,根据ELISA试剂盒说明书进行操作,检测各组细胞上清液中IL-6、TNF-α 含量。
1.7 免疫荧光法检测各组细胞内血管内皮生长因子(vascular endothelial growth factor, VEGF)蛋白表达情况
取对数生长期的MLE-12 细胞重悬,按每孔8 000个细胞接种至12 孔板,待细胞贴壁后依次进行病毒感染和药物干预,造模方法和分组干预方法同“1.6”。药物干预8 h 后去细胞上清液,用4%多聚甲醛固定细胞15 min,0.5% Triton X-100 室温通透20 min,1% BSA 封闭30 min,VEGF 蛋白一抗(稀释比例为1∶500)4 ℃孵育过夜,山羊抗兔荧光二抗(稀释比例为1∶1 000)37 ℃孵育1 h,避光核复染,封片,拍照,使用Image J 软件对细胞荧光强度定量。
1.8 RT-qPCR 检测细胞内mRNA 表达情况
取对数生长期的MLE-12 细胞重悬,按每孔5×105个细胞接种至6 孔板,待细胞贴壁后依次进行病毒感染和药物干预,造模方法和分组干预方法同“1.6”。药物干预8 h 后收集各组细胞,用Trizol 提取细胞总RNA,超微量分光光度计检测RNA 浓度,按照逆转录试剂盒将1 μg RNA 逆转录成cDNA,根据试剂盒操作说明进行qPCR 扩增。 qPCR 反应条件为95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火延伸30 s,循环40 次,以β-actin 为内参,2-ΔΔCt法计算目的基因相对表达量。 引物序列见表1。

表1 引物序列
1.9 Western blot 法检测细胞内VEGF、蛋白激酶B(protein kinase B, Akt)、3-磷酸肌醇激酶(phosphoinositide 3-kinase, PI3K) 和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)蛋白表达情况
取对数生长期的MLE-12 细胞重悬,按每孔5×105个细胞接种至6 孔板,待细胞贴壁后依次进行病毒感染和药物干预,造模方法和分组干预方法同“1.6”。药物干预8 h 后收集各组细胞,RIPA 裂解液提取总蛋白后用BCA 法测定蛋白浓度,取50 μg 蛋白样品进行SDS-PAGE 电泳后,进行转膜,封闭1 h后分别加入VEGF、Akt、PI3K 和eNOS 蛋白一抗 (稀释比例均为1∶10 000)4 ℃孵育过夜,二抗(稀释比例1∶10 000)37 ℃孵育2 h,加入ECL 工作液后,在化学发光成像仪中显影成像。 使用Image J 软件分析图像灰度值。
1.10 统计学方法
采用SPSS 23.0 统计学软件进行分析,计量资料以“±s”表示,对数据进行方差齐性检验,方差齐时,用One-Way ANOVA 检验,并用LSD 法进行组间的多重比较;方差不齐时,用非参数秩和检验,先用Kruskal-Wallis H 检验比较总的差异,两组间比较采用Mann-Whitney U 检验。 P<0.05 认为差异有统计学意义。
2 结果
2.1 不同浓度木犀草素对损伤细胞活性的影响
使用不同浓度的木犀草素对IAV 感染后的MLE-12 细胞模型进行干预,与0 μmol/L 组相比,木犀草素各剂量组均能降低病毒引起的细胞损伤,且出现不同程度的增殖(P<0.01),其EC50=7.204 μmol/L,基于此,在后续的体外实验中,药物干预浓度选择5 μmol/L 和2.5 μmol/L。 详见图1。
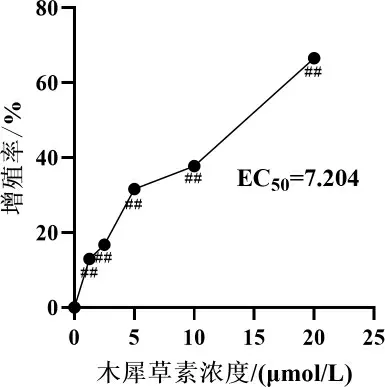
图1 各组细胞的增殖情况
2.2 木犀草素对细胞形态及细胞活性的影响
正常组细胞呈梭形,细胞形态完整;与正常组相比,模型组细胞活性降低(P<0.01),细胞形态发生变化,视野内出现细胞碎片;与模型组相比,各药物组均能不同程度地修复病毒感染后的细胞损伤,细胞活性增加(P<0.01),视野内细胞碎片减少。 详见图2。

图2 各组细胞形态及细胞活性比较(倒置显微镜,×40)
2.3 木犀草素对细胞上清液中炎性细胞因子释放的影响
与正常组相比,模型组细胞上清液中IL-6、TNF-α水平增加(P<0.01);与模型组相比,各药物组IL-6、TNF-α 表达水平降低(P<0.01)。 详见图3。

图3 各组细胞炎性细胞因子水平比较
2.4 木犀草素对细胞VEGF 蛋白荧光强度的影响
与正常组相比,模型组细胞内VEGF 蛋白荧光强度明显增强(P<0.01);与模型组相比,各药物组荧光强度明显降低(P<0.01)。 详见图4。

图4 各组细胞VEGF 蛋白表达情况比较
2.5 木 犀 草 素 对 细 胞VEGF、Akt、PI3K 和eNOS mRNA 表达的影响
与正常组相比,模型组VEGF、Akt、PI3K、eNOS表达增加(P<0.01);与模型组相比,各药物组VEGF、Akt、PI3K、eNOS 表达降低(P<0.01)。 详见图5。
2.6 木犀草素对细胞VEGF、Akt、PI3K 和eNOS 蛋白表达的影响
与正常组相比, 模型组VEGF、Akt、PI3K 和eNOS蛋白表达增加(P<0.01);与模型组相比,各药物组VEGF、Akt、PI3K 和eNOS 蛋白表达均降低(P<0.01)。详见图6。

图6 各组细胞中VEGF 信号通路相关蛋白表达水平比较
3 讨论
IAV 感染后刺激肺内和循环血液中的中性粒细胞进入肺泡腔内,通过释放炎性细胞因子进而引起弥漫性肺损伤和血管内皮损害,导致急性肺水肿或急性呼吸窘迫综合征[9]。抗病毒药物如奥司他韦等多用于临床治疗流行性感冒,但病毒变异株和耐药性大大限制了抗病毒药物在临床上的使用[10]。 中医药在治疗流行性感冒方面具有丰富的临床诊疗经验,具有安全性高、不易产生耐药性以及毒副作用少等特点。 木犀草素作为一种可以从多种中草药中分离出来的类黄酮多酚化合物,具有抗炎、抗氧化等多种生理活性[11]。 本研究通过构建IAV 诱导小鼠肺上皮细胞损伤模型,进一步探索和挖掘木犀草素治疗流行性感冒的作用机制,以期为木犀草素在未来临床治疗流感病毒性肺损伤中提供实验依据。
研究表明,入侵宿主的流感病毒RNA 可通过多种模式识别受体,促进干扰素、炎性细胞因子、类花生酸、趋化因子等的分泌,从而引发局部和全身炎症,造成机体肺部的损伤,甚至组织的破坏[12]。因此,炎性细胞因子的表达可作为确定流行性感冒严重程度和药物治疗效果的重要指标。 本研究结果证实,木犀草素可抑制IAV 感染诱导的炎性细胞因子释放,提示木犀草素可能通过减少感染后炎性细胞因子的分泌来减轻IAV 诱导的细胞炎症。 新生血管的生成在机体的发育和生理稳态过程中至关重要,血管将营养物质输送到组织和器官并去除分解代谢产物,但不受控的血管生长,对许多疾病过程有促进作用[13]。在血管生成、炎性血管生成以及淋巴管生成过程中,VEGF 扮演着至关重要的角色[14]。VEGF 家族成员包括VEGFA、VEGFB、VEGFC、VEGFD、VEGFE和胎盘生长因子(plcental growth factor, PLGF),其中VEGFA 是研究最多的成员,也是最主要的成员,通常被简称为VEGF[15]。 作为一种多功能细胞生长因子,VEGF 与血管通透性的增加和血管内皮细胞的增殖、修复有关[16]。作为血管生成和通透性的关键调节因子,VEGF 介导的PI3K/Akt/eNOS 通路对调节血管内皮细胞增殖、调节炎症反应具有重要作用[17-18]。研究表明,VEGF 表达的变化在急性肺损伤、支气管哮喘和肺纤维化等一些常见呼吸道疾病的病理生理变化中扮演着重要角色[19-21]。 大量实验研究表明,VEGF 过度表达可能造成高渗透性肺水肿[22]。 临床研究也发现了血浆VEGF 水平升高的急性呼吸窘迫综合征患者[23]。 IAV 感染导致的肺部炎症和肺损伤可以促进肺血管增厚、炎性渗出增多[24]。 本研究结果显示,IAV 感染可以升高细胞VEGF、PI3K、Akt 及eNOS 的mRNA 和蛋白表达,表明当IAV 感染细胞时,可以刺激细胞VEGF 的生成和释放,进而刺激细胞PI3K 和Akt 的活化,活化后的Akt 可使刺激血管重塑和血管新生的eNOS 活化后产生一氧化氮(nitric oxide, NO),促进炎性细胞因子分泌增加,在使用木犀草素治疗后可降低VEGF、PI3K、Akt 及eNOS 的mRNA 和蛋白表达,提示在木犀草素防治流感病毒性肺损伤中,VEGF 介导的PI3K/Akt/eNOS信号轴发挥着重要作用。
综上所述,木犀草素能有效缓解IAV 所致的细胞损伤,其作用机制可能是通过抑制VEGF 介导的PI3K/Akt/eNOS 信号通路,从而抑制相关炎症反应,最终抑制IAV 感染引起的细胞损伤。

