中药申请加拿大传统药物资质的证据材料要求和启示
魏嘉茵 ,谭勇,杨龙会*,林林,温博,冯小玉,王湘鹏,谭佳妮,夏玉文
1.中国中医科学院 中医临床基础医学研究所,北京 100700
2.北京中医药大学 管理学院,北京 100029
3.北京中医药大学 中药学院,北京 100029
4.湘潭大学 文学与新闻学院,湖南 湘潭 411105
中医药是我国独特的卫生资源,距今已有5 000多年的发展历史,曾经使用过的和正在使用着的中药品种不计其数。中医药走向世界是时代需求,也是世界范围内对中医药的迫切需求,中医药国际化是保障中医药高质量发展的必要措施[1]。了解海外国家药品注册政策、构建中药产品在各国的注册路径有助于我国中药产品更好地在国外市场上市销售,推动中药企业向进军国际市场,提升中药产品在国际上的认知度。
加拿大医药市场较成熟,且对统医药文化包容度高[2-3],作为参照国研究和构建中药产品海外注册的路径具有先进性。在加拿大市场销售天然健康产品必须获得产品许可证,产品许可证有7 种不同类型的申请。中药产品属于加拿大传统药物的范畴,可以通过传统药物声明的申请途径取得加拿大天然健康产品许可证。目前,中药产品在加拿大成功注册的关键要点和主要难点是如何提供符合加拿大卫生部要求的高质量证据,以支持中药产品的安全性、有效性和质量可控性。本研究通过分析加拿大《天然健康产品作为传统药物使用的许可申请指南》[4]和《传统药物声明:证据标准和证据评估模板》[5],构建资质证据材料体系,从传统药物申请途径的适用性、传统药物的安全性和有效性3 个方面评价药品,并提出一种证据评估模板,帮助申请人准备符合标准的证据,提高申请效率,希望推动中药国际化注册进展,提升中医药在国际上的认知度和竞争力,为我国完善药品注册体系提供参考。
1 加拿大传统药物
1.1 加拿大传统医学和传统药物的定义
传统医学是指基于各种文化所固有的理论、信念和经验的知识、技能和实践的总和,用于维持健康以及预防、诊断、改善或治疗身体或精神疾病的医学。传统药物是指在某一个文化体系或治疗理论下,至少连续使用50 年的产品。符合上述传统药物声明的产品可以通过传统药物途径申请产品许可证。在申请天然健康产品许可证时,需提供2 份独立的传统参考文献或可接受的药典参考文献(如《中国药典》、《国家药品标准》)证明推荐使用条件的合理性。
1.2 适用于传统药物申请流程的法律文件
加拿大《食品和药品法案》、《天然健康产品规章》是对天然健康产品实施监督管理的纲领性法律文件,概述了天然健康产品的适用范围,并明确提出传统药物属于天然健康产品的范畴。除此之外,加拿大卫生部还发布了《产品许可指导文件》等一系列的指导文件指南,帮助申请人了解传统药物如何以传统药物声明途径取得产品许可证。《天然健康产品作为传统药物使用的许可申请指南》和《传统药物声明:证据标准和证据评估模板》作为指导天然健康产品以传统药物声明途径申请许可证的主要指导性文件,对中药产品作为传统药物在加拿大注册提供关键参考和指导。其中现行的第2 版《天然健康产品作为传统药物使用的许可申请指南》于2012 年12 月发布[4],《传统药物声明:证据标准和证据评估模板》则于2004 年1 月发布[5],旨在协助申请人提交完整、高质量的产品许可证申请,确保产品许可证申请符合基本的证据要求。可见充分理解和正确使用两份指导文件可以帮助申请人准备符合传统医学定义的天然健康产品安全性和有效性的证据资料。
1.3 传统药物申请中的相关主体
1.3.1 申请人 天然健康产品申请人负责提供申请材料,并保证材料的真实性、准确性和全面性。在准备申请材料时,应从产品的安全性和有效性2个方面提供证明材料,包括已证明确立的产品安全性和已证明药品风险较低的证据、已证明的产品功效和质量保证的相关资料。
1.3.2 天然健康产品理事会 天然健康产品理事会负责审查产品许可申请的财料,以评估天然健康产品的安全性、有效性和质量可控性,确保天然健康产品的收益大于风险,并保存批准产品许可证的过程记录。
2 中药产品作为传统药物申请的资质证据材料
2.1 健康声明和药用成分
健康声明是“传统药物在推荐使用方式下使用时所能够达到预期的有益效果”的文字说明,常与“推荐使用或推荐目的”或“适应证”互换使用。健康声明(推荐使用目的、剂量、制备方法、剂型或给药途径)的相关内容应与参考文献中的适应症相同。中药产品的健康声明应突出“传统用途”,重点阐释在中医理论背景下,其传统的临床使用经验和临床治疗效果。
产品满足“传统药物的健康声明”条件时,还需要对天然健康产品配方和药用成分进行评估。对于传统配方应证明产品属于某一传统医学体系(如中医药、原住民民族药、阿育吠陀医学等)中完整独立的经典配方;若对配方进行成分的增减,需证明该修改是基于该传统医学体系的知识和经验进行的。对于药用成分,天然健康产品理事会要求天然健康产品中每种成分都应对产品的安全性和有效性产生积极影响,不要求配方中所有成分单独使用时都可以达到推荐的目的;所有药用成分都应记录在该传统药物体系中,并根据适用于该药用成分的传统制备方法制备。传统药物的健康声明、配方和所有的药用成分都应该属于传统医学理论指导下的传统治疗范例或经验,而不是基于现代的证据。中药产品支撑材料应重点概述其基础配方的来源和每种药用成分在古籍中的收录和使用的情况。
以六味地黄丸为例,需详细阐述和提供相关材料,证明六味地黄丸的现代说明书或标准与《小儿药证直诀》在适应证、方解、剂量、制备方法、剂型等方面具有一致性,满足“传统药物的健康声明”条件后,应补充六味地黄丸的出处、组方中每一种药材在中医药其他古籍中安全性和有效性的证据材料、每一种药材制备方法的适宜性等。
2.2 长期使用历史
证明传统药物具有悠久传统使用历史的方法很多,较理想的证据是参考文献,既能够提供特定成分的使用条件(如适应证、剂量、注意事项和禁忌症等)的信息,还有助于建立范例。申请人可以通过以下3 种推荐的途径说明天然健康产品或药用成分具有长期使用的历史。第1 种为:证明传统药物具有两代人安全使用的时间跨度。第2 种为:证明产品符合欧洲关于传统草药的法令;通过提交相关材料证明,申请的传统药物符合欧洲《传统草药产品-关于与人用医药产品有关的共同体法规》(2001/83/EC)[6]。第3 种为:证明澳大利亚治疗产品管理局支持的传统用途的参考文献。中医理论基本形成于春秋战国时期,中药产品的人用经验丰富,基于此申请人可以通过查阅中医典籍、历史古籍,需要拟申请中药产品在两代人上安全使用的时间跨度的证据。
以六味地黄丸为例,六味地黄丸源于《小儿药证直诀》,成书于宋宣和元年(公元1119 年),距今有近千年的历史。通过提供《小儿药证直诀》中六味地黄丸内容、同时期使用历史案例证明六味地黄丸具有长期使用的历史。
2.3 疾病诊断状况
申请人应该至少使用1 份参考文献支持药物在传统医学实践中的应用。传统药物应在传统医学理论的疾病分类标准下使用,且使用传统的制备方法。参考文献还应包括药物的剂型规格、给药途径、用法用量和保质期等内容,需与传统用法说明书内容的一致。以六味地黄丸为例,药品说明书中功能主治描述为“滋阴补肾,用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精”,该功能主治是在中医药基础理论下提出的病症,疾病的分类也属中医学中独有的病名,需提供中医脏腑、阴阳等概念以及疾病说明的历史证据材料。
3 传统药物安全性和有效性的证据材料
3.1 安全性证据材料
传统药物的安全性证据材料可以是概述了药用成分广泛使用历史的参考文献。传统药物产品的适应证可以与历史参考文献不全相同,其使用条件(如剂量、使用时间、原料、制备方法等)应与推荐地使用条件相同。参考文献中的注意事项、警告和禁忌证是安全信息的主要来源。同时应检索是否有新的文献材料报道了药物安全性的问题。如果现有证据证明药用成分不安全,则需要提交相同或更权威的证明材料对药用成分和不良反应之间的因果关系做进一步论述。在没有临床数据的情况下,该问题不予考虑。中药产品中若使用药性较强的中药材,则可以通过增加风险提示减轻安全问题,如限制其使用剂量、使用对象等。
天然健康产品成分数据库中所列的非药用成分不需要安全性或适用性审查,不属于所列非药用成分需要附《天然保健品成分数据库问题表格》[7]。如果提供药典证据来支持产品的功效,则只需要1份证据。在提交非药用成分安全性证据的附加信息时应从以下内容展开讨论:(1)是否说明非药用成分的每日剂量、使用目的、给药途径和暴露情况;(2)非药用成分不能随意添加到产品的配方中;(3)非药用成分的安全要求通常与药用成分的安全要求相同;(4)若非药用成分风险待被验证,则需要其他证据。若制造商在其药用成分中添加某种物质用来提高稳定性或制造工艺,且这些成分在制成的天然健康产品中仍然大量存在,则必须在产品许可证申请表和标签上注明其属于非药用成分。
3.2 有效性证据材料
传统药物的有效性证据类型分为药典证据和其他类型的传统药物证据。申请人应在提交时指出其产品属于哪种证据类别,以保证天然健康产品理事会能够及时处理该申请。
3.2.1 传统药物的药典证据材料 申请人需要回答“传统药典证据类别清单”中所列的问题,清单内容包括:所有药用成分换算成原料药的药用成分的值、所有推荐的用途或目的、推荐的用量、推荐的给药途径、建议的使用期限、剂型、药品使用说明、风险信息(注意事项、警告、禁忌证、不良反应)、制备方法、药典相关页面和适应症不属于《食品和药品法》附表A 所列疾病纸质材料。回答的内容为“是”或“否”,如果所有问题的回答均为“是”,则属于药典证据,且仅需提供1 份支持性参考文献。支持性参考文献必须为以下1 种材料:1 份公认药典专著相关页的副本;1 份由权威机构出版的专著、标准。如果参考文献的出版版本不是英语或法语,应提供原版的文件和英文或法文的翻译版。当参考文献的适应证为严重疾病、病症或异常身体状态(如癌症、抑郁症、酗酒)时,允许修订产品许可证申请表,以使其符合非处方产品的范畴。
中药产品应符合国家药品标准,且其推荐剂量、配伍情况、质量标准等内容应与《中国药典》、《中国药品标准》或国家药品监督管理局批准使用的说明书中的证据相同或相当。
3.2.2 其他类型的传统药物证据 如果“传统药典证据类别清单”中任何一个问题的回答为“否”,则属于其他类型的传统药物证据,应当提供至少2 篇相互独立的支持推荐使用条件的参考文献。相互独立的参考文献是指不引用同一来源,或彼此不引用的信息作为关于成分的传统用法的主要信息来源。如果相关文献只有1 篇或多个文献都回溯到同一个来源文件,权威专家的意见可作为第2 个参考资料。专家意见可用于补充文献中未提供的信息或作为补充信息,以支持先前批准成分的新用途。
在使用专家意见时,应考虑经验、教育程度、专家人数和利益冲突等因素。这些因素和提供的任何其他相关信息将有助于专家意见的权重。
3.3 证明多种药用成分组合具有合理性的证据
多种药用成分组合的传统药物需要提供1 份组合的基本原理说明,具体流程见图1。组合的基本原理说明应着重阐释每种药用成分在产品推荐的使用条件中的具体作用,且应与提交的证据一致。对于没有特定格式的组合原理,应提供每种药用成分存在的原因,以及每种药用成分对产品整体功效和安全性的影响或贡献。
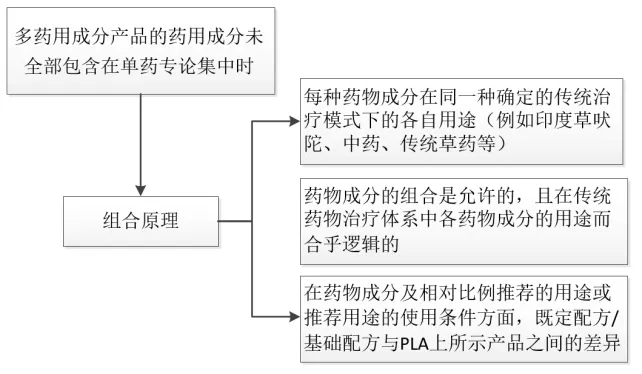
图1 多药用成分产品的组合原理Fig.1 Combination principle of multi medicinal component products
二陈汤由半夏、陈皮(橘红)、茯苓、生姜、乌梅和甘草组成,为燥湿祛痰剂。半夏为君药,具有祛化痰祛湿、和胃降逆的功效;陈皮为臣药,具有化痰理气的功效;茯苓、生姜和乌梅为佐药,具有健脾渗湿、止呕和胃的功效,能够强化君药的作用;甘草为使药,具有和中健脾的功效,能够调和诸药。若拟申请的中药产品以二陈汤为基础配方,但用黄芩代替半夏,则申请人需要在中医理论的基础上解释为什么这种组合理论替代是可以接受的。在所提交的证据中,需要考虑黄芩和半夏的药性(如温、寒等)、归经(如肺、脾、肝等)和功效(如缓解气滞、清热、祛湿等),证明黄芩和半夏的特征和作用机制必须相同,具有互换性。
4 传统药物的证据评估模板
为了提高以传统药物声明途径进行产品许可证申请的证据的准确性,保证产品许可证申请证据材料符合最低质量标准,天然健康产品理事会从申请者角度为传统声明途径证据制定了证据标准和证据评估模板,协助申请人准备完整和高质量的产品许可证申请。此传统药物证据评估模版不作为申请材料提交给天然健康产品理事会。
证据评估模板是一种用于帮助申请人审查证据的工具,是在准据标准的基础上设计形成的评估表格,确保申请人提交的产品许可证申请材料是完整的,并能够充分支持拟申请产品的安全性和有效性。表1 为证据评估模板。证据评估模板包括一系列关于产品中每种药用成分的问题,以及一个与产品推荐用途或用途相关的问题。除第5 题外,申请人应根据其对产品中各药用成分所提交证据对于每个问题进行批判性评估,回答“是”或“否”。对于第5 题,申请人应仅根据产品的推荐用途或用途的措辞回答“是”(√)或“否”(×)。对证据评估模板中的任何问题回答“否”,意味着产品许可证申请严重不足,不符合最基本的证据要求。

表1 证据自评模板Table 1 Evidence self-assessment template
5 加拿大传统药物申请路径和证据材料对我国的启示
为了更好地进入海外医药市场,不仅需要中医药事业不断创新高质量发展,还“走出去”,让更多的人了解和认可中医药,以敏锐的“嗅觉”实时关注和深入研究相关法律法规,引导和协助中成药以传统药物的身份进入加拿大天然健康产品市场。
5.1 加强合作,破除文化差异壁垒,形成中医药多语言版本翻译共识
由于中西方之间存在文化差异,对中成药的安全性、有效性和质量控制的评价要求与国际主流的法规体系存在差异,中成药海外注册仍然存在阻碍。申请人必须提交英语或法语版本的传统药物安全性、有效性支持性的参考文献,如果出版物不是英语或法语,则应提供英语版或法语版的译版章节。中医药需要与时俱进,通过了解探究不同国家文化背景、语言表述习惯和方式,实现中医药术语的精准翻译。由中医药管理人员牵头,组成由中医药临床专家、中医药古籍专家、外国文学专家和专业翻译人员的翻译团队,保证内容翻译准确、语义符合表达习惯的标准化文字材料,并形成中医药文字材料翻译要求和规范,以指导更多中医药文字材料的准确翻译。标准的中医药外文翻译材料既可以打破中医药企业在实现中药产品海外注册时语言方面的阻碍,又可以实现中医药文化的变装,使之与海外国家在语言上、文化上相融相通,激发中医药文化的魅力,起到弘扬发展中医药文化的作用。
5.2 开展证据自查工作,建立符合国情的证据评估模板
在递交传统声明申请的最终阶段,加拿大政府推荐申请人使用声明的证据标准和证据评估模板作为一种工具用来进行最终检查,有助于帮助申请人审查证据,确保作为传统声明提交的证据是完整的,提高双方的效率。我国新修订的《药品管理法》提出了“四个最严”的要求,强调了利用严格的药品管理制度保护和促进公众健康、保障药品的安全、有效、可及[8]。构建适宜我国的证据标准和证据评估模板,能够进一步保证我国药品质量,严格把控药品质量,在不同药品申请途径的最后关卡保证药品申请证据材料的全面和准确。针对不同的场景和申请类型,建立符合我国国情的证据评估标准和模板,开展证据自查工作,加快证据评估流程,提高评审通过率。
5.3 及时反馈证据提交过程中的问题,制定针对性的指导性文件
加拿大卫生部根据目前天然健康产品生产许可证中传统药物类别的申请过程中存在的问题和反馈,及时制定了针对传统药物注册全过程的指导指南,为行业和医疗保健从业人员提供有关如何遵守法律规定提供建议。我国法律文件具有高度概括、语言凝练的特点,但对于文化水平不同、知识背景不同的申请者而言,难以全面地理解和运用政策文件,缺少从反馈中再次提出指导意见的行政文件。从政策制定者的角度,建议根据利益相关者的反馈,以及药品注册过程中科学评审员、评估官和提交协调员获得的经验及时出台一些具有针对性的指南、指导文件,构建政策文件体系。
6 结语
中医药国际化发展是我国重要的战略目标之一,实现中药产品在海外医药市场的合法注册和上市是实现中药国际化的“敲门砖”。中药相关产品属于加拿大健康产品传统药物的范畴、梳理和分析传统药物注册和进口管理相关的政策文件,根据申请材料的目的,梳理构建加拿大健康产品传统药物资质证据材料体系,形成中药相关产品传统药物途径注册路径。加拿大传统药物资质证据材料要求内容清晰、层次分明,支撑材料以医学古籍为主,便于中药产品检索和收集相关证据。同时引入证据自查模版,逐项排查证据的完整性和全面性,帮助申请人提高获得产品许可证审批的效率,为我国中药企业进入加拿大市场提供具有实践意义与参考。
利益冲突 所有作者均声明不存在利益冲突

