酿酒酵母抗氧化活性与发酵香气化合物研究
杨学山 李洁春 杨 柳 李俊娥 祝 霞
(1.甘肃农业大学食品科学与工程学院,兰州 730070; 2.甘肃省葡萄与葡萄酒工程学重点实验室,兰州 730070)
0 引言
酿酒酵母(Saccharomycescerevisiae,S.cerevisiae)在酒精发酵过程中代谢产生的高级醇、酯、醛、酸等化合物,是塑造葡萄酒香气风格与典型性的关键因子[1-2]。但在葡萄酒酿造过程中,发酵菌株会受到高糖、低pH值、乙醇、氧化胁迫等因素的影响,导致细胞内的抗氧化防御系统失衡,产生活性氧(Reactive oxygen species,ROS),破坏细胞脂质、蛋白质和DNA等细胞成分,抑制菌株的生长和发酵[3-4]。此外,ROS还会干扰辅助因子的平衡,改变或破坏靶分子结构,导致关键酶活力降低或丧失,影响发酵香气物质的合成[5]。因此,提高发酵过程中酿酒酵母菌株的抗氧化能力,保持其较高的细胞活力对葡萄酒酿造具有重要意义。目前,国际葡萄与葡萄酒组织已批准酵母多糖作为发酵助剂应用于酿酒生产[6],加之使用绿色安全、便捷、可控和通用性较强,使其成为提升葡萄酒品质的研究热点。
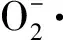
在葡萄酒实际酿造生产中,不同葡萄品种间的酶类和非酶类抗氧化成分组成相对复杂且差异较大。而人工配制的模拟葡萄汁成分明确,既可以满足微生物生长的营养需求,又可以消除发酵体系中其他抗氧化成分对试验结果的影响。为此,本文以模拟葡萄汁为试材,在酒精发酵前添加不同质量浓度的水溶性β-葡聚糖,探究其对酵母细胞的抗氧化活性和挥发性香气化合物的影响规律,以期为深入解析水溶性β-葡聚糖对葡萄酒发酵香气化合物的促进作用机制及其生产应用提供参考依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母菌株Aroma White,购自意大利Enartis公司。
水溶性β-葡聚糖SG 90,购于安琪酵母股份有限公司;糖链结构以β-1,3糖苷键为主,含有部分β-1,6糖苷键支链,纯度85%以上,分子质量200~500 ku,具有良好的水溶性,推荐用量200~500 mg/L。
苯乙醇、正戊醇、正辛醇、乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、乙酸己酯、癸酸乙酯、辛酸乙酯、己酸乙酯、丁酸乙酯等香气标准品均购自美国Sigma公司。
SOD、ATP酶活力测定试剂盒,还原型谷胱甘肽(Glutathione,GSH)、ROS、丙二醛(Malondialdehyde,MDA)检测试剂盒,购自南京建成生物工程研究所;L-苹果酸、纤维二糖、肌醇、B族维生素、生物素等均为国产分析纯,购自上海源叶生物科技有限公司;柠檬酸、硫酸镁、硫酸锰、酒石酸氢钾、偏重亚硫酸钠等常规试剂均为国产分析纯,购自天津光复化工研究所。
1.2 仪器与设备
TRACE1310-ISQ型气相色谱-质谱仪,美国Thermo Scientific公司;DB-WAX型气相色谱柱(30 m×0.25 mm,0.25 μm),美国Agilent Technologies公司;固相微萃取头,50/30 μm DVB/CAR-PDMS,上海安谱科学仪器有限公司;DK-S12型电热恒温水浴锅,上海森信试验仪器有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;LRH-150型生化培养箱,上海一恒科学仪器有限公司。
1.3 方法
1.3.1模拟葡萄汁体系构建
模拟葡萄汁的配制参考文献[14]的方法。其中葡萄糖100 g/L、果糖100 g/L;磷酸氢二铵1 500 mg/L、磷酸二氢钾750 mg/L、硫酸钾500 mg/L、氯化钙0.117 mg/L;肌醇20 mg/L、维生素B515 mg/L、维生素B10.25 mg/L、维生素B60.25 mg/L、生物素0.003 mg/L、维生素B32 mg/L;L-苹果酸3.0 g/L、柠檬酸300 mg/L、酒石酸氢钾2.5 g/L。模拟汁添加40 mg/L SO2(偏重亚硫酸钠计),NaOH调节pH值至3.5。
1.3.2酿酒酵母菌株活化与模拟葡萄汁发酵
按产品说明书推荐方法对酿酒酵母菌株进行活化。将活性干酵母溶于10倍体积无菌水中,37℃静置20 min,再加入等体积的模拟汁,28℃活化 25 min。根据课题组前期研究结果[15],将活化后的Aroma White菌株(0.2 g/L),接种于分别添加300、400、500 mg/L水溶性β-葡聚糖的模拟葡萄汁中,以未添加水溶性β-葡聚糖为对照(CK),20℃恒温培养箱进行酒精发酵,残糖质量浓度小于4 g/L时结束发酵。从接入酿酒酵母菌株(0 h)开始,每隔24 h测定酵母细胞的生物量(以600 nm波长处的吸光度(OD600)表征),绘制Aroma White菌株生长曲线。平行重复3次,结果取平均值。下同。
1.3.3酿酒酵母细胞抗氧化活性测定
1.3.3.1Aroma White细胞中ATP酶活力测定
分别在发酵的第2(初期)、3(中前期)、4(中期)、7天(末期)取样(下同)。参照文献[16]的方法并做修改,10 mL发酵样液在3 500 r/min条件下离心10 min后倾倒上清液,收集酵母细胞;ATP酶活力测定不能引入磷,因此用5 mL 0.9% NaCl洗涤3次后,称量,再次加入0.9% NaCl,冰水浴超声破碎(4℃,功率360 W,开启5 s,停止7 s,共计1 min),制成0.063 g/mL的匀浆。其余操作按照试剂盒说明书进行。
1.3.3.2Aroma White细胞中SOD酶活力测定
参照文献[16]的方法并做修改,收集酵母细胞,准确称取组织质量,用20倍体积的磷酸盐缓冲液(Phosphate buffer saline,PBS)以1 000 r/min离心10 min洗涤酵母细胞,重复2次后,再加入20倍体积的0.9% NaCl,以3 500 r/min离心10 min,冰水浴条件下超声破碎,制成10%的组织匀浆,将匀浆稀释5倍,按照试剂盒说明书进行测定。
1.3.3.3Aroma White细胞中GSH含量测定
按照1.3.3.2节的方法,制成10%的细胞匀浆,按照南京建成试剂盒说明书进行测定。
1.3.3.4Aroma White细胞中ROS含量测定
取发酵样液,3 500 r/min离心10 min收集细胞,PBS洗涤1~2次,将离心收集的细胞用PBS重悬,按照试剂盒说明书加入荧光探针(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA),按预试验确定的浓度10 μmol/mL进行试验。在最佳激发波长500 nm、最佳发射波长525 nm条件下进行荧光检测。
1.3.3.5Aroma White细胞中MDA含量测定
按照1.3.3.2节的方法制成10%的细胞匀浆,参照MDA含量测定试剂盒说明书进行操作。
1.3.4挥发性香气物质分析
参照文献[17]的香气物质萃取方法及GC-MS(气相色谱-质谱联用)条件,并略作修改。
1.3.4.1香气成分富集
取8 mL待测酒样,添加2.5 g NaCl、10 μL 2-辛醇(质量浓度为81.06 mg/L),放入恒温加热磁力搅拌器中,40℃水浴平衡30 min,插入萃取针(旋出萃取头),顶空萃取30 min。
1.3.4.2GC-MS条件
GC条件:色谱柱DB-WAX 60 m×2.5 mm×0.25 μm,进样口温度240℃,传输线温度230℃,离子源温度250℃,不分流进样;载气(He)流速1 mL/min;进样时间5 min;柱温升温程序:40℃保持5 min,以3.5℃/min升至180℃,保持15 min。
MS条件:电子轰击离子源(EI);电子能量70 eV;传输线温度180℃;离子源温度200℃;质谱扫描范围50~350 m/z。
定性定量分析:通过NIST-11、Wiley及香精香料谱库对香气化合物质谱图进行初步检索比对,并结合人工图谱解析进行定性分析,确认各个香气物质的化学成分。对已有标准品的高级醇、酯类和萜烯类等化合物,利用标准曲线(R2>0.995)定量,无标准品的化合物采用化学结构、官能团相似、碳原子数相近的标准物质进行半定量。
1.4 数据分析
测定均重复3次,取平均值,试验数据用Microsoft Excel 2010 计算标准偏差,采用SPSS 19.0进行方差分析,用Duncan’s多重差异显著分析;并用Origin 2018作图。
2 结果与分析
2.1 水溶性β-葡聚糖对Aroma White菌株生长的影响
由图1可知,在整个酒精发酵过程中,不同质量浓度的水溶性β-葡聚糖对Aroma White菌株生物量均具有明显的促进作用。发酵3 d后,酵母细胞的生长趋于稳定;在发酵时间为第7天时,酿酒酵母细胞的OD600由大到小依次为300 mg/L(2.509)、400 mg/L(2.461)、500 mg/L(2.398)、CK(2.046)。与CK相比,分别提高22.63%、20.28%和17.20%。综合分析,在模拟葡萄汁酒精发酵时添加水溶性β-葡聚糖有利于Aroma White菌株的生长,且添加量为300 mg/L时效果最佳。
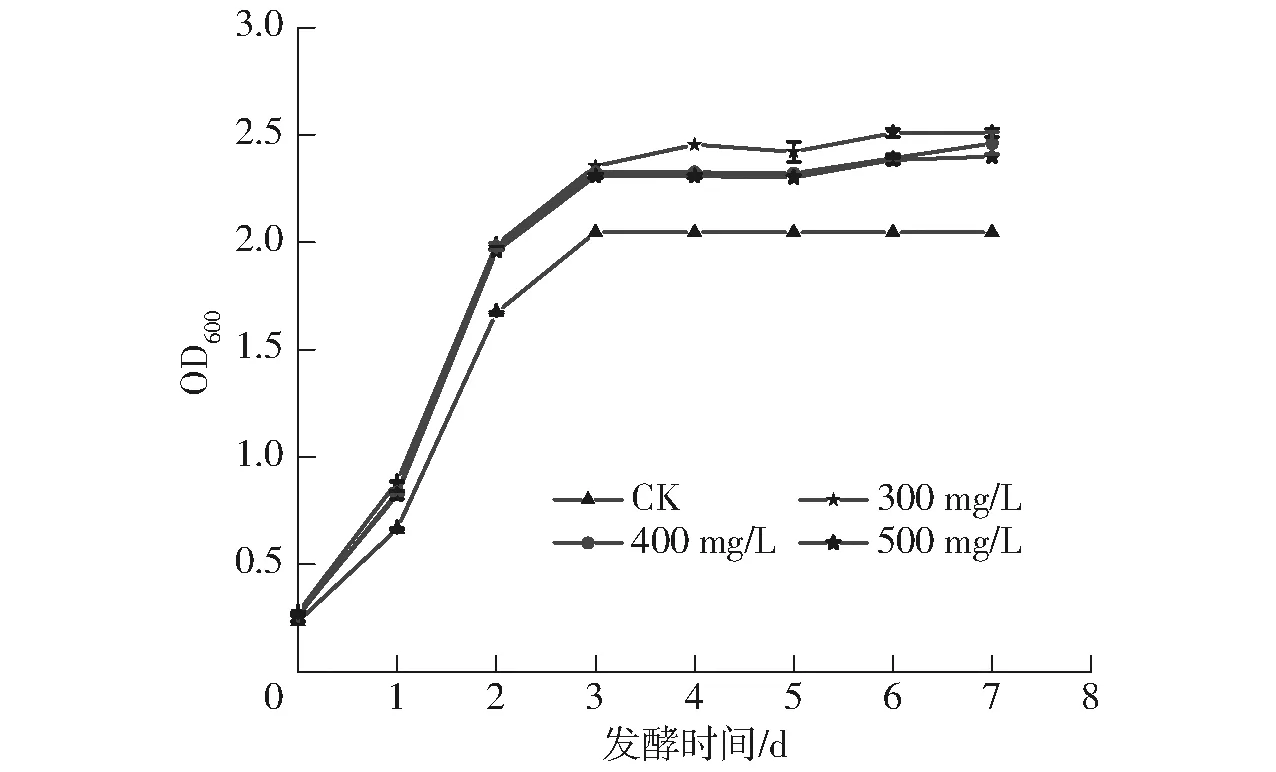
图1 水溶性β-葡聚糖对酿酒酵母生物量的影响
2.2 水溶性β-葡聚糖对Aroma White菌株抗氧化能力的影响
2.2.1ATP酶活力
ATP酶广泛存在于细胞膜系统上,在能量转换、物质运输传递方面起着至关重要的作用,主要通过调节细胞内外渗透压平衡和细胞膜结构与功能的完整性维持细胞正常的生理活性[18]。如图2(不同小写字母表示在P<0.05水平下组内差异显著,下同)所示,受试组酵母细胞的ATP酶活力在中、后期显著升高(P<0.05),在第4天时明显高于对照组(P<0.05),分别比CK增加39.59%、36.43%和21.90%。不同质量浓度的水溶性β-葡聚糖处理组之间也存在差异,其中300 mg/L处理组在酒精发酵第7天时,ATP酶活力最高,比CK显著增加57.04%;400 mg/L和500 mg/L处理组比CK分别提高37.24%和30.13%。
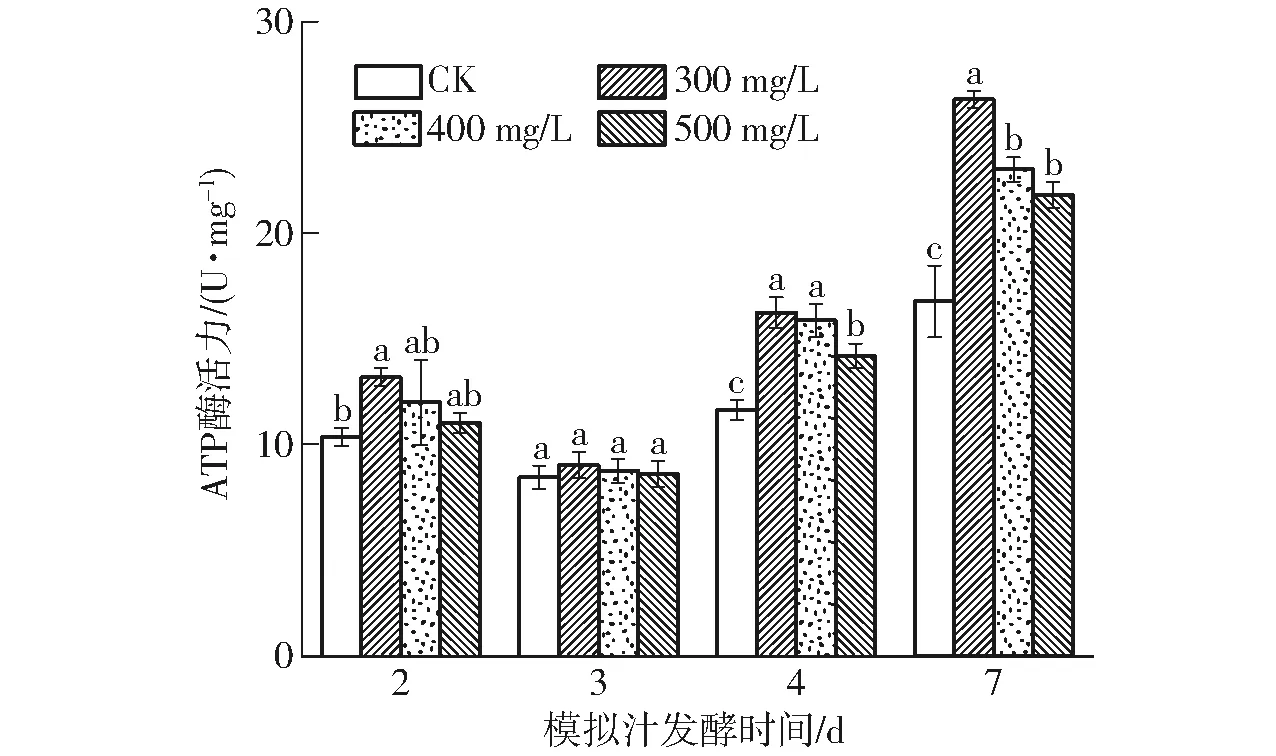
图2 水溶性β-葡聚糖对酿酒酵母细胞中ATP酶活力的影响
2.2.2SOD酶活力
SOD酶作为酵母的主要抗氧化酶,能特异性地清除体内的氧自由基,SOD酶活力的变化能够直接地反映酵母细胞对氧化胁迫应答的水平[19]。从图3可知,在发酵的前期和中期,酵母细胞中的SOD酶活力增高。在发酵的第2天,300 mg/L和400 mg/L 水溶性β-葡聚糖处理组SOD酶活力分别比CK增加了24.85%和12.25%;酒精发酵第4天,300 mg/L处理组SOD酶活力最高,比CK提高22.43%。说明外源性添加水溶性β-葡聚糖能增加菌株SOD酶活力,从而提高细胞的抗氧化能力。

图3 水溶性β-葡聚糖对酿酒酵母细胞中SOD酶活力的影响
2.2.3GSH含量
还原型谷胱甘肽(GSH)和氧化性谷胱甘肽(Glutathione oxidized,GSSG)的氧化还原平衡对于调节细胞ROS水平至关重要,其中GSH可将部分巯基形成的二硫桥还原,防止含巯基的蛋白质与酶免受过氧化物的损害[20-22]。由图4可知,各处理组细胞中GSH含量(质量比)在发酵过程中均高于CK(P<0.05),酒精发酵第7天,300 mg/L处理组的GSH含量最高,比CK提高76.50%,表明水溶性β-葡聚糖作为氧化刺激物,可以通过氧化应激来诱导提高GSH的合成代谢。综上,在酒精发酵前添加水溶性β-葡聚糖可明显促进酵母细胞中GSH的含量,且质量浓度为300 mg/L时效果最佳。
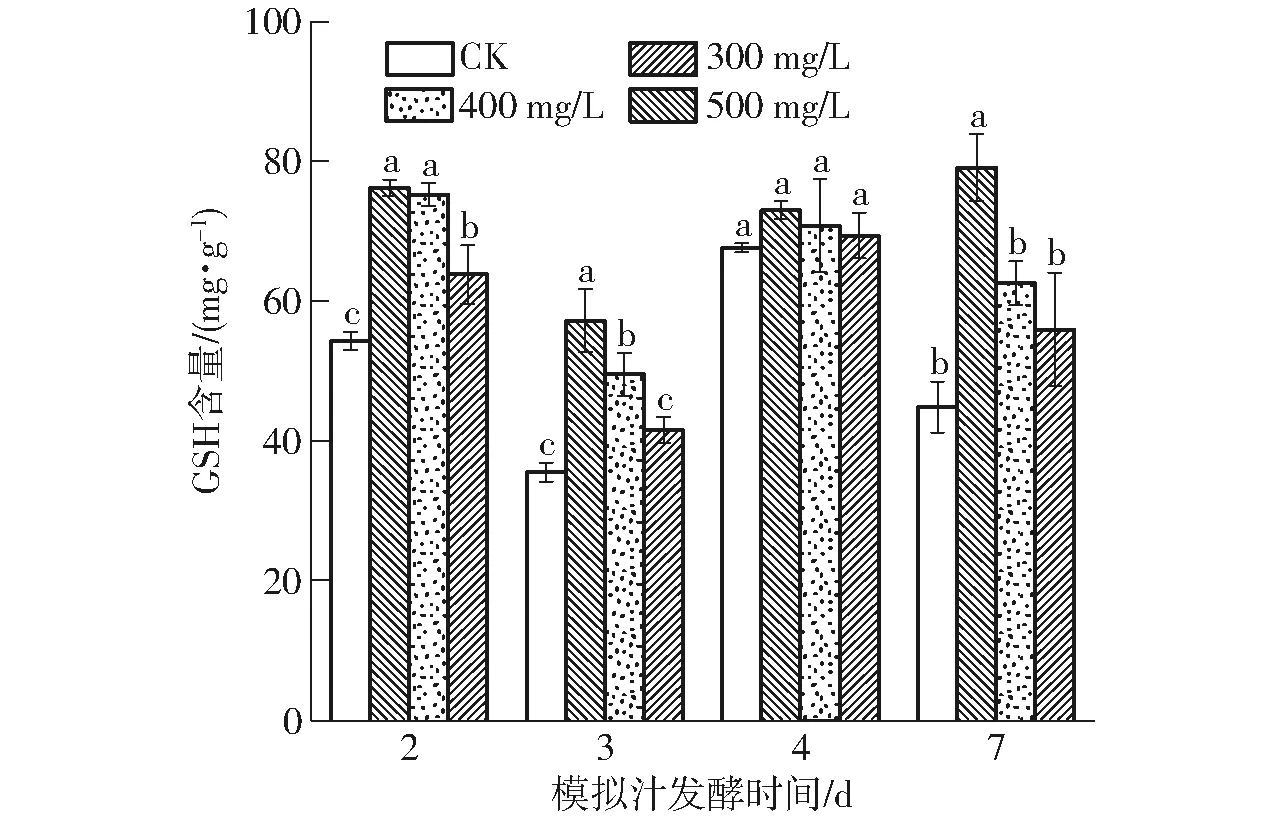
图4 水溶性β-葡聚糖对酿酒酵母细胞中GSH含量的影响
2.2.4ROS含量
在正常的生理代谢活动中,适宜水平的ROS可作为细胞信号传导、基因表达和调控动态氧化平衡的媒介。当细胞内ROS含量过高时,会攻击DNA与蛋白质,并通过诱发过氧化作用影响细胞膜的流动性与稳定性[23]。图5表明,在酒精发酵过程中,酵母细胞中的ROS含量逐渐降低(以荧光值表征细胞内ROS含量)。在发酵第2天时,处理组细胞中的ROS含量均显著低于CK(P<0.05);第3天时,各组细胞中ROS含量由小到大依次为300 mg/L、400 mg/L、500 mg/L、CK,300 mg/L处理组较CK、400 mg/L和500 mg/L处理组分别降低44.14%、16.95%和21.20%;在第7天,各处理组中ROS含量无明显差异,但与CK差异显著(P<0.05)。
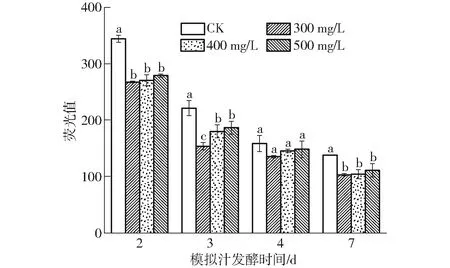
图5 水溶性β-葡聚糖对酿酒酵母细胞中ROS含量的影响
2.2.5MDA含量
酿酒酵母细胞在发酵过程中可以产生氧自由基,攻击生物膜的多不饱和脂肪酸,引起脂质过氧化作用。MDA是膜脂过氧化的主要产物之一,可作为评价其作用强弱的重要指标[20,22]。由图6可知,酒精发酵前添加水溶性β-葡聚糖会降低酿酒酵母细胞内MDA含量。在发酵的第2天,处理组与CK不显著,第3、4天,处理组的MDA含量均显著低于CK(P<0.05)。其中第4天时,供试组MDA含量由小到大依次为300 mg/L组(1.49 mg/g)、500 mg/L组(2.17 mg/g)、400 mg/L组(2.74 mg/g)、CK组(4.22 mg/g),其中300 mg/L处理组较对照组显著降低64.69%。由此表明,添加水溶性β-葡聚糖在酒精发酵(AF)前期和中期显著减弱了膜脂过氧化反应,减弱了MDA对酵母细胞膜的损伤,且以添加质量浓度为300 mg/L时效果最佳。
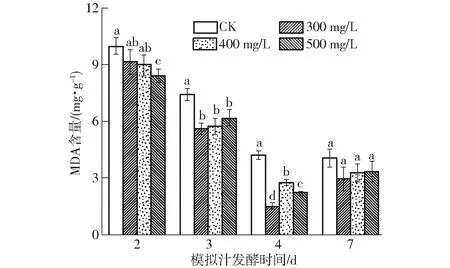
图6 水溶性β-葡聚糖对酿酒酵母细胞中MDA含量的影响
2.3 水溶性β-葡聚糖对挥发性香气化合物的影响
外源性添加不同质量浓度的水溶性β-葡聚糖模拟汁发酵酒样中的主要香气物质GC-MS检测结果如图7(图中星号表示处理组与CK或处理组之间差异显著(P<0.05),ns表示处理组之间差异不显著(P>0.05))所示。试验共检测出89种香气化合物,其中酯类37种、高级醇类21种、酸类15种、萜烯类4种、其他类13种。
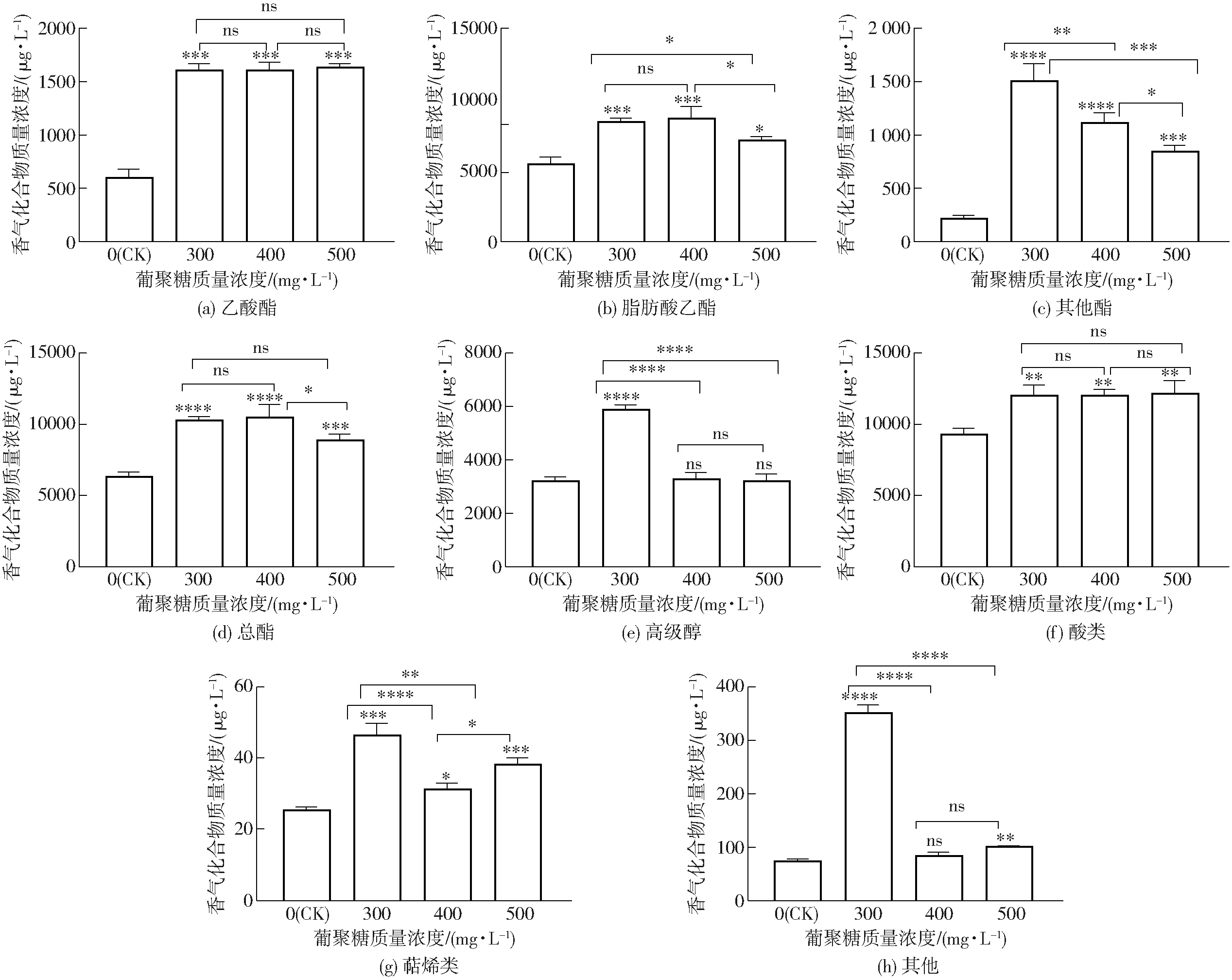
图7 不同处理组酒样的挥发性香气物质
酯类物质对葡萄酒的花果香气具有积极贡献,主要包括乙酸酯、脂肪酸乙酯和其他酯类。本试验共检出4种乙酸酯,占酯类物质总量的9.42%~16.42%。各处理组之间乙酸酯类物质总量之间无显著差异(P>0.05),但与CK相比,水溶性β-葡聚糖处理组的乙酸乙酯含量分别显著增加19.84%、9.55%和31.32%(图7a)。与CK相比,300 mg/L和400 mg/L处理组中脂肪酸乙酯含量分别显著增加了47.32%和51.42%(图7b)。各处理组中辛酸乙酯和癸酸乙酯的含量最高,尤其是辛酸乙酯含量比CK分别提升45.39%、47.65%和51.42%。酯类物质总质量浓度由高到低为400 mg/L组(10 626.40 μg/L)、300 mg/L组(10 434.24 μg/L)、500 mg/L组(9 096.53 μg/L)、CK组(6 509.88 μg/L)(图7d)。
在所有的发酵酒样中,异戊醇的含量最高,约占高级醇类化合物含量的55%以上。其次是苯乙醇和异丁醇。300 mg/L和400 mg/L处理组之间的异戊醇含量没有显著差异,但显著高于CK(P<0.05)(图7e)。各试验组共检出14种酸类物质,质量浓度依次为913.91、1 120.29、1 187.56、1 214.85 μg/L(图7f)。与对照组相比,300、400、500 mg/L处理组的辛酸含量分别提升28.88%、27.42%、29.94%,但均未超过感官阈值,对葡萄酒香气不存在负面影响。处理组萜烯类物质比CK显著增加,但是各处理组之间不存在显著差异(P>0.05)(图7g)。
参考文献[1]的方法,选择所有风味活性值(Odor activity value,OAV)大于0.1的发酵香气成分进行主成分分析(Principal component analysis,PCA)。由图8可知,PC1和PC2分别占数据总体方差的61.04%和25.45%,二者累计贡献率为86.49%,可明显区分水溶性β-葡聚糖处理组与CK酒样。辛酸乙酯、辛酸、癸酸乙酯,花香、热带水果、脂肪味及300 mg/L和400 mg/L处理组酒样主要分布在第一象限;己酸乙酯和500 mg/L处理组酒样分布在第四象限,而CK酒样分布在第三象限且无任何香气成分分布。总体分析,水溶性β-葡聚糖处理有利于促进辛酸乙酯、癸醛、丁酸乙酯、癸酸乙酯、辛酸、芳樟醇等香气化合物的生成,酒样的花香、热带水果和柑橘类香气潜在特征较CK更加突出。
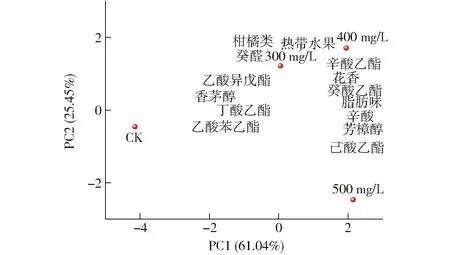
图8 水溶性β-葡聚糖处理酒样中香气化合物及香气特征的主成分分析
2.4 酿酒酵母细胞ATP酶活力及抗氧化能力与挥发性香气化合物的相关性分析
将增香效果最突出的300 mg/L水溶性β-葡聚糖处理组中,OAV大于0.1的挥发性香气化合物,分别与酿酒酵母细胞ATP酶活力及抗氧化能力进行Pearson相关性分析。结果表明(图9),辛酸乙酯质量浓度与ATP酶活力存在强正相关性(r=0.92),与ROS质量浓度和MDA含量存在强负相关(r<-0.9)。辛酸乙酯质量浓度与SOD酶活力和GSH含量均存在较强正相关性(r>0.8),辛酸、辛酸乙酯、芳樟醇质量浓度与ROS含量和MDA含量存在较强的负相关性(r<-0.8),乙酸异戊酯质量浓度与MDA和ROS含量存在正相关性(r>0.6),这可能与酿酒酵母细胞合成分泌的酯酶对不同酯类底物的水解平衡有密切关系。
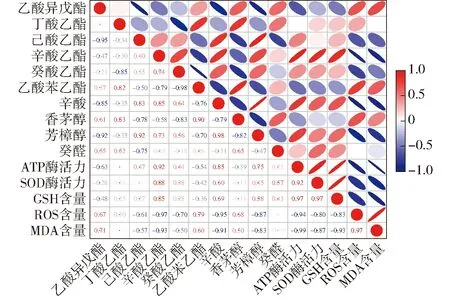
图9 酿酒酵母细胞抗氧化能力与挥发性香气化合物的相关性热图
3 讨论
文献[18]发现细胞对大部分的外界胁迫反应都集中在线粒体,尤其是在电子传递链(Electron-transport chain,ETC)上。外界的胁迫使酵母细胞的ATP需求增加,当线粒体无法产生足够的ATP支撑细胞抵抗胁迫时,就会影响到细胞增殖。本试验结果表明,外源性添加水溶性β-葡聚糖可以显著增加酿酒酵母ATP酶活力,以利于增强线粒体功能来提高细胞对多种胁迫的耐受性。GSH可使细胞内巯基酶的活性基团维持还原状态,保证了抗氧化酶发挥生理功能[21];同时GSH自身也可够清除ROS自由基,延迟细胞凋亡[24]。本试验中,水溶性β-葡聚糖能显著提高酿酒酵母细胞中SOD和GSH活性(P<0.05),降低MDA水平,且与其抗氧化能力之间存在一定剂量-效应关系。其中300 mg/L水溶性β-葡聚糖处理组中抗氧化酶活力较高,尤其是发酵中、末期,GSH对细胞维持较高水平的抗氧化能力具有积极作用,从而使发酵菌株保持较高的生物量,有利于合成和分泌更多的挥发性香气化合物。
本试验进一步证实,添加300 mg/L的水溶性β-葡聚糖后,模拟汁发酵酒样中的乙酸酯、脂肪酸乙酯类和高级醇的含量显著增加(P<0.05)。究其原因,可能与水溶性β-葡聚糖提高了ATP酶的活力有关[25]。活力显著增高的ATP酶可催化产生更多的ATP参与脂肪酸活化,并促进酯化反应的进行,提高了酒样中己酸乙酯、丁酸乙酯、辛酸乙酯、癸酸乙酯等中链脂肪酸乙酯的含量。水溶性β-葡聚糖处理组中高级醇含量显著高于对照组(P<0.05),也可能与S.cerevisiae中ATP酶活力增强,分解更多的ATP有利于为Ehrlich途径提供能量[26]。此外,模拟汁发酵酒样也检测到了微量的萜烯类化合物,300 mg/L 处理组中萜烯类化合物含量较对照组增加80.10%,这与发酵过程酵母中的ROS降低,减少了萜烯类等香气物质的氧化降解作用直接相关[27],也与文献[28]研究证明GSH可以降低某些重要的酯类、萜烯类等香气化合物的氧化损失结果一致。
相关性热图分析结果表明,300 mg/L水溶性β-葡聚糖处理对苯乙醇、正辛醇的生成促进作用最为明显,表明水溶性β-葡聚糖处理有利于促进酵母细胞的Harris代谢途径,提升酒样的醇香和花香。脂肪酸参与酯类物质生成,是合成酯类风味化合物不可或缺的前体物质,其含量对于水果香气特征的感知至关重要[29]。水溶性β-葡聚糖处理组的辛酸含量较对照组均有增加,同时引起了辛酸乙酯含量较对照组均显著增加。其中300 mg/L处理组辛酸乙酯含量增加最为明显,推测可能是水溶性β-葡聚糖促进了酵母脂肪酸的代谢,进一步转化生成了脂肪酸乙酯,这与文献[30]的研究结果类似。但抗氧化活性与其他酯类化合物的转化水解平衡,尤其对酯酶活力的调控关系需要进一步探讨。
4 结束语
在模拟葡萄汁中外源性添加水溶性β-葡聚糖,能够促进酒精发酵过程中酵母细胞的生长,有效降低细胞内ROS的积累,使ATP酶活力、SOD酶活力和GSH含量保持相对较高的水平,抑制MDA的生成,具有良好的抗氧化能力。同时,300 mg/L水溶性β-葡聚糖还可以明显提高模拟葡萄汁发酵酒样中酯类、高级醇类物质的含量,且与酿酒酵母细胞的抗氧化能力呈高度正相关。综合分析,外源性添加300 mg/L水溶性β-葡聚糖,可以促进酿酒酵母的生长、提高细胞抗氧化水平,增强发酵香气化合物的合成,具有应用在葡萄酒/果酒增香酿造的潜力。

