pH值和阳离子对环丙沙星与土壤胶体共运移的影响
刘晓雯,邵明艳,徐绍辉,林 青*
pH值和阳离子对环丙沙星与土壤胶体共运移的影响
刘晓雯1,邵明艳2,徐绍辉1,林 青1*
(1.青岛大学环境科学与工程学院,山东 青岛 266071;2.青岛地质工程勘察院(青岛地质勘查开发局),山东 青岛 266101)
采用静态吸附实验和柱实验,分析了不同pH值和阳离子条件下,环丙沙星(CIP)与棕壤胶体共运移的特征.结果表明,棕壤胶体在pH值为4.0时抑制了CIP的运移;而在pH值为7.0和9.0时无显著影响,但部分CIP以胶体的形式迁移.与pH值相比,阳离子(Na+/Ca2+)对CIP与棕壤胶体共运移的影响更为显著.除了低NaCl(0.001mol/L)浓度外,大量棕壤胶体的沉积抑制了CIP的运移;随着离子强度和阳离子价态的增加,棕壤胶体对CIP的吸附能力降低,抑制作用减弱.在0.01mol/L NaCl条件下,溶液离子强度的降低导致CIP随胶体的释放而活化,而在CaCl2条件下则不会,这可用DLVO理论和物理形变效应来解释.此外,CIP的存在增大了胶体表面电荷的不均匀性,促进了胶体的凝聚,故不同pH值和阳离子条件下CIP均抑制了棕壤胶体的运移.简言之,土壤胶体的移动性及其吸附能力共同决定了胶体对CIP运移的影响,在评估抗生素的潜在环境风险时,应慎重考虑CIP的运移形式而不仅仅是总量.
胶体;环丙沙星;共运移;石英砂;吸附
环丙沙星(CIP)是一种被广泛用于人类医学和动物疾病预防的喹诺酮类抗生素,由于用量大、体内代谢转化率低(15%~40%)且在污水处理厂难以被去除而导致大量CIP以原药或代谢产物的形式进入环境.CIP含有羧基(—COOH)、羰基(C=O)、胺基(—NH)等多种官能团,其强极性和多离子基团导致不易被生物降解,极易在土壤、地下水、沉积物等环境介质中积累[1-3].研究表明抗生素会改变土壤微生物群落结构,导致细菌耐药性的产生,同时对人体健康造成严重威胁[4-5].抗生素在土壤或地下水中的运移受多种因素的影响,如抗生素的化学性质、pH值、离子强度/类型、介质表面性质等.CIP在不同pH值条件下以不同离子形式存在,它们与多孔介质表面的吸附机制和亲和力不同,从而影响CIP的移动性和生态毒性.胶体广泛存在于土壤环境和水体系中,具有较大的比表面积和大量的吸附位点,对污染物表现出较高的亲和力,可作为污染物的载体改变污染物的归趋.Chen等[6]和Zhang等[7]研究发现胶体对CIP的吸附受溶液化学条件的影响,随着pH值的升高, CIP的吸附量逐渐降低;Na+、Ca2+等阳离子的存在可与CIP反应,形成金属-CIP络合物,使胶体对其的吸附能力降低[8-9].同时,胶体的稳定性和移动性也会受到pH和阳离子的影响[10-12],继而改变抗生素的环境行为.因此,不同化学条件下CIP的环境问题引起广泛关注,全面了解地下环境中抗生素迁移转化影响因素及作用机制对于对评估其生态风险至关重 要.
CIP或重金属等污染物在地下环境中可以溶解态的形式迁移,也可附着在移动的胶体上以胶体态的形式迁移.尽管胶体对抗生素迁移的影响研究已有很多,但有关抗生素对胶体移动性影响及抗生素迁移形态(溶解态或胶体态)的研究鲜有报道.冯桐桐等[13]、Zhang等[7]和Yang等[14]研究发现磺胺二甲嘧啶(SMZ)和CIP改变了黏土矿物胶体和生物炭胶体的迁移能力.与溶解态相比,胶体态抗生素的生物利用度增加,降解能力降低,并能增加细菌产生耐药性的风险[15-16].相关研究在胶体与抗生素共运移方面取得了一定的进展,但对胶体-抗生素-介质的作用机制仍缺乏深入的了解,尤其是胶体存在下抗生素的迁移形态及其影响因素.
因此,本文以CIP和棕壤胶体为研究对象,采用柱实验的方法分别研究了不同pH值(4.0, 7.0, 9.0)和阳离子(Na+,Ca2+)条件下,CIP与棕壤胶体在饱和多孔介质中共运移的行为.为了进一步揭示棕壤胶体对抗生素运移的影响,在吸附实验的基础上,考虑了胶体吸附CIP的固体浓度效应,分别测定和计算了出流液中溶解态和胶体态CIP浓度及土壤胶体浓度.研究结果可为抗生素污染环境风险评价提供基础数据,对土壤/地下水抗生素污染的防控和修复提供借鉴.
1 材料与方法
1.1 供试材料
环丙沙星(CIP,纯度>99.0%)购于中国珠海实验设备有限公司,化学式为C17H18FN3O3,易溶于水溶液中,是一种两性化合物,具有两个质子结合位点[17],在不同pH值条件下以不同的离子形式存在,如图1所示.用去离子水配制100mg/L的CIP原液,实验中所用抗生素浓度均由原液稀释得到,用NaCl或CaCl2调节溶液阳离子类型和浓度,用NaOH或HCl调节pH值.不同化学条件下,CIP在48h内降解可忽略不计.

棕壤胶体由采自青岛市即墨蓝村镇(120°17'E, 36°42'N)的棕壤(0~20cm)制备.棕壤占青岛土壤总面积的59.8%,是青岛市分布最广、面积最大的土壤类型,基本理化性质如表1所示.取30.0g过100目筛的土壤样品置于烧杯中,加入1000mL去离子水制成悬浊液,超声分散30min后静置,根据Stokes公式,采用静水沉降—虹吸法提取粒径小于1μm的棕壤胶体颗粒.将提取的胶体悬浊液加入到2L容量瓶中用去离子水定容,采用重量法测定胶体原液浓度,实验中所需的胶体浓度均由原液稀释得到.根据土壤pH值的范围且考虑到酸化问题设置实验的pH值为4.0、7.0和9.0,阳离子则选取土壤/地下水中常见的Na+和Ca2+.采用纳米粒度Zeta电位仪测定不同pH值和离子强度/类型下棕壤胶体的zeta电位和粒径,根据DLVO理论计算石英砂与胶体颗粒间的势能.DLVO理论主要采用范德华引力和双电层排斥力来描述胶体颗粒、胶体与多孔介质之间的相互作用力,二者共同作用决定了胶体颗粒在溶液中的稳定性以及胶体与多孔介质之间的固着-分离,进而影响胶体在多孔介质中的运移行为[18].

表1 供试土壤基本理化性质
实验采用石英砂模拟多孔介质,粒径范围为0.425~0.600mm.为了去除砂粒表面杂质,先后将石英砂在0.1mol/L HNO3和0.1mol/L NaOH溶液中依次浸泡24h,再用去离子水反复冲洗至中性,最后在105℃条件下烘干备用[19].取适量石英砂颗粒研磨成粉末[20],测定不同pH值和离子强度/类型下石英砂的zeta电位,计算石英砂与胶体颗粒间的DLVO势能.
1.2 实验方法
1.2.1 静态吸附实验 为了研究棕壤胶体对CIP的吸附能力,且考虑到胶体的固体浓度效应,进行了不同棕壤胶体浓度下CIP等温吸附实验.将不同pH值和阳离子条件下的胶体和CIP溶液加入离心管中,棕壤胶体的浓度梯度设置为10,20,30,40,50mg/L, CIP的浓度梯度为2,4,6,8,10mg/L.将离心管置于(25±0.5)℃的振荡器上振荡24h后,取悬浊液过0.22μm滤膜,然后用紫外分光光度计在278nm处测定滤液中CIP的浓度,并计算胶体对CIP的吸附量.每个实验均设3个重复.吸附等温线由Langmuir方程拟合[21],获取不同化学条件下,不同浓度棕壤胶体对CIP的吸附参数.
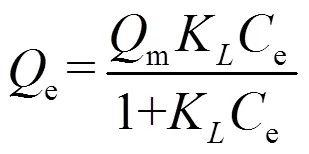
式中:e为达到平衡时CIP在棕壤胶体上的吸附量,mg/g;m为最大吸附量,mg/g;K为吸附平衡常数,L/mg;e为达到平衡时溶液中CIP浓度,mg/L.

表2 实验设置
注:max为最大排斥势垒,min为次级势阱.
1.2.2 柱实验 砂柱装填前,首先将长20cm,内径5cm的有机玻璃柱底面和内壁涂抹一层凡士林,减少边壁优势流,然后将石英砂分层依次加入有机玻璃柱(长20cm,内径5cm)中,每填装一层用玻璃棒搅拌并压实,以保证石英砂填装均匀,孔隙度为0.44左右.在砂柱两端进出水口处分别放置一层厚度约2mm的脱脂棉,防止砂粒流出堵塞进出水口.砂柱填装完成后,启动蠕动泵,用不同条件下的背景溶液自下而上饱和砂柱,以排尽空气;待砂柱饱和后改变入流方向,以1mL/min的恒定流速通入3孔隙体积(3PV)的CIP或棕壤胶体或CIP与棕壤胶体混合溶液,考察CIP/胶体吸附运移特征;然后再通入3孔隙体积(3PV)的背景溶液进行冲洗,最后再通入pH值为7.0的去离子水冲洗,考察CIP/胶体解吸运移特征,直至出流液中不再有CIP或棕壤胶体流出为止,各柱实验条件的设置如表2所示.
出流液用自动部分收集器每隔20min收集1次,溶液平分2份,1份过0.22μm滤膜,采用紫外可见分光光度计在278nm处测定滤液中CIP浓度(溶解态);1份在400nm处(此波长下CIP的吸光度接近于零)测定棕壤胶体浓度.出流胶体携带的CIP浓度通过吸附等温方程计算获得.在整个实验过程中,为防止胶体絮凝沉淀,将输入溶液置于磁力搅拌器持续搅拌;同时,为了保证研究的可靠性和准确性,每个实验至少进行2次.
2 结果与讨论
2.1 棕壤胶体对CIP的等温吸附特征
不同pH值条件下,CIP的存在形态不同,其与棕壤胶体间的相互作用不同.从图2中可以看出,随着pH值的增加棕壤胶体对CIP的吸附能力逐渐降低,这主要是因为随着pH值的升高,CIP+逐渐减少,而CIP0和CIP-的含量增加,带负电荷的棕壤胶体对CIP的静电吸附作用减弱.在pH 7.0时,两性离子CIP+/−占主导地位,其可通过氨基所带的正电荷被棕壤胶体吸附[2],然而吸附的减少表明两性离子的阳离子交换能力低于CIP+.除静电吸引外,两性离子上酮基和羧基上的氧原子也可通过氢键或表面络合作用被棕壤胶体吸附[2-3,22].随着pH值的增加(pH 9.0),棕壤胶体表面电位降低(-45.3mV),CIP主要以阴离子的形式存在,CIP-与胶体间的排斥力增大,吸附进一步减少,此时,CIP主要通过离子配对、阴离子交换作用吸附到胶体表面.

阳离子对棕壤胶体吸附CIP的影响与其类型和浓度有关.与去离子水相比,Na+的存在增加了棕壤胶体对CIP的吸附,而Ca2+的存在抑制了棕壤胶体对CIP的吸附,且随着Na+/Ca2+强度的增加,CIP的吸附量减少.一方面,Na+的存在降低了棕壤胶体表面负电位(-46.0mV),有利于静电吸附;另一方面,与Ca-胶体体系相比,CIP+和CIP+/−更易进入Na-胶体体系的层间结构中[23],从而增加了胶体对CIP的吸附.对于Ca2+而言,其使棕壤胶体表面电位升高,粒径增大,吸附位点减少,导致胶体对CIP的静电吸引减弱;其次,Ca2+可与CIP上的-COOH 形成金属络合物,使棕壤胶体与CIP的结合受到抑制,而Na+与CIP的络合能力低于Ca2+[24]; Na+/Ca2+可与CIP竞争棕壤胶体表面的吸附位点,浓度越高,竞争能力越强,从而降低了棕壤胶体对CIP的吸附.已有研究表明,喹诺酮类抗生素主要通过静电吸引作用被吸附[2,25-26],故阳离子竞争极大地影响了棕壤胶体对CIP的吸附.但是,当Ca2+浓度为0.001mol/L,棕壤胶体浓度为10mg/L时,离子强度和胶体浓度较低,二价阳离子桥键作用突显,在一定程度上增加了胶体对CIP的吸附.

图3 不同离子强度/类型下CIP在棕壤胶体上的吸附等温线

表3 不同溶液化学条件下胶体对CIP的等温吸附参数及Qm与胶体浓度的指数方程

续表3
如图2和图3所示,不同溶液化学条件下,随着棕壤胶体浓度的增加,CIP吸附等温线明显降低.在固-液吸附体系中,吸附剂颗粒和吸附剂分子(或离子)之间存在相互作用,包括碰撞、粘附、静电作用和范德华力等[27].吸附剂颗粒之间的相互作用会减少有效吸附位点,从而降低吸附容量,且吸附剂浓度越高,相互作用的影响越大,即固体浓度效应.随着胶体浓度的增加,土壤颗粒的相互作用导致其有效吸附位点减少,从而降低了对CIP的吸附.Langmuir方程可以较好地描述棕壤胶体对CIP的吸附,拟合参数与胶体浓度相关,表现为最大吸附量m与胶体浓度呈指数关系(表3),而L在相同的化学条件下变化不大且e对其不敏感.因此,可以根据砂柱出流液中测定的胶体浓度确定参数m,L取相应溶液化学条件下的均值,根据Langmuir方程,由液相中CIP的浓度计算胶体对CIP的吸附量(mg/g),进而获得出流液中胶体态CIP的浓度(mg/L).
2.2 pH值对CIP与棕壤胶体运移特征的影响
2.2.1 不同pH值下单一CIP/棕壤胶体的运移特征 从图4中可以看出,不同pH值条件下,CIP的峰值随pH值的增加而显著增加,回收率由48.65%升高到93.71%,与Chen等的研究结果一致[28].这主要是因为CIP在不同的pH值条件下以不同的离子形式存在(图1).在pH值为4.0时,CIP主要以阳离子形式存在,与带负电荷的石英砂表面之间的静电吸引以及表面络合作用促进了对CIP的吸附,导致了CIP在砂柱中的滞留增强[29].随着pH值的升高,CIP+逐渐减少,静电吸附减弱,CIP的出流量浓度逐渐升高.pH值为7.0时,CIP主要以中性/两性离子形式存在,可通过静电吸引、氢键、疏水分布等作用被石英砂吸附[30].当pH值增加到9.0时,CIP-增多,石英砂电位降低(-45.3mV),静电斥力增强,从而导致在石英砂表面的吸附减少.由此可见,抗生素在不同pH值下的离子形态是控制其在多孔介质中运移的主要因素.此外,在较高的pH值条件下,石英砂表面的粗糙度和化学异质性会减弱[31],导致CIP运移增强.
不同pH值条件下,棕壤胶体和多孔介质的电位不同,两者之间的相互作用力不同,从而造成出流胶体浓度不同.pH值的增加降低了胶体和石英砂表面电位(表2),分别从-10.7和-6.6mV降到-36.7和-45.3mV,排斥作用增大,从而降低了棕壤胶体在石英砂表面的吸附,导致出流浓度增大(图4),这与李兵等[32]研究结果一致.胶体的粒径也会影响胶体的迁移,pH值的改变对棕壤胶体颗粒的影响不大(389.5~ 441.2nm),胶体粒径与石英砂粒径之比(p/c)小于0.001,无物理形变(physical straining)滞留作用发生[33].胶体主要通过重力沉降、拦截作用滞留在砂柱中,这与Shen等[34]和Bradford等[35]的研究结论相同.

2.2.2 不同pH值下CIP与棕壤胶体的共运移特征 胶体在不同溶液环境条件下的运移、沉淀和释放规律,对于理解胶体的环境行为和对污染物运移的影响具有重要的意义.随着pH值的增加,棕壤胶体和石英砂表面电位绝对值增加(表2),静电斥力增强,导致棕壤胶体的出流浓度增大(图4).与单一棕壤胶体相比,CIP的存在抑制了棕壤胶体的运移.pH值为7.0和9.0时,共运移胶体穿透曲线的峰值分别从0.71和0.83降到0.39和0.58;pH值为4.0时,无胶体出流.这主要是因为棕壤胶体对CIP的吸附使胶体表面电位升高,胶体与石英砂间的斥力作用减弱,滞留量增加;另外,石英砂对CIP的吸附增加了其表面的粗糙度和化学异质性,有助于对胶体的吸附.pH值为4.0时,胶体双电层被压缩,颗粒之间的排斥力降低,胶体发生凝聚,粒径显著增大(4446nm),导致p/c>0.001,部分胶体通过形变作用被滞留在砂柱中.
土壤胶体的移动性及其对CIP的吸附作用影响着多孔介质中CIP的迁移.从图5(b)-(d)中可以看出,在不同pH值条件下,棕壤胶体对CIP运移的影响不同.pH 为4.0时,棕壤胶体的存在抑制了CIP的运移.CIP穿透时间延迟,峰值和回收率分别从0.46下降到0.09和48.65%下降到12.47%(表4),CIP主要以溶解态的形式迁移.棕壤胶体具有较大的比表面积,能够为带正电荷的CIP提供大量吸附位点[36],吸附在棕壤胶体上的CIP随胶体的沉积而被滞留在砂柱中;此外,沉积在石英砂表面的棕壤胶体为CIP提供了额外的吸附位点.通入pH值为7.0的去离子水后,羟基离子浓度增加,少量CIP发生解吸.pH值为7.0和9.0时,与单一CIP的运移相比,棕壤胶体对总CIP的运移没有显著影响,穿透曲线基本重合,但是约40%的CIP以胶体的形式迁移,改变了其生态环境风险.这是因为在中性和碱性条件下棕壤胶体具有较高的移动性,回收率分别为35.77%和53.23%,CIP0和CIP+/−能够通过表面络合、阳离子交换和氢键等作用与胶体结合[37],且在此条件下CIP的溶解度较低,疏水作用也促进了胶体对CIP的吸附[40],故部分CIP由胶体携带发生迁移.

图5 不同pH值条件下CIP与棕壤胶体共运移的穿透曲线
不同pH值条件下棕壤胶体对不同形态CIP运移的影响不同.随着pH值从4.0增加到9.0,溶解态CIP的迁移能力增大,这是因为随着pH值的增加,棕壤胶体和石英砂对CIP的吸附量逐渐降低.另外,在较高pH值条件下,由于羟基离子浓度增加,吸附在胶体和石英砂表面CIP容易解吸[29],促进了溶解态CIP的运移.胶体态CIP的运移受胶体的流动性以及胶体对CIP吸附的影响.棕壤胶体在pH 7.0时对CIP的吸附能力大于pH 9.0(图3),然而由于棕壤胶体在pH 9.0时的运移高于pH 7.0,因此导致胶体态CIP在pH 7.0和pH 9.0时相差不大.

表4 不同pH值条件下CIP的穿透时间、峰值和回收率
2.3 离子强度/类型对CIP与棕壤胶体运移特征的影响
2.3.1 不同离子强度/类型下单一CIP/棕壤胶体的运移特征
从图6可以看出,随着离子强度和阳离子价态的增加,CIP的穿透曲线峰值增大,回收率逐渐增加.首先,Ca2+减少了石英砂表面的负电荷(表2),不利于CIP在石英砂表面的静电吸附.其次,CIP可通过羧基和酮基与Ca2+形成Ca-CIP络合物[8],使游离态CIP比例减少,且随着Ca2+浓度的增加,表面络合作用增强,从而导致CIP出流浓度增加,这与孙凯璇等[39]的研究一致;Na+与CIP的络合能力较弱[24],因此CIP的出流浓度较低.第三,高浓度的阳离子可以与CIP竞争石英砂表面的吸附位点,从而降低对CIP的吸附,导致CIP的出流浓度随离子强度和阳离子价态的增加而增大.Lv等[40]研究表明阳离子桥键作用对抗生素在石英砂介质上的吸附影响不大.值得注意的是,与去离子水相比,Na+的存在抑制了CIP的运移,这可能是因为在0.001mol/L Na+下石英砂表面电位降低导致静电吸附增加;此外,NaCl对疏水化合物的吸附具有盐析作用[41],盐析效应可能是影响较高Na+浓度下CIP(logkow=1.32)吸附的另一个重要因素.
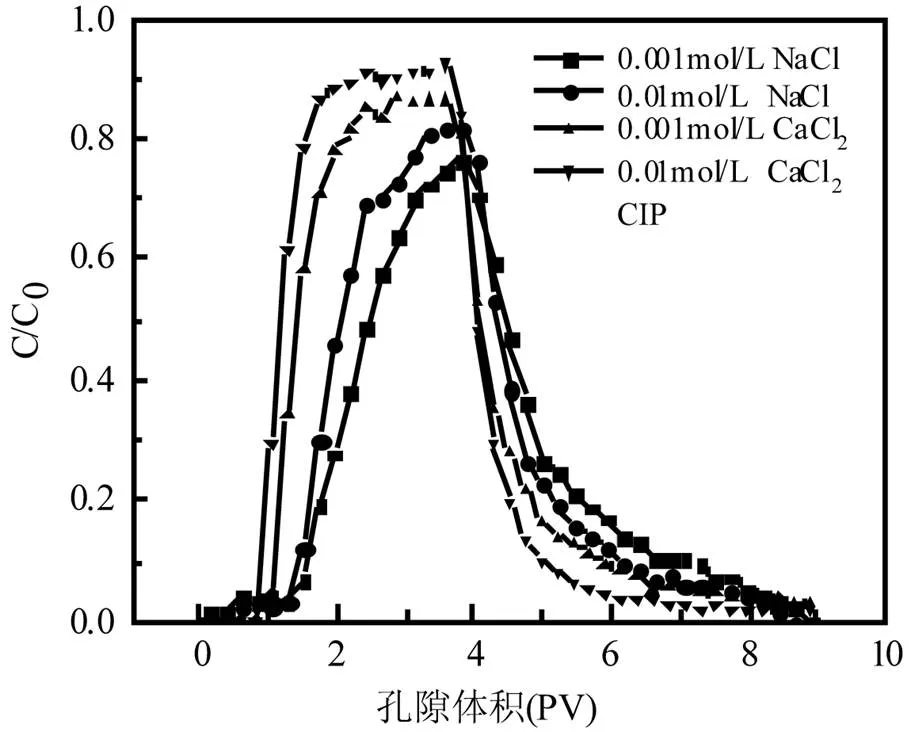
图6 不同离子强度/类型下CIP运移的穿透曲线
与pH值相比,离子强度/类型对胶体迁移的影响更为显著,Na+/Ca2+的存在显著抑制了棕壤胶体在多孔介质中的运移.如图7所示,随离子强度和阳离子价态的增加,穿透曲线峰值降低,当背景溶液为Ca2+时,无胶体流出.随着离子强度的增加,胶体和石英砂表面的双电层被压缩而变薄,电位绝对值降低,胶体与石英砂之间的静电排斥力减小,范德华引力增强[42],表现为最大排斥势垒(max)降低,由411.5kBT变为2.81kBT,次级势阱(min)变深,由-0.28kBT变为-12.97kBT,导致更多的胶体在石英砂表面沉积.0.001mol/L Na+时,max> 400kBT且min>-1kBT,胶体主要通过石英砂的粗糙度和化学异质性被滞留在砂柱中.0.01mol/L Na+时,棕壤胶体的穿透曲线呈上升趋势,表明胶体迁移行为主要受阻隔作用的影响,原因在于随着棕壤胶体的通入,砂柱表面可供胶体附着的位点数减少,导致随后的胶体不能有效附着,颗粒迁移能力增加.电解质中阳离子价态越高,对双电层的压缩能力越强,胶体更易发生聚沉现象.Ca2+对胶体的凝聚作用强于Na+,胶体粒径显著增大,导致p/c>0.001,部分胶体通过形变作用滞留在砂柱中;另外,Ca2+存在的条件下,二价阳离子的桥键作用增加了石英砂对棕壤胶体的吸附[14],从而导致胶体在通入阶段没有流出.去离子水淋洗阶段,离子强度降低,导致胶体的双电层厚度增加,胶体颗粒之间的静电斥力增大,介质对胶体的吸附力减弱,部分胶体从石英砂表面活化释放出来随溶液迁移.吕雪艳等[43]研究离子强度对棕壤胶体释放的作用时,也发现淋滤液离子强度降低促进胶体释放迁移.0.001mol/L Na+条件下,降低离子强度,无棕壤胶体释放,进一步说明棕壤胶体的滞留不是由DLVO作用引起;Ca2+对胶体的凝聚作用强于Na+,凝聚后的胶体颗粒比Na+更稳定,故棕壤胶体释放量低于Na+;另外,Ca2+浓度较高时,次级势阱消失,此时胶体主要滞留在初级势阱中,这部分胶体通常被认为是不可逆的,对溶液离子强度的变化不敏感,故降低离子强度,胶体不释放.
2.3.2 不同离子强度/类型下CIP与棕壤胶体的共运移特征 与单一棕壤胶体运移相比,不同离子强度/类型下,CIP的存在显著抑制了棕壤胶体的运移,除0.001mol/L的Na+外,胶体均被滞留在砂柱中.如表2所示,CIP使棕壤胶体的电位和粒径显著增大,故促进了胶体沉积[44].由DLVO理论可知,0.001mol/ L Na+时,CIP的存在使max(306.9kBT)和min(-0.35kBT)有所降低,但仍不利于胶体的吸附,滞留胶体的增加主要是由于石英砂对CIP的吸附使其表面化学异质性增大,这进一步证实了在低离子强度(DI和0.001mol/L NaCl)下,胶体主要通过石英砂表面的粗糙度和化学不均匀性被滞留在砂柱中. 0.01mol/L Na+时,CIP显著增大了棕壤胶体的粒径(2088nm),使部分胶体通过物理形变阻塞作用滞留在砂柱中;另外,CIP显著降低了次级势阱(-30.20kBT),大量胶体被滞留在次级势阱中;当电解质溶液中的离子强度降低时,次级势阱会变浅或消失,滞留在次级势阱中的棕壤胶体被释放出来.背景溶液为Ca2+时,次级势阱消失,胶体主要滞留在初级势阱中,通入去离子水后无释放;同时,棕壤胶体的粒径大于发生物理形变阻塞的临界值0.001,部分胶体被多孔介质的小孔隙截留,降低离子强度也不会引起该部分胶体的释放.
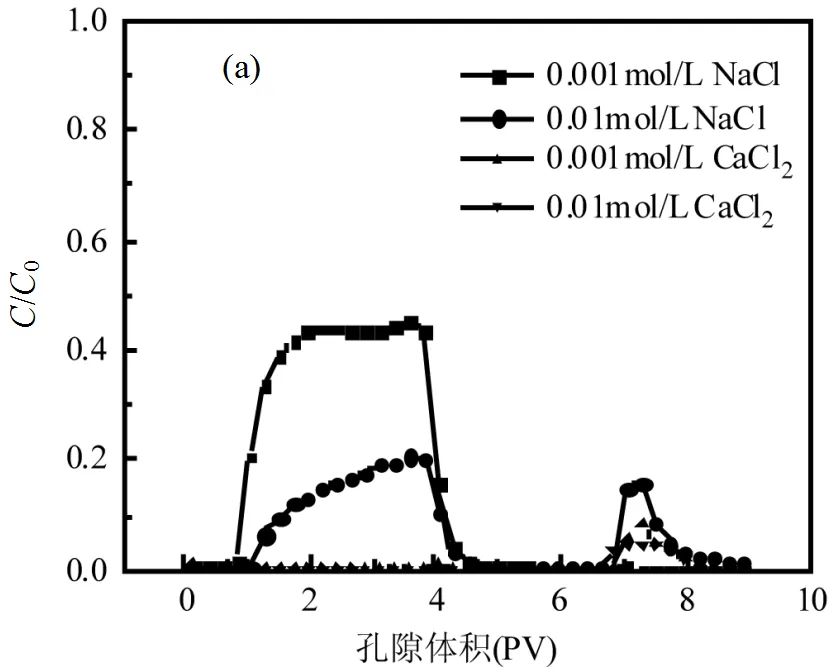
不同阳离子条件下,土壤胶体的运移特征不同,从而导致其对抗生素迁移的影响不同.如图8所示,0.001mol/L NaCl条件下,由于胶体的携带作用,促进了CIP的运移,使CIP穿透时间提前,峰值增大, 47.24%的CIP以胶体态的形式运移(表5).在0.01mol/L Na+和Ca2+存在的条件下,棕壤胶体几乎全部滞留在砂柱中,相应地吸附在棕壤胶体上的CIP随胶体一起被石英砂吸附,从而抑制了CIP的运移.由此可见,胶体的移动性是影响抗生素运移的重要因素.随着离子强度和阳离子价态的增加,由于竞争吸附和金属络合作用,CIP吸附在棕壤胶体上的数量减少(图3),抑制作用减弱,溶解态CIP出流浓度增加.除0.01mol/L Ca2+外,棕壤胶体使CIP的穿透时间提前,这可能是因为砂柱中大量胶体的滞留使溶液只能在大孔隙中流动,即尺寸排除效应(Size exclusion effect);而Ca2+浓度较高时,Ca2+对CIP运移的促进作用较强,孔径排除效应不凸显.此外,穿透曲线存在明显的拖尾现象,表明CIP从石英砂/胶体上的解吸受时间控制.在0.01mol/L NaCl下,部分CIP由于胶体的重新释放而活化,抗生素的迁移能力增强,进而增大了地下水污染的风险.
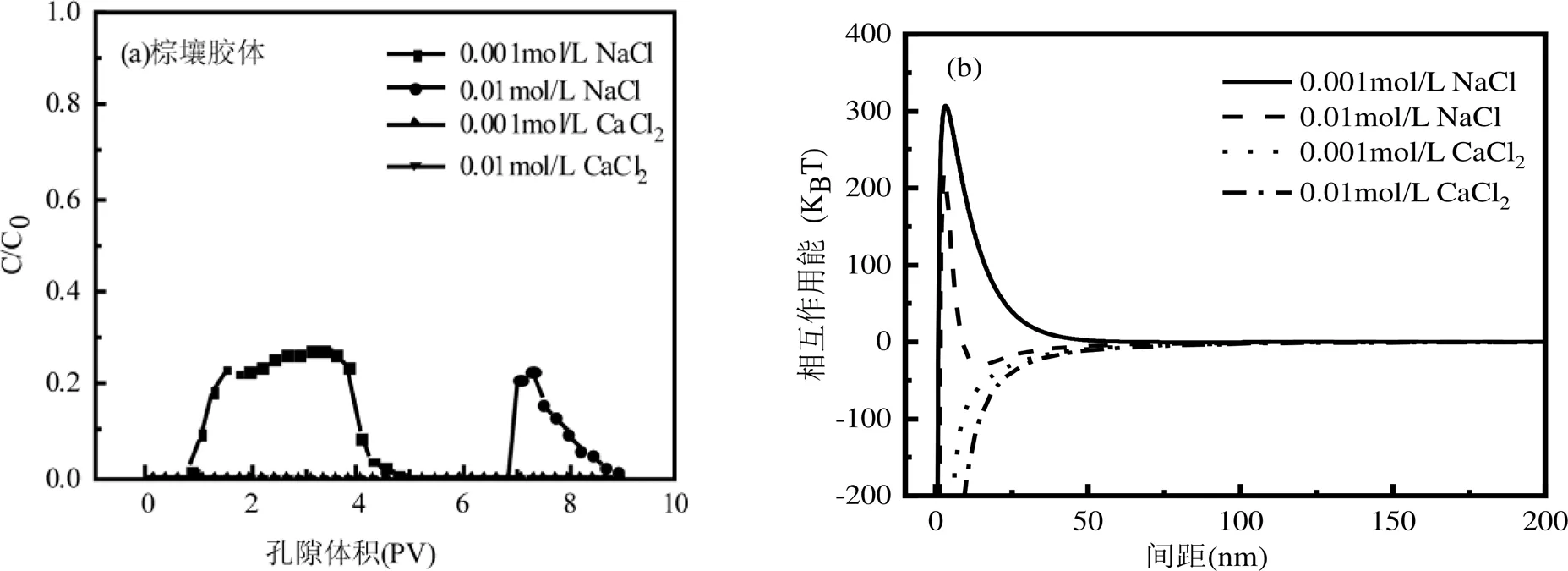
图8 不同离子强度/类型下棕壤胶体和CIP共运移的穿透曲线及DLVO能曲线

图9 不同离子强度/类型下CIP与棕壤胶体共运移的穿透曲线
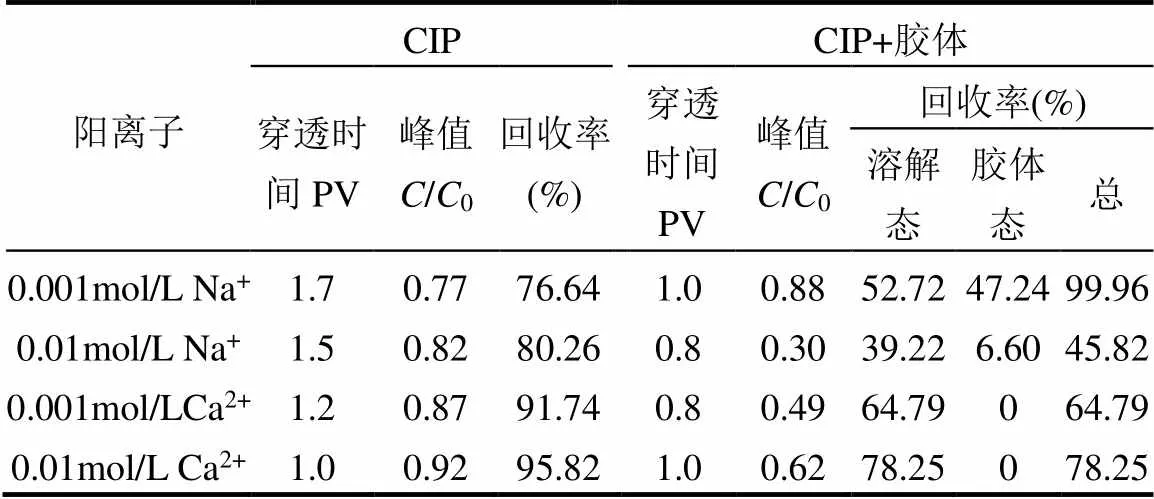
表5 不同离子强度/类型下CIP的穿透时间、峰值和回收率
3 结论
3.1 CIP在棕壤胶体上的吸附强烈依赖于pH和离子强度/类型,并受吸附剂浓度效应的影响.随pH升高,棕壤胶体对CIP的最大吸附量从341.4逐渐减小至262.5mg/g.随离子强度/阳离子价态的增加,棕壤胶体对CIP的最大吸附量从413.4逐渐减小至342.9mg/g.
3.2 酸性条件下,由于吸附CIP的棕壤胶体沉积以及滞留在石英砂表面的胶体为CIP提供了额外的吸附位点,棕壤胶体抑制了CIP的运移.中性和碱性条件下,棕壤胶体对总CIP的运移没有显著影响,但是由于移动胶体的携带作用,部分CIP以胶体态的形式迁移,增大了CIP的生态风险.在不同pH条件下, CIP均抑制了棕壤胶体的运移.
3.3 与pH相比,离子强度和类型对棕壤胶体运移的影响更为显著,继而改变了CIP的运移行为.由于移动胶体的吸附携带作用,低NaCl浓度(0.001mol/L)条件下,棕壤胶体促进了CIP的迁移;但在高NaCl浓度(0.01mol/L)和CaCl2溶液条件下,大量胶体的沉积抑制了CIP的迁移,且随着离子强度和价态的增加,由于CIP在胶体上的吸附量减少,抑制作用减弱.值得注意的是,在0.01mol/L NaCl条件下,当离子强度降低时,部分CIP随着胶体的释放而活化,但CaCl2条件下无胶体释放,这可由DLVO理论和应变效应来解释.此外,CIP的存在增加了胶体表面电荷的不均匀性,并促进了胶体的凝聚,故不同阳离子条件下CIP均抑制了棕壤胶体的运移.
[1] 邹高龙,刘志文,董洁平,等.环丙沙星在污水处理过程中的迁移转化及对污水生物处理的影响 [J]. 环境科学学报, 2019,39(2):308-317. Zou G L, Liu Z W, Dong J P, et al. 2019.The transformation of ciprofloxacin in wastewater treatment and its impact on wastewater treatment [J]. Acta Scientiae Circumstantiae, 2019,39(2):308-317.
[2] Vasudevan D, Bruland G L, Torrance B S, et al. pH-dependent ciprofloxacin sorption to soils: interaction mechanisms and soil factors influencing sorption. [J]. Geoderma. 2009,151:68-76.
[3] 张晶晶,陈 娟,王沛芳,等.中国典型湖泊四大类抗生素污染特征[J]. 中国环境科学, 2021,41(9):4271-4283. Zhang J J, Chen J, Wang P F, et al. Characteristics of four types of antibiotic pollution in typical lakes in China [J]. China Environmental Science, 2021,41(9):4271-4283.
[4] 成玉婷,吴小莲,向 垒,等.广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J]. 中国环境科学, 2017,37(3):1154-1161. Cheng Y T, Wu X L, Xiang L, et al. Distribution and risk assessment of sulfonamide antibiotics in soil from organic vegetable farms in Guangzhou [J]. China Environmental Science, 2017,37(3):1154-1161.
[5] 杨 唐,惠晓亮,王振兴,等.污水处理厂生物气溶胶抗生素抗性污染特征 [J]. 中国环境科学, 2022,42(12):5626-5632. Yang T, Hui X L, Wang Z X, et al. Pollution characteristics of bioaerosol antibiotic resistance in sewage treatment plants [J]. China Environmental Science, 2022,42(12):5626-5632.
[6] Chen H, Gao B, Yang L Y, et al. Montmorillonite enhanced ciprofloxacin transport in saturated porous media with sorbed ciprofloxacin showing antibiotic activity [J]. Journal of Contaminant Hydrology, 2015,173:1–7.
[7] Zhang H, Lu T, Zhang R, et al. Effects of clay colloids on ciprofloxacin transport in saturated quartz sand porous media under different solution chemistry conditions [J]. Ecotoxicology and Environmental Safety, 2020,199:110754.
[8] Chen H, Ma L Q, Gao B, et al. Influence of Cu and Ca cations on ciprofloxacin transport in saturated porous media [J]. Journal of Hazardous Materials, 2013,262:805–811.
[9] Cuprys A, Pulicharla R, Brar S K, et al. Fluoroquinolones metal complexation and its environmental impacts [J]. Coordination Chemistry Reviews, 2018,376:46-61.
[10] Petosa A R, Jaisi D P, Quevedo I R, et al. Aggregation and deposition of engineered nanomaterials in aquatic environments: role of physicochemical interactions [J]. Environmental Science & Technology, 2010,44 (17):6532-6549.
[11] Torkzaban S, Bradford S A, Vanderzalm J L, et al. Colloid release and clogging in porous media: Effects of solution ionic strength and flow velocity [J]. Journal of Contaminant Hydrology, 2015,181:161–171.
[12] Sasidharan S, Torkzaban S, Bradford S A, et al. Coupled effects of hydrodynamic and solution chemistry on long-term nanoparticle transport and deposition in saturated porous media [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014,457:169-179.
[13] 冯桐桐,杨 雯,刘克思,等.离子强度和腐植酸对高岭土协同磺胺二甲基嘧啶迁移的影响[J]. 农业环境科学学报, 2017,36(9):1804-1810.Feng T T, Yang W, Liu K S, et al. Effect of ionic strength and humic acid on the collaborative transport of kaolinite and sulfamethazine [J]. Journal of Agro-Environment Science, 2017,36(9):1804-1810.
[14] Yang W, Feng T, Flury M, et al. Effect of sulfamethazine on surface characteristics of biochar colloids and its implications for transport in porous media. Environmental [J]. Environmental Pollution, 2019,113482.
[15] Aguzzi C, Cerezo P, Viseras C, et al. Use of clays as drug delivery systems: Possibilities and limitations [J]. Applied Clay Science, 2007, 36:22–36.
[16] Jiang W T, Chang P H, Wang Y S, et al. Removal of ciprofloxacin from water by birnessite [J]. Journal of Hazardous Materials, 2013: 250–251,362–369.
[17] Zrnčić M, Babić S, Mutavdžić Pavlović D. Determination of thermodynamic pKa values of pharmaceuticals from five different groups using capillary electrophoresis [J]. Journal of Separation Science, 2015,38(7):1232-1239.
[18] 孟 秀.不同离子强度和pH下黏土类胶体和典型抗生素协同运移的机理研究[D]. 青岛:青岛大学, 2021. Meng X. Study on the mechanism of cooperative migration of clay-like colloid and typical antibiotics under different ionic strength and pH [D]. Qingdao: Qingdao University, 2011.
[19] 褚灵阳.纳米羟基磷灰石及其携带重金属铜在石英砂柱中迁移研究[D]. 合肥:安徽农业大学, 2011. Chu L Y. Study on the migration of nano-hydroxyapatite and its heavy metal copper in quartz sand column [D]. Hefei: Anhui Agricultural University, 2011.
[20] Cheng D, Liao P, Yuan S. Effects of ionic strength and cationic type on humic acid facilitated transport of tetracycline in porous media [J]. Chemical Engineering Journal, 2016,284:389-394.
[21] 陈燕娜,吴 鸣,程 洲,等.典型微塑料对环丙沙星在多孔介质运移的影响[J]. 农业环境科学学报, 2021,40(2):400-407. Chen Y N, Wu M, Cheng Z et al. Effects of typical microplastics on migration of ciprofloxacin in porous media [J]. Journal of Agro- Environment Science, 2021,40(2):400-407.
[22] Chen J, Xu Y, Zheng Z, et al. The mechanisms involved into the inhibitory effects of ionic liquids chemistry on adsorption performance of ciprofloxacin onto inorganic minerals [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022,648,129422.
[23] Wang C J, Li Z, Jiang W T. Adsorption of ciprofloxacin on 2:1dioctahedral clay minerals [J]. Applied Clay Science, 2011,53: 723–728.
[24] 黄翔峰,熊永娇,彭开铭,等.金属离子络合对抗生素去除特性的影响研究进展[J]. 环境化学, 2016,35(1):133-140. Huang X F, Xiong Y J, Peng K M, et al. The progress of antibiotics removal performance under the complexion effect of metal ions [J]. Environmental Chemistry, 2016,35(1):133-140.
[25] Wu Q, Li Z, Hong H, et al. Adsorption and intercalation of ciprofloxacin on montmorillonite [J]. Applied Clay Science, 2010, 50:204–211.
[26] Riaz L, Mahmood T, Khalid A, et al. Fluoroquinolones (FQs) in the environment: a review on their abundance, sorption and toxicity in soil. [J]. Chemosphere, 2018,191:704–720.
[27] 赵凌曦,侯万国.固-液界面吸附中的固体浓度效应 [C]//中国化学会第十四届胶体与界面化学会议论文摘要集-第5分会:胶体与界面化学中的理论问题, 2013:21-22.Zhao L X, Hou W G. Effect of solid concentration on solid-liquid interface adsorption [C]//Abstracts of the 14th Colloidal and Interfacial Chemistry Conference of the Chinese Chemical Society - Session 5: Theoretical problems in colloid and interfacial chemistry [C]. 2013,21-22.
[28] Chen H, Gao B, Li H, et al. Effects of pH and ionic strength on sulfamethoxazole and ciprofloxacin transport in saturated porous media [J]. Journal of Contaminant Hydrology, 2011,126:29-36.
[29] Peng X, Lam F L Y, Wang Y, et al. Adsorption behavior and mechanisms of Ciprofloxacin from aqueous solution by ordered mesoporous carbon and bamboo-based carbon [J]. Journal of Colloid and Interface Science, 2015,460:349–360.
[30] Li Z, Hong H, Liao L, et al. A mechanistic study of ciprofloxacin removal by kaolinite [J]. Colloids and Surfaces B: Biointerfaces, 2011, 88:339-344.
[31] Dong S, Gao B, Sun Y, et al. Transport of sulfacetamide and levofloxacin in granular porous media under various conditions: Experimental observations and model simulations [J]. Science of The Total Environment, 2016,573:1630-1637.
[32] 李 兵,李 航,朱华玲,等.不同pH条件下黄壤胶体凝聚的动态光散射研究[J]. 土壤学报, 2013,50(1):89-95. Li B, Li H, Zhu H L, et al. Study on dynamic light scattering of yellow soil colloid condensation under different pH conditions [J]. Acta pedologica sinica, 2013,50(1):89-95.
[33] Bradford S A, Yates S R, Bettahar M, et al. Physical factors affecting the transport and fate of colloids in saturated porous media [J]. Water Resources Research, 2002,38(12):61-63.
[34] Shen C, Wu L, Zhang S, et al. Heteroaggregation of microparticles with nanoparticles changes the chemical reversibility of the microparticles’ attachment to planar surfaces [J]. Journal of Colloid and Interface Science, 2014,421:103-113.
[35] Bradford S A, Torkzaban S. Colloid interaction energies for physically and chemically heterogeneous porous media [J]. Langmuir, 2013,29: 3668-3676.
[36] Sibley S D, Pedersen J A. Interaction of the macrolide antimicrobial clarithromycin with dissolved humic acid [J]. Environmental Science & Technology, 2008,42(2):422–428.
[37] Genç N, Dogan E C. Adsorption kinetics of the antibiotic ciprofloxacin on bentonite, activated carbon, zeolite, and pumice [J]. Desalination and Water Treatment, 2015,53:785–793.
[38] Celis R, Adelino M A, Hermosín M C, et al. Montmorillonite–chitosan bionanocomposites as adsorbents of the herbicide clopyralid in aqueous solution and soil water suspensions [J]. Journal of Hazardous Materials, 2012:209-210,67-76.
[39] 孙凯璇,向 令,孙占学,等.典型抗生素在多孔介质中迁移特性的对比研究[J]. 环境科学学报, 2020,40(5):1786-1797. Sun K X, Xiang L, Sun Z X, et al. Comparing the transport behavior of typical sulfonamides and fluoroquinolones in granular porous media [J]. Acta Scientiae Circumstantiae, 2020,40(5):1786-1797.
[40] Lv X Y, Sun Y Y, Ji R, et al. Physicochemical factors controlling the retention and transport of perfluorooctanoic acid (PFOA) in saturated sand and limestone porous media [J]. Water Research, 2018,141:251–258.
[41] Xie W H, Shiu W Y, Mackay D. A review of the effect of salts on the sol- ubility of organic compounds in seawater [J]. Marine Environmental Research, 1997,44:429-444.
[42] 胡俊栋,沈亚婷,王学军.离子强度、pH对土壤胶体释放、分配沉积行为的影响 [J]. 生态环境学报, 2009,18(2):629-637. Hu J D, Shen Y T, Wang X J. Effects of ionic strength and pH on soil colloid release, distribution and deposition behavior [J]. Ecology and Environment, 2009,18(2):629-637.
[43] 吕雪艳,姚 遥,孙媛媛,等.离子强度及pH对不同类型土壤中胶体释放的影响[J]. 农业环境科学学报, 2014,33(7):1358-1365. Lv X Y, Yao Y, Sun Y Y, et al. Effects of ionic strength and pH on colloidal release in different soil types [J]. Journal of Agro- Environment Science, 2014,33(7):1358-1365.
[44] Fang J, Xu M J, Wang D J, et al. Modeling the transport of TiO2nanoparticle aggregates in saturated and unsaturated granular media: effects of ionic strength and pH [J]. Water Research, 2013,47:1399-1408.
Effect of pH and cations on co-transport of ciprofloxacin and soil colloids.
LIU Xiao-wen1, SHAO Ming-yan2, XU Shao-hui1, LIN Qing1*
(1.College of Environmental Science and Engineering, Qingdao University, Qingdao 266071, China;2.Qingdao Geo-Engineering Surveying Institute (Qingdao Geological Exploration Development Bureau), Qingdao 266101, China)., 2023,43(9):4768~4779
Soil colloids play an important role in the transport and transformation of antibiotics in underground environments, but the transport forms of antibiotics in dissolved and colloidal states have not been fully studied. The co-transport characteristics of ciprofloxacin (CIP) andbrown soil colloids under different pH and cationic conditions were studied by static adsorption and column experiments. The results showed that CIP transport was inhibited by brown soil colloids at pH 4.0. At pH 7.0 and 9.0, soil colloids had no significant effect on CIP transport, but some CIP was transported in the colloidal form. Compared with pH, cations (Na+/Ca2+) had more significant effects on the co-transport of CIP and soil colloids. Except for low NaCl concentration (0.001mol/L), CIP transport was inhibited by large amounts of deposited colloids on the quartz sand. With the increase of ionic strength and cationic valence, the inhibition effect weakened due to the decreased adsorption capacity of CIP on brown soil colloids. Under 0.01mol/L NaCl, CIP was activated with the release of soil colloids as the ionic strength in bulk solution decreased, but this phenomenon did not occur under CaCl2, which can be explained by the DLVO theory and straining effect. In addition, CIP inhibited the transport of brown soil colloids under all tested conditions due to the increased surface charge heterogeneity and aggregation of colloids. Our findings demonstrated that the mobility of soil colloids and their adsorption capacity jointly determined the influence of colloids on CIP transport, and the antibiotic transport form not just the total amount should be carefully considered as assessing the potential environmental risks of antibiotics.
colloid;ciprofloxacin;co-transport;quartz sand;adsorption
X53
A
1000-6923(2023)09-4768-12
刘晓雯(1996-),女,山东潍坊人,青岛大学硕士研究生,主要从事土壤/地下水污染物多介质界面过程及调控的研究.发表论文1篇. 2020025866@qolu.edu.cn.
刘晓雯,邵明艳,徐绍辉,等.pH值和阳离子对环丙沙星与土壤胶体共运移的影响 [J]. 中国环境科学, 2023,43(9):4768-4779.
Liu X W, Shao M Y, Xu S H, et al. Effect of pH and cations on co-transport of ciprofloxacin and soil colloids [J]. China Environmental Science, 2023,43(9): 4768-4779.
2023-02-07
国家自然科学基金资助项目(41807010)
* 责任作者, 副教授, qdulinqing@qdu.edu.cn

