糖尿病心肌病发病机制及治疗研究进展
陈艳艳,周洁,卢作维,李梦颖,马溪悦,李晓苗*
1空军军医大学第一附属医院内分泌科,陕西西安 710033;2西安医学院医学影像学系,陕西西安 710021
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一类排除高血压、冠心病、瓣膜病、先天性心脏病等其他心血管疾病后的特异性心肌病[1-2]。通常,糖尿病发展为DCM是一个漫长而又隐匿的过程,一般从初始的亚临床阶段逐渐进展为伴有临床症状的心脏功能失常,最终发展为需要干预的难治性心力衰竭。多数研究证实,DCM的发生发展与糖脂代谢紊乱、心脏胰岛素信号受损、晚期糖基化终产物积累、炎症反应、亚细胞成分异常和冠状动脉微循环受阻等病理过程密切相关,但具体的分子机制仍需进一步阐明[3-5]。本文对DCM 的病理生理机制、临床表现及治疗前景的研究进展进行综述,以期加强对DCM的认识,为临床早期防治提供参考。
1 DCM的概念与流行病学
1972 年,Rubler 等[6]首次报道了4 例死于慢性心力衰竭的糖尿病患者。这些患者生前并无明显的冠状动脉疾病、高血压或其他已知的诱发心力衰竭的危险因素,但心脏病理检查却发现这4 例患者的心肌存在结构异常,呈弥漫性纤维化。随后,1974 年Hamby 等[7]首次提出了DCM 的概念:在糖尿病患者中发生的以心肌结构和功能重构为特征的特异性心肌病,其发生不依赖于冠状动脉病变、高血压、瓣膜病或其他心脏疾病,以心肌肥大、纤维化和心肌微血管病变等病理改变为主,最终发展为慢性心力衰竭。临床上,DCM往往与冠状动脉疾病、高血压等共同存在,单独评估DCM对整体心室功能不全的影响比较困难,因此,最近有研究者提出DCM应定义为不能完全由其他心血管或非心血管原因解释,而可能由糖尿病引起的心脏异常。众所周知,糖尿病作为人类的健康杀手,在全球的患病率增长迅速。国际糖尿病联盟的数据显示,截止到2017年,全球糖尿病患者约4.25 亿,预计到2045 年将高达6.29亿[8]。心血管并发症是糖尿病患者病死率较高的主要原因,占1 型糖尿病(type 1 diabetes mellitus,T1DM)患者死亡的44%,占2 型糖尿病(type 2 diabetes mellitus, T2DM) 患 者 死 亡 的 52%[9]。Framingham 心脏研究表明,19%的心力衰竭患者患有T2DM,而T2DM患者心力衰竭的风险增加了2~8倍[10]。糖化血红蛋白水平每增加1%,T1DM 和T2DM 患者心力衰竭发生风险分别增加30%和8%,且与传统的心血管危险因素无关[11]。相反,UKPDS研究显示,糖化血红蛋白水平每下降1%,心血管死亡风险降低16%,提示糖尿病是心力衰竭风险增加的独立危险因素[12]。
2 病理生理机制
研究表明,胰岛素缺乏和(或)胰岛素抵抗所致的高血糖是DCM 心功能受损级联反应的起点[3,13]。在高糖状态下,多种代谢途径被激活并相互影响,导致心肌纤维化及肥大,心肌细胞凋亡,冠状动脉微循环灌注减少,进而演变为舒缩功能障碍,最终发展为糖尿病性心力衰竭。其中,T1DM 和T2DM在DCM 的触发方面存在一定的病理生理差异:T1DM 的触发因素主要为高血糖,与肌质网钙吸收延迟相关,导致左室收缩性和主动舒张功能受损,因此在T1DM患者中收缩功能障碍的症状更为典型;T2DM 的触发因素主要为高胰岛素血症和胰岛素抵抗,临床表现与心肌纤维变性、左室重构相关,导致室壁硬度增加,顺应性降低,在疾病早期诱发舒张性心肌功能障碍[14]。此外,胰岛素抵抗和T2DM的发展可使心肌细胞对游离脂肪酸(free fatty acid,FFA)的摄取增加,过量摄入的脂肪酸反过来可加重线粒体脂肪酸β-氧化损害,最终造成T2DM 患者心脏中线粒体功能障碍和脂毒性代谢物的积累更严重。尽管T1DM 和T2DM 的病因不同,但高血糖和血脂异常等系统性代谢紊乱在两种疾病的心力衰竭过程中均发挥关键作用。因此,控制血糖被认为是预防和治疗DCM最重要的治疗手段。然而,最近多项研究表明,强化血糖控制并不能改善糖尿病患者的总体心血管预后。Zhan 等[15]发现,严格的血糖控制不足以降低糖尿病患者的心力衰竭发生风险,提示糖尿病患者在强化血糖控制后仍容易发生心血管并发症,表明短暂性高血糖应激的影响可持续存在,即存在高血糖记忆现象,这为研究DCM的治疗策略提供了新的理论依据。
2.1 胰岛素抵抗 细胞内的胰岛素信号主要通过两个途径发挥作用。第一条途径涉及胰岛素受体底物1(insulin receptor substrate 1,IRS-1),它作用于磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(Akt)信号转导途径的上游,引发主要的代谢反应。如胰岛素受体自身磷酸化引起的IRS-1蛋白酪氨酸磷酸化,可引起下游PI3K的磷酸化并启动激酶级联反应,进一步激活Akt信号通路。Akt 的激活可使心肌细胞葡萄糖转运蛋白4(glucose transporter 4,GLUT4)转位至细胞膜,增加葡萄糖的摄取[10,16]。PI3K-Akt 也可激活内皮一氧化氮合酶(NOS)使NO的生成增加,从而介导冠状动脉血管扩张、心肌柔韧性和能量平衡的调节。第二条途径是通过SHC 基因激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)介导的信号转导反应[17],这一通路有助于细胞生长和心肌重构过程,可导致心肌肥厚、纤维化和细胞凋亡。胰岛素抵抗主要表现为胰岛素信号通路的代谢和生长效应失衡,以第二条途径Ras-MAPK信号通路发挥主导作用,可造成心肌肥厚、纤维化;同时,高血糖可通过抑制细胞内IRS-1蛋白表达和酪氨酸磷酸化,抑制胰岛素信号传导过程,进而引起胰岛素抵抗[10](图1)。此外,高血糖所致的线粒体功能障碍、内质网应激和氧化应激、Ca2+处理异常等也可加剧胰岛素信号受损[18]。总之,细胞内胰岛素信号通路的动态失衡可导致心肌细胞外基质重构,表现为明显的心室肌肥厚、纤维化;同时胰岛素抵抗可使心肌利用葡萄糖的能力下降,出现能量供不应求,最终演变为心室壁僵硬和DCM。

图1 糖尿病心脏胰岛素抵抗信号通路图(引自Nat Rev Endocrinol, 2016, 12(3): 144-533[10])Fig.1 Signaling pathway of insulin resistance in diabetic cardiomyopathy (cited from Nat Rev Endocrinol, 2016, 12(3): 144-533[10])
2.2 代谢底物改变 心脏是人体内对新陈代谢需求最大的器官。为了满足心肌需要,ATP 由各种底物的线粒体快速氧化产生,其中包括脂肪酸(60%~70%)、葡萄糖(20%)和乳酸(10%)[11]。心脏可同时利用脂肪酸和葡萄糖作为能量底物来提高代谢的灵活性。脂肪酸和葡萄糖的摄取分别由CD36 和GLUT4介导,在生理条件下,胰岛素与心肌细胞的胰岛素受体结合,可促进GLUT4 和CD36 向心肌细胞膜转运,从而为心肌提供能量。在高糖状态下,心肌细胞中胰岛素信号受损,GLUT4 内化并返回细胞内,导致葡萄糖的摄入减少,而CD36 优先定位于肌膜,可导致FFA 摄入增加[19],最终造成脂质积累并发生脂毒性。
GLUT4 和CD36 的相互易位可影响代谢平衡。全身和心脏胰岛素抵抗可使葡萄糖摄取减少,FFA氧化增加,细胞代谢底物发生转移,从而导致心脏工作效率降低。同时,心脏组织中脂肪酸过度积累及其相关的脂毒性可进一步损害胰岛素信号转导,加重代谢紊乱和心脏功能障碍,最终使心肌形态和结构发生改变。最近,有动物研究结果显示,细胞内CD36 的滞留依赖于液泡H+-ATP 酶的正常功能,过量的脂质可通过抑制该酶活性触发CD36易位,提示液泡H+-ATP酶是心脏代谢底物脂质和葡萄糖转换的关键调节因子,并可能成为治疗脂毒性引起的DCM的潜在靶点[20]。
2.3 晚期糖基化终产物(AGEs) 葡萄糖利用减少和糖异生增加均与DCM的发生、发展密切相关。慢性高血糖产生的活性氧(ROS)除造成分子直接损伤外,还可激活细胞损伤的应激敏感通路[21]导致DNA 损伤,抑制甘油醛3-磷酸脱氢酶(G3PDH)活性,形成AGEs[22]。AGEs的增加不仅可导致全身糖毒性和血管紧张素Ⅱ(Ang Ⅱ)积累,还可使ROS 和活性氮生成增加、NO的生物利用度降低,最终导致心肌细胞肥大。据报道,氧化应激与AGEs 之间存在相关性[23]。有研究发现,分别上调Nrf2[24]、Sirtuin1 介导[25]的抗氧化信号通路,以及抑制核因子-κB(NF-κB)介导的促炎信号通路[26]可有效防止DCM 的氧化应激损伤。因此,未来应关注DCM发病机制相关的主要信号通路,有望为进一步的研究和治疗提供新思路。
2.4 炎症反应 炎症反应作为经典的病理机制同样在DCM演变过程中发挥着重要作用。大多数研究证实,炎症细胞分泌的细胞因子、趋化因子和外泌体可促进心肌细胞肥大及细胞外基质重塑。在高血糖环境中,心肌炎症反应被激活,促炎因子表达上调,可使促炎巨噬细胞和淋巴细胞在心肌间质中积累及浸润。大量的炎症细胞分泌肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、IL-1β、γ干扰素(IFN-γ)和转化生长因子-β(TGF-β)等细胞因子,可加重心脏损伤。此外,机体免疫系统与DCM 的发生发展密切相关。如M1型巨噬细胞分泌炎症细胞因子,可导致全身和心脏胰岛素信号减少;M2 型巨噬细胞分泌IL-10 可抑制心肌肥大和纤维化,从而发挥抗炎作用。当机体处于高血糖胰岛素抵抗时,巨噬细胞的促炎表型和抗炎表型失调,促进过度炎症反应和心肌损伤,最终造成心脏不良重塑[27]。
最近,有学者在动物实验中意外发现,间充质干细胞灌注可缓解DCM大鼠的心肌损伤,其潜在机制为间充质干细胞通过环氧合酶2(COX2)-前列腺素E2(PGE2)信号通路增强M2型巨噬细胞极化,从而抑制心肌炎症反应,该结果为治疗DCM的靶向药物开发提供了新的策略[28]。
2.5 亚细胞成分异常 细胞内线粒体功能障碍、内质网应激和钙处理失衡等过程相互影响,共同参与了DCM的发生发展。内质网是一个重要的翻译后修饰位点,负责细胞中蛋白质的正确折叠。在高糖状态下,大量ROS 通过蛋白质翻译及折叠不当、DNA表达异常等造成细胞损伤。内质网应激还可通过提高甾醇调节元件结合蛋白的活性来增加脂质的合成,加剧心脏脂毒性。此外,内质网应激可造成细胞膜不稳定,促使肌质网释放Ca2+进入细胞质,并降低肌质网钙泵的活性,使细胞质中Ca2+潴留,心肌细胞舒张弛缓。为了应对ROS 和内质网功能的失调,线粒体可通过增加外膜通透性来诱导细胞凋亡,导致溶质和水分迅速涌入线粒体基质,质子梯度崩溃,ATP 合成中断,使线粒体过量摄取Ca2+而致Ca2+超载,最终导致线粒体功能彻底溃塌[29]。甚至有研究发现,在糖尿病前期阶段,Ca2+处理异常和线粒体功能受损就已经发生[30]。总之,线粒体功能障碍、内质网应激和钙处理失衡三者相互作用,严重损害心肌功能,临床主要表现为早期心室舒张功能障碍。
近年来,表观遗传学尤其是小分子核糖核酸(miRNA)的改变也日益受到关注。目前,在DCM心肌组织中已发现多个miRNA 表达水平异常,其中6种miRNAs(miR-34b、miR-34c、miR-199b、miR-210、miR-223和miR-320)可能参与转录和转录后调节,从而影响心脏结构及功能。Li等[31]在T2DM db/db小鼠中确定miR-320 是与DCM 表型相关的关键miRNA,富集在心肌细胞核中的miR-320 可增强CD36 转录,导致心脏脂肪毒性。该研究进一步通过重组腺相关病毒载体抑制miR-320的表达,发现可明显改善db/db小鼠的心脏功能,减少心肌细胞凋亡。此外,有临床前研究发现,糖尿病心力衰竭人群心脏及循环中miR-320 表达上调[32]。以上研究均提示miR-320 有望成为治疗DCM的有效靶点。
2.6 冠状动脉微循环障碍 DCM 患者存在冠状动脉微循环受损。内皮功能障碍在冠状动脉微循环障碍中占主导地位,由并发症相关的亚临床炎症引发,或直接由高血糖、脂肪毒性和微血管稀疏所致,可使心脏发生重构。在存在胰岛素抵抗和高胰岛素血症的情况下,NO的生成和利用减少,降低了蛋白激酶G 的活性,导致血管舒张效应减弱[33]。同时,血管平滑肌细胞内Ca2+敏感性增强可使冠状动脉收缩,冠脉血流减少。有研究发现,高胰岛素水平也与大、小血管的僵硬度有关,不仅可促进血管平滑肌细胞向成骨细胞样表型分化,造成血管硬度增加,还可通过增加碱性磷酸酶活性、骨钙蛋白表达及血管平滑肌细胞中矿化结节的形成而使血管顺应性降低[10]。因此,血管内皮细胞和血管平滑肌功能受损在DCM患者的冠状动脉微循环障碍中发挥着重要作用。此外,应用心脏MRI 评估心脏血流灌注的研究显示,除外心外膜大血管狭窄病变后,T2DM 患者心肌灌注储备指数明显低于正常对照组[34],提示T2DM 患者存在冠脉微循环功能障碍,且心脏血流灌注减少与心肺运动测试中耗氧量峰值较低有关[35]。这表明,T2DM冠状动脉微血管功能障碍可能导致心肌缺氧,加重损害心肌代谢活动。另一项应用正电子发射计算机断层显像(PET/CT)进行的研究同样显示,在校正年龄、性别、吸烟、血压等因素后,糖尿病患者冠脉血流储备仍明显低于非糖尿病患者,且其降低程度与24 h 尿蛋白量呈负相关,提示冠脉微循环损伤进程可能与微血管病变一致[36]。此外,炎性因子IL-6 和TNF-α 介导的血管舒缩性痉挛也可诱导冠状动脉微血管功能障碍[37],进一步加剧DCM 的疾病进展。
目前,关于DCM的认识主要来源于对左心室的评估,而作为一种全身性疾病,其右心室同样受累。最新证据表明,与左心室重构不同,右心室损伤是由于右心室和肺血管同时发生变化而导致心脏早发性离心性肥大和舒缩功能障碍[38]。由于左心室与右心室的根本差异,以及人们对右心室进行直接研究的途径和能力有限,导致右心室不良重塑并最终发展为心力衰竭的发病机制尚不完全清楚。目前已有的研究结果提示,肺动脉高压及心室肌细胞能量代谢紊乱似乎在右心室损伤中起主要作用,但其具体病理学机制仍需进一步研究[39]。
3 临床表现与治疗前景
3.1 临床表现 DCM 发病隐匿,早期无明显临床症状,随着病情的进展,主要表现为不典型的胸痛、劳累性呼吸困难等,并伴有心肌结构和舒缩功能的实质性改变。如前所述,在T2DM 相关的DCM 中,冠状动脉微血管炎症、心肌细胞和内皮细胞旁分泌作用所介导的向心性左室重构和肥厚增加了心室硬度,并可导致舒张功能障碍。临床上,伴有保留左室射血分数(left ventricular ejection fraction,LVEF)心力衰竭的T2DM患者症状通常出现较早,但很轻微,相应的体征早期可通过敏感、无创的舒张功能障碍检测(如组织多普勒成像)而被发现。相比之下,T1DM相关的DCM以心肌细胞丢失、左室重构和心肌胶原沉积为特征,早期收缩功能障碍的症状较为典型。然而,目前对于DCM心室功能改变的认识仍存在争议。既往国内外大多数学者认为,左室舒张功能障碍是DCM 病程中最早出现的功能改变[40-41],且是一个重要的临床预后因子。一些新近的研究利用新型斑点追踪超声技术(speckle-tracking echocardiography,STE)发现,在糖尿病患者还未出现明显的临床症状时,心脏除舒张功能受损外,也同时存在收缩功能受损[42],甚至早于舒张功能受损[43-44]。如图2为我院诊治的1例LVEF正常的T2DM患者,但STE 测量显示左心室纵向收缩功能异常,表明常规心脏超声评估的LVEF在早期评价亚临床左心室收缩功能方面具有一定的局限性。类似地,Ernande 等[45]利用STE 发现,具有正常舒张功能且LVEF≥55%的糖尿病患者存在左心室纵向收缩功能障碍,并首次提出舒张功能障碍不应被认为是DCM临床表现的首个标志,更新了人们对DCM 的传统认识。目前,心血管磁共振成像(CMR)已成为描述心肌结构和功能改变的无创“金标准”[46]。有研究者利用CMR 测量心肌造影前和造影后纵向弛豫时间(T1),发现心肌细胞外基质增加是糖尿病患者病死率增高的独立预测因子,并可能作为一种新的无创生物标志物来评估DCM的严重程度[47]。因此,早期关注无症状DCM患者的心肌功能改变,对亚临床阶段延缓和预防DCM发生心血管事件意义重大。
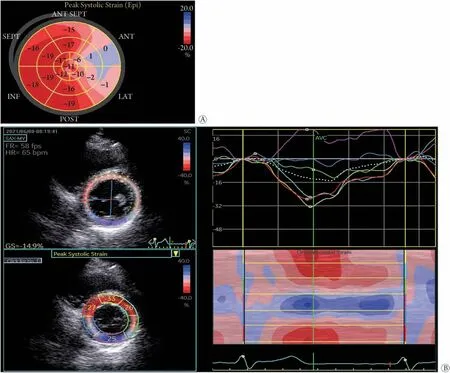
图2 T2DM患者左室二维心肌应变Fig.2 Two-dimensional left ventricular myocardial strain in patients with T2DM
3.2 治疗前景 糖尿病心肌损伤的发生机制、临床诊断及干预一直是基础研究和临床治疗的重点和难点,因而迫切需要深入探讨在糖尿病状态下心肌内在的病理生理学变化机制,尽早发现并寻找新的干预手段,为患者带来临床获益。其中,早期筛查和诊断极其重要。病理组织活检虽具有直接诊断价值,但由于操作具有侵入性和有创性,其临床适用范围和患者接受度受到极大限制。近年来影像学技术的迅速发展有助于更好地了解心脏的病理生理学变化,以及心脏功能的重塑和改变。对于那些既往无明显症状的糖尿病患者,通过超声斑点追踪技术测量的心肌纵向应变被证实是一个可早期发现DCM 的指标[42]。此外,心肌营养因子1、转化生长因子-β 家族成员(激活蛋白a)、心脏脂肪酸结合蛋白(HFABP)、Ⅰ型前胶原N 端前肽(PINP)和基质金属蛋白酶-7(MMP-7)、胰岛素样生长因子结合蛋白7(IGFBP-7)等也被作为早期识别DCM 的有效循环生物标志物[33],在DCM等多种心血管疾病的诊断和预后方面具有潜在作用。
目前尚未就预防或治疗与糖尿病相关心血管并发症的最佳管理策略达成共识。DCM 发病机制复杂,目前仍无特异性的治疗方法。通常用于治疗糖尿病的药物疗法可能对DCM具有重要价值。有临床试验证实,新型抗糖尿病药物如钠-葡萄糖共转运体-2(sodium glucose co-transporter 2,SGLT2)抑制剂、胰高血糖素样肽-1(glucagon-like peptide 1,GLP1)受体激动剂等可通过强化血糖控制来增加心血管获益和减缓糖尿病肾病等微血管并发症的进展,但对大血管并发症的影响仍存在争议[48]。最新的一项荟萃分析结果显示,SGLT2 抑制剂对LVEF 降低或LVEF 保留的心力衰竭患者均具有非常确切的疗效,且与基线射血分数、血糖状况或基础治疗无关,肯定了SGLT2 抑制剂应被积极应用于DCM 治疗的策略[49]。同样,GLP1受体激动剂可通过增加胰岛素分泌、降低胰高血糖素和体重来减少主要不良心血管事件,其机制包括减轻心肌缺血/再灌注损伤,改善心室重构,以及增加NO 来改善内皮功能[50]。在临床试验中,GLP1类似物如利拉鲁肽、司美格鲁肽等均已被证实具有心血管保护作用,可能有利于DCM的一级预防[51]。最近的研究发现,间充质干细胞灌注可减缓心肌损伤并改善心功能,因同时具有抗糖尿病特性及心脏保护功能而成为DCM 治疗研究的热点[52]。但是,到目前为止,仍未见该方法用于评估DCM治疗效果的临床试验。然而,也有研究将缺血性和非缺血性心肌病合并糖尿病作为共病,采用经心内膜注射移植骨髓间充质干细胞来研究其对心肌病的影响,结果表明,非缺血性心肌病患者的心功能优先得到改善[53],提示该方法在DCM的治疗中具有广泛的应用前景。此外,褪黑素作为一种调节昼夜节律的激素,在DCM 治疗中的有益作用已经得到证实,动物实验结果表明,适当补充外源性褪黑素或刺激内源性褪黑素的产生有一定的临床价值,并被认为是DCM的一种潜在治疗方法[54]。另外,以细胞为基础的免疫应答和异常基因的纠正对延缓疾病的发生发展也具有重要意义,如利用RNA测序技术综合分析发现,精胺可通过调控免疫系统异常基因转录及相关信号转导而对DCM产生保护作用[55];应用以血管生成素1 为靶点的新基因疗法,可有效预防DCM引起的早期舒张功能障碍[56]。因此,未来基因组学和代谢组学可能成为DCM早期诊疗的潜在手段。
4 总结与展望
综上所述,DCM 作为一种单独的临床病理类型,其确切病理生理机制既复杂又具有系统性。因此,研究其发病机制并开发靶向药物对预防和延缓疾病的发展具有重要意义。尽管许多研究在病理生理机制方面取得了重大进展,但预防和治疗DCM的有效策略仍难以实现。基于糖尿病治疗的新型降糖药物包括SGLT-2 抑制剂、GLP1 受体激动剂等均已被证实具有心血管保护作用,在DCM的治疗中具有潜在价值。遗传学和分子生物学的发展有利于DCM生物标志物的发现和新药的研发。然而,为了更好地制定DCM患者的个体化医疗方案,促进对该疾病的早期筛查、诊断和治疗,未来仍需要进行更深入的研究以达成共识。

