槲皮素/β-环糊精包合物的制备及水溶性研究
赵春梅,仝照岭,王保玉,李玉玲,张玲丽
(郑州工程技术学院 化工食品学院,河南 郑州 450044)
槲皮素具有抗菌、抗炎、抗癌、抗氧化、抗风湿和神经保护等多种特性[1-7],具有优异的抗氧化性,且广泛存在于各种植物中,常用做食品添加剂,不仅能延长食品的货架期,还能改善液态食品的稳定性[8]。槲皮素与其他抗氧化剂联合使用,可表现出更高的抗氧化活性[9]。槲皮素在水中的溶解度很小,且稳定性差,通过引入亲水基团,对槲皮素本身的分子结构进行修饰,可改善其水溶性[9],但制备方法复杂,成本较高,不利于推广应用。
环糊精具有内部疏水、外部亲水的空腔结构,常作为主体分子与疏水性的客体分子结合,用于化学催化、药物缓/控释、分析检测、手性分离、食品、污染物吸附、分子识别等领域[10-12]。由于环糊精表面有大量的羟基,因此具有较好的自组装[13]和吸附性能[14]。以环糊精为主体、槲皮素为客体制备槲皮素/环糊精包合物,有望改善槲皮素的水溶性,提高其生物利用度。
1 材料与方法
1.1 材料
槲皮素、β-环糊精、无水乙醇,均为分析纯。
1.2 主要仪器与设备
TG16台式离心机:上海卢湘仪离心机仪器有限公司;TU-1810紫外-可见吸收光谱仪:北京普析通用仪器有限责任公司;D8 ADVANCE X射线衍射仪:德国Bruker公司;Avanced Ⅲ核磁共振谱仪(400 MHz):德国Bruker公司;SDT Q600同步热分析仪:美国TA公司;769YP-15A红外专用压片机:天津科器高新技术公司;AlphaⅡ傅里叶变换红外光谱仪:德国Bruker公司。
1.3 实验方法
1.3.1 槲皮素/β-环糊精包合物的制备
准确称取一定量的槲皮素于三颈烧瓶中,加入无水乙醇10 mL,搅拌、加热,使固体溶解完全。称取一定量的β-环糊精于烧杯中,加入60%的乙醇50 mL,加热搅拌,使其完全溶解。将该溶液加入上述槲皮素溶液中,继续搅拌一定时间。反应结束后,用旋转蒸发仪除去溶剂,得到浅黄色固体。用无水乙醇洗涤、离心(7000 r/min,15 min)多次,直至上清液变为无色。将固体放入50℃的烘箱中干燥3 h,即可得到槲皮素/β-环糊精包合物。将上清液合并,用于紫外-可见吸收光谱测定。
1.3.2 表征方法
核磁共振氢谱测试:分别取适量的槲皮素、β-环糊精和槲皮素/β-环糊精包合物,溶解于氘代二甲基亚砜中,用400 MHz的核磁共振谱仪测试,得到槲皮素、β-环糊精和槲皮素/β-环糊精包合物的核磁共振氢谱。
X-射线衍射测试:分别取适量的槲皮素、β-环糊精、槲皮素与β-环糊精的物理混合物和槲皮素/β-环糊精包合物,用X射线衍射仪在5~90进行扫描,得到槲皮素、β-环糊精和槲皮素/β-环糊精包合物的X-射线衍射光谱图。
红外光谱测试:分别取适量的槲皮素、β-环糊精、槲皮素与β-环糊精的物理混合物和槲皮素/β-环糊精包合物,加入适量的KBr,研细,再用红外专用压片机压片,用傅里叶变换红外光谱仪在400~4000 cm-1范围内进行扫描,得到槲皮素、β-环糊精和槲皮素/β-环糊精包合物的红外光谱图。
1.3.3 标准曲线的绘制
用分析天平称取槲皮素0.0210 g于10 mL容量瓶中,加入无水乙醇溶解、定容,得到浓度为2.1 mg/mL的母液。用移液管吸取1 mL母液至50 mL的容量瓶中,用无水乙醇定容,即得到浓度为42 μg/mL的槲皮素溶液。再分别取1.5,2.5,3.5,4,4.5 mL浓度为42 μg/mL的槲皮素溶液于10 mL容量瓶中,用无水乙醇定容。得到浓度分别为6.3,10.5,14.7,16.8,18.9 μg/mL的标准溶液。用紫外-可见吸收光谱仪在200~600 nm范围内对以上5个样品进行扫描,得到紫外-可见吸收光谱。以槲皮素的浓度为横坐标、256 nm处的吸光度为纵坐标作图,并进行线性拟合,得到回归方程。
1.3.4 包合率的计算
包合物中槲皮素的包合率Y=[1-(c·V)/(m0×106)]×100%。其中c为根据回归方程计算的上清液中槲皮素的浓度,μg/mL;V为上清液的体积,mL;m0为实验时投入的槲皮素的质量,g。
1.3.5 单因素实验
投料比对包合率的影响:保持其他条件不变,β-环糊精与槲皮素的摩尔比分别为11,21和31,按照1.3.1的方法制备包合物,计算包合率。
反应时间对包合率的影响:保持其他条件不变,反应时间分别为2,2.5和3 h,按照1.3.1的方法制备包合物,计算包合率。
反应温度对包合率的影响:保持其它条件不变,反应温度分别为60,70和80℃时,按照1.3.1中的方法制备包合物,计算包合率。
1.3.6 正交实验
在单因素实验的基础上设计正交实验,并分析各因素对包合率的影响能力的大小,从中选出制备包合物的最优条件。
1.3.7 溶解度测定
准确称取槲皮素0.0024 g于烧杯中,室温下分批多次向其中加入一定量的水,摇匀,直至槲皮素完全溶解,记录所用水的总体积。准确称取槲皮素/β-环糊精包合物0.0072 g,用同样方法测定包合物在水中的溶解度。为了便于比较,对于槲皮素/β-环糊精包合物,以溶解的包合物中槲皮素的含量为基准计算其溶解度。
包合物中槲皮素含量的计算式:m=m0·m1Y/m2,单位:g。其中m1为溶解的包合物质量,g;m0为制备包合物时投入的槲皮素的质量,Y为包合率,m2为当次实验包合物的产量,g。
纯槲皮素在水中溶解度的计算式:Iq=mq/Vq,单位:μg/mL。其中Iq为槲皮素在水中的溶解度,mq为槲皮素的质量,μg;Vq为溶解槲皮素所用水的体积,mL。
包合物中槲皮素在水中溶解度的计算式:Ic=mc/Vc,单位:μg/mL。其中Ic为包合物中槲皮素在水中的溶解度,mc为溶解的包合物中槲皮素的含量,μg;Vc为溶解包合物所用水的体积,mL。
2 结果与分析
2.1 槲皮素/β-环糊精包合物的制备
由于溶液搅拌法操作简单,包合率高,且槲皮素和环糊精在无水乙醇中都有一定的溶解度。所以,本文以无水乙醇为溶剂,用溶液搅拌法制备槲皮素/β-环糊精包合物。投料比、反应时间和反应温度对产物的包合率都会产生一定的影响,本文首先在投料比为11、反应温度为60℃的条件下反应2 h,制备槲皮素/β-环糊精包合物,在此基础上考察实验条件对产物包合率的影响。
2.2 槲皮素/β-环糊精包合物的表征
为了鉴定槲皮素/环糊精包合物的结构,分别用核磁共振氢谱、红外光谱和X射线衍射谱对其进行表征。
2.2.1 核磁共振氢谱分析
槲皮素、β-环糊精和槲皮素/β-环糊精包合物的核磁共振氢谱如图1所示。由图可以看出,包合后槲皮素在低场的峰消失了,这是因为槲皮素作为客体分子进入β-环糊精的空腔后产生了屏蔽效应,由此可以证明槲皮素进入了β-环糊精的空腔内,即槲皮素与β-环糊精形成了包合物[15]。
2.2.2 X-射线衍射分析
槲皮素、β-环糊精、槲皮素与β-环糊精的物理混合物和槲皮素/β-环糊精包合物的X-射线衍射光谱如图2所示。由图2可以清晰地看出,物理混合物的X-衍射光谱仅仅是槲皮素与β-环糊精峰的简单叠加,而包合物在26.74、27.50处归属于槲皮素的衍射峰消失了,这说明槲皮素和β-环糊精物理混合时没有发生包合作用,而在槲皮素/β-环糊精包合物中,槲皮素已经进入β-环糊精的空腔中,即表明成功制备出了槲皮素/β-环糊精包合物[16]。
2.2.3 红外光谱分析
槲皮素、β-环糊精、槲皮素与β-环糊精的物理混合物和槲皮素/β-环糊精包合物的红外光谱如图3所示。由图3可以看出,物理混合物表现出槲皮素和β-环糊精图谱的叠加。包合物在1152~1640 cm-1范围的峰形与槲皮素的峰形完全不同,与β-环糊精相似[16]。这说明槲皮素进入环糊精的空腔内,即形成了槲皮素/β-环糊精包合物。这与核磁共振氢谱、X射线衍射谱结果一致。
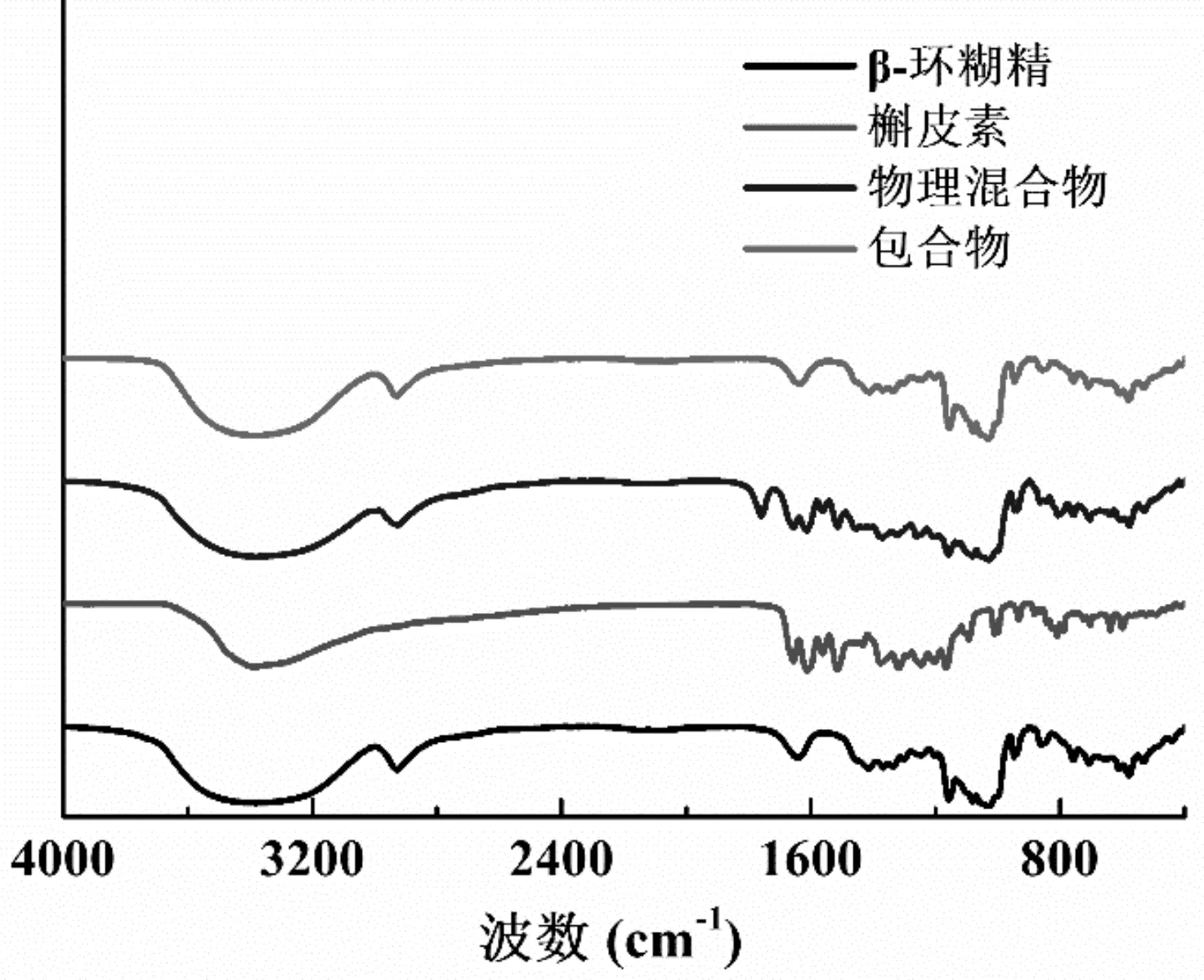
图3 槲皮素、β-环糊精、物理混合物和包合物的红外光谱图
2.3 槲皮素/β-环糊精标准曲线的绘制
浓度分别为6.3,10.5,14.7,16.8,18.9 μg/mL的槲皮素溶液的紫外-可见吸收光谱如图4A所示。由图4A可得知,在256 nm和373 nm处出现了最大吸收峰,在256 nm处的峰位重复性较好,因此选择256 nm处对应的吸光度作为纵坐标、槲皮素浓度为横坐标作图(图4B)。通过线性拟合可得回归方程为。这说明槲皮素的吸光度在6.3~18.9 μg/mL范围内与溶液浓度有良好的相关性,可用于计算槲皮素溶液的浓度。
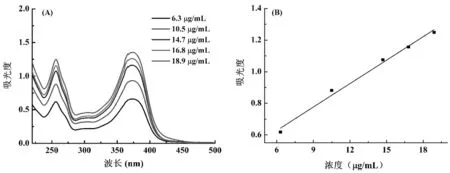
图4 槲皮素溶液的紫外-可见吸收光谱(A)和标准曲线(B)(溶剂:无水乙醇)
2.4 影响槲皮素包合率的因素
2.4.1 投料摩尔比对包合率的影响
β-环糊精与槲皮素的摩尔比分别为11,21,31,由结果可知,随着投料摩尔比的增加,槲皮素的包合率逐渐降低,当槲皮素与β-环糊精的摩尔比为11时包合率最高。这说明槲皮素/β-环糊精包合物可能是以11的摩尔比形成的。
2.4.2 反应时间对包合率的影响
反应时间分别为2,2.5和3 h,随着时间的增加,槲皮素的包合率呈现出先增大后减小的趋势,其中反应时间为2.5 h时的包合率最高。
2.4.3 反应温度对包合率的影响
反应温度分别为60,70和80℃,随着温度的升高,槲皮素的包合率呈现出先增大后减小的趋势,其中反应温度为70℃时包合率最高。
2.5 槲皮素/环糊精包合物的制备工艺优化
2.5.1 反应温度对包合率的影响
根据单因素实验结果,选取包合率最高的摩尔比、制备时间及反应温度设计L9(33)正交实验,正交因素水平和实验结果分别见表1和表2。

表1 槲皮素/β-环糊精包合物制备条件优化正交实验因素水平
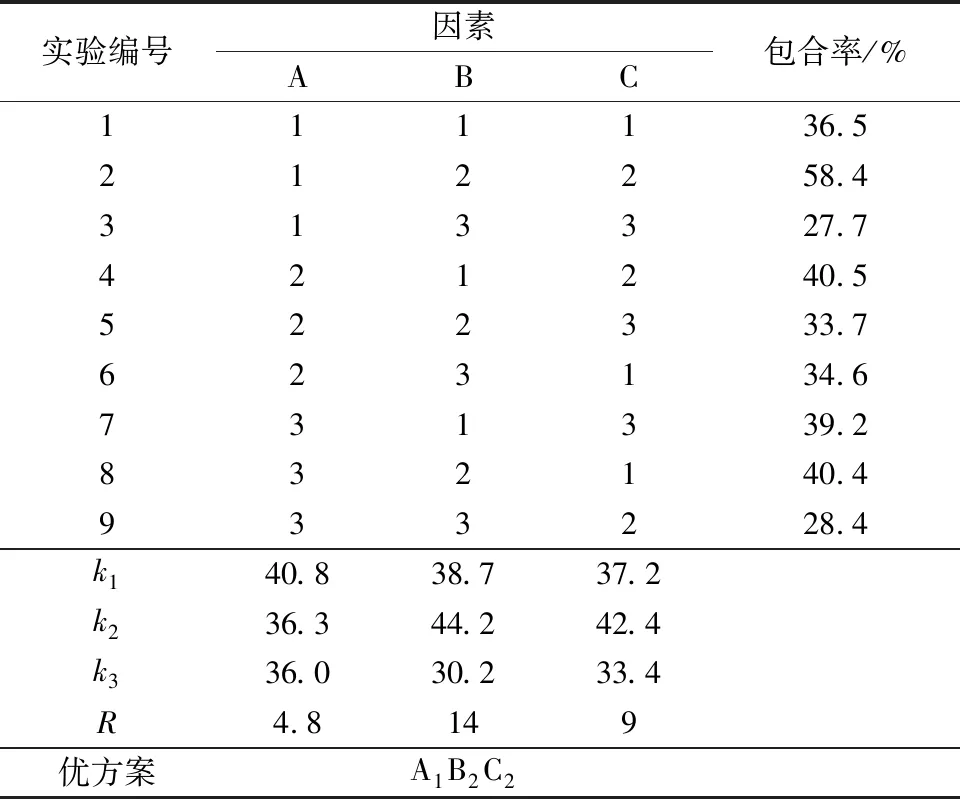
表2 槲皮素/β-环糊精包合物制备条件优化正交实验结果与分析
由表5的极差分析可知,投料摩尔比、反应温度和反应时间3个因素对包合率的影响大小顺序为:反应时间>反应温度>投料摩尔比。由正交实验结果可知,制备槲皮素/β-环糊精包合物的最优工艺条件为A1B2C2,即投料摩尔比为11,制备时间为2.5 h,制备温度为70℃。
2.5.2 验证实验结果分析
2.6 槲皮素/β-环糊精包合物的水溶性
根据1.2.7中的方法测得,纯槲皮素与包合物在水中的溶解度分别为4.8 μg/mL和392.4 μg/mL。与纯槲皮素相比,包合物的溶解度提高了约81倍。表明槲皮素在水中的溶解度得到了明显改善,有望提高其生物利用度。
3 结论
通过溶液搅拌法制备了槲皮素/β-环糊精包合物,并通过红外光谱分析、X-射线衍射光谱分析和核磁共振氢谱分析,对槲皮素/β-环糊精包合物进行表征。结果表明,成功制备出了槲皮素/β-环糊精包合物。通过正交实验法优化了制备工艺,最佳条件为槲皮素与环糊精的摩尔比为11,包合时间为2.5 h,温度为70℃。溶液度测试结果表明,槲皮素/β-环糊精包合物在水中的溶液度比纯槲皮素提高了约81倍。
本文制备槲皮素包合物的方法简单易行,对实验设备要求较低,且包合产物的水溶性得到了较大改善,有利于提高槲皮素的生物利用度。

