兰科雄蕊发育多样性研究进展
摘要:蘭科是被子植物中多样性最丰富的家族,其雄蕊形态和功能分化在亚科间变化明显,是该物种多样性形成及适应性传粉生物学的研究重点。基于现有研究资料,该文初步归纳了兰科雄蕊发育多样性的主要研究内容及现状,为野生兰花资源的保护与利用提供科学依据。结果表明:(1)可育雄蕊数目的减少和花粉愈合程度的增加在兰科分子系统树上呈明显的平行演化趋势。(2)兰科雄蕊数目的减少和功能分化与早期花器官发生中存在大量的滞后和缺失、次生融合与分裂现象等密切相关。(3)花药开裂时的4类散粉单元的花粉超微形态特征在亚科、族、亚族、属和种间差异明显。(4)兰科花药散粉单元可以为单花粉粒,也可以通过花药发育过程中源自绒毡层的三类黏性物质而聚合成不同的散粉单元,包括花粉鞘、弹性黏素和其他黏性物质。(5)花药发育揭示了兰亚科的花粉小块结构主要有三类(红门兰型、树兰型和过渡型),树兰亚科的不同数目(2、4、8)和形态(全缘、浅裂、深裂、孔裂)的花粉团是由于花药原基分化出的不育隔膜组织的数目、朝向和位置而形成的。(6)兰科花药发育中,花药室数目、花药壁发育类型、绒毡层细胞核数目、不育隔膜组织分化、胞质分裂类型、小孢子四分体排列形式、花粉细胞核数目等在亚科和属间差异明显。然而,由于种类繁多,现有研究资料难以为理解兰科雄蕊发育提供清晰的线索,包括雄蕊的发育模式、散粉单元的形成机制、花药发育的胚胎学特征等。因此,有必要重视兰科雄蕊发育研究,包括扩大取样范围和利用多学科技术方法和修订兰科花形态常用术语等。
关键词: 可育雄蕊, 退化雄蕊, 散粉单元, 花药发育, 系统学
中图分类号:Q944 文献标识码:A 文章编号:1000-3142(2023)08-1537-16
Research progress on diversity of androecium development of Orchidaceae
LI Lu
( College of Biodiversity Conservation, Southwest Forestry University, Kunming 650224, China )
Abstract:Orchidaceae is the most diverse family of angiosperms. The development of androecium varied greatly at the subfamily level, which has been a research focus of speciation and adatptive pollination biology. Progress on the development of androeceum in Orchidaceae was summarized according to a survey of literature. The results were as follows: (1) It was suggested that evolutionary trends on the decreasing number of fertile stamens was parallel with the increasing degree of coherence of pollens in the pollen dispersal units, which was present in the updated classification of Orchidaceae. (2) The reduced number of stamens and their functional differentiation would be related with the loss, delay, sub-fusion, sub-divsion of stamen primordia during the ontogeny of gynostemium in Orchidaceae. (3) Significant differences of the ultrastructural pollen existed in the four pollen dispersal units at the levels of taxonomic categories of Orchidaceae, including dry pollen, sticky pollen, sectile pollinium, and hard pollinium, which contains great implications of classifications. (4) Pollen may be dispersed in monads or grouped in pollen dispersal units by following three viscous substances (pollenkitt, elastoviscin, cohesion strands) derived from the tapetum. (5) Three main types of sectile pollinia in Orchidoideae were recognized based upon form and arrangement of massulae. Meanwhile, different numbers and varied morphology of pollinia in Epidendroideae were produced by the different numbers and orientations of sterile septum differentiated in the microsporangium during the early anther development based on anatomic evidence. (6) Some embryological features during anther development were diverse at the different categories, including the number of thecae, the type of anther wall development, thenuclei numbers of tapetum, the pattern of cytokinesis, the varied arrangements of microspore tetrads, and the nuclei number of pollens, which could provide a better understanding of taxonomy and evolution of Orchidaceae. However, considering the large number of orchid species, research data available seemed to be very limited. And then, it is necessary to clarify such fascinating questions as functional differentiation and developmental patterns of stamens and staminods, formation mechanisms for varied pollen dispersal units, and diverse embryological features of anther development. Therefore, much more efforts should be taken for the development of androecium in Orchidaceae, including expansive investigation of materials to be observed, using multidisciplinary technicalmethods, and rivising the common terminology of orchid floral morphology.
Key words: fertile stamen, staminode, pollen dispersal unit, anther development, systematics
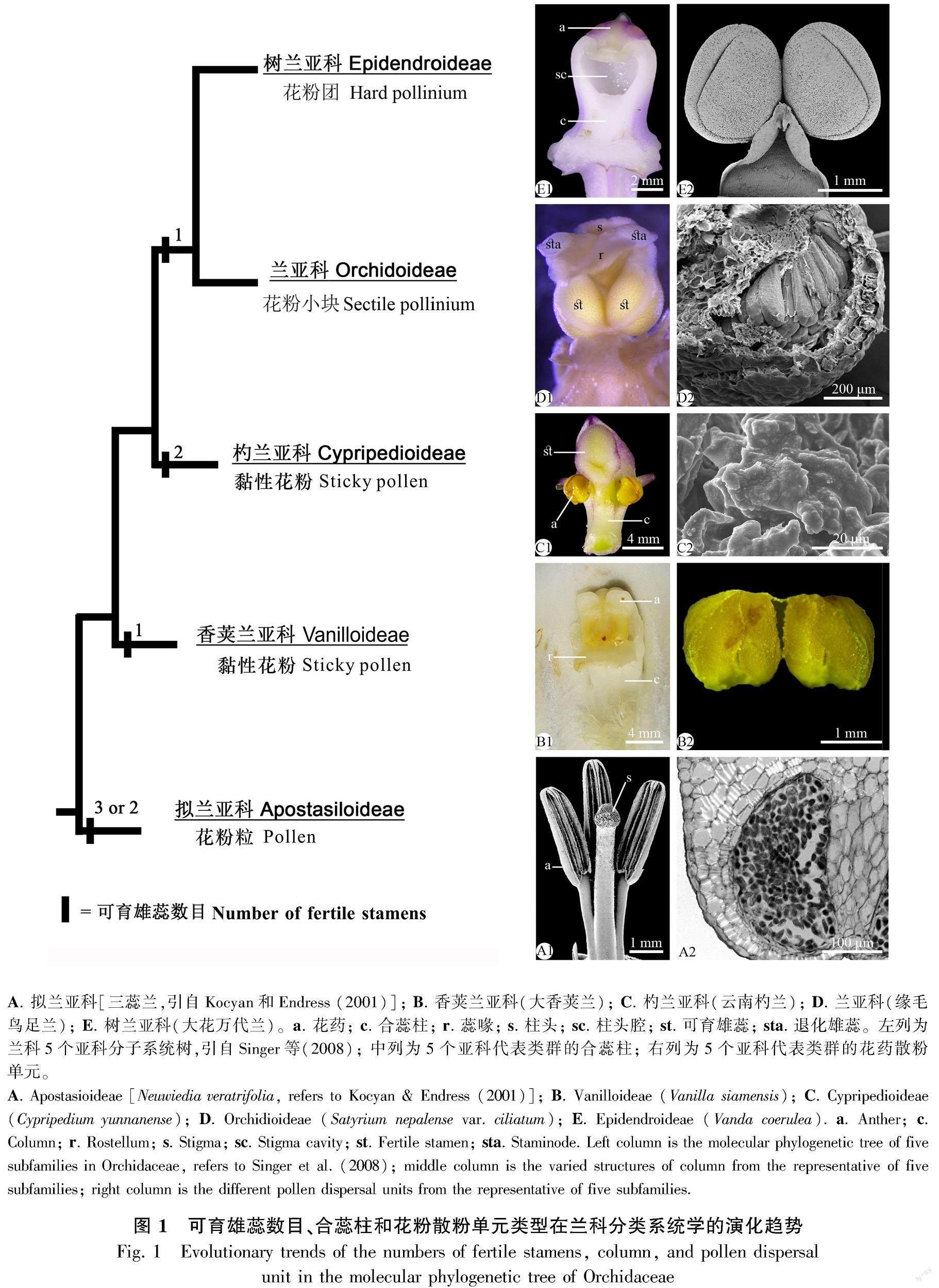
兰科是被子植物仅次于菊科的第二大科,拥有约800属近28 000种,世界广布,多见于湿润的热带和亚热带区域,少数分布于温带地区(Pridgeon et al., 1999; Chen et al., 2009; Chase et al., 2015)。大部分兰科植物具有以下4个典型的花形态特征。第一,花两侧对称,花萼和花瓣两轮,各3枚,形态近相似,中央一枚花瓣特化为唇瓣(lip or labellum),形态各异。第二,雄蕊和雌蕊(除子房外)愈合形成一个柱状复合结构,叫合蕊柱或蕊柱(gynostemium or column)。第三,花药成熟开裂时,花粉常聚合成不同数目和排列的花粉小块(sectile pollinium, or massulae)或花粉团(pollinium)。第四,子房下位,常具1室,侧膜胎座着生数枚倒生胚珠,发育为数目繁多的尘埃大小的种子,无胚乳。因此,兰科植物的花形态特征的专业术语在被子植物里较为独特,包括唇瓣、合蕊柱、蕊喙(rostellum)、花药帽(anther cap)、花粉团、黏盘(viscidium)、黏盘柄(stipe)、花粉团柄(caudicle)等(Dressler, 1993;郎楷永等,1999)。
合蕊柱和花粉团一直被视为兰科物种多样性演化过程中的关键革新性性状(innovative features),其形态建成离不开雄蕊的贡献(Endress, 2001, 2016;Rudall & Bateman, 2002)。发育完好的合蕊柱(developed column or gynostemium)是由一枚可育雄蕊的花丝和雌蕊的花柱愈合形成的一个具有背腹面之分的扁平柱状结构,从上到下由花药、柱头和合蕊柱三部分构成(Dressler, 1986, 1993)。花粉团是可育雄蕊的花开裂时,同一个花药室的花粉靠黏性物质凝聚成的团块(Dressler, 1986;Singer et al., 2008;Endress, 2016)。在物種多样性丰富的兰科家族,发育完好的合蕊柱和花粉团这一对特征经常同时出现,出现在三个核心分支(core clades),包括香荚兰亚科(Vanilloideae)、兰亚科(Orchidoideae)、树兰亚科(Epidendroideae)。这三个亚科均具一枚可育雄蕊,被称为单雄蕊类群(monandrous orchids)。但是,花药开裂时,它们的散粉单元(pollen dispersal unit)形态结构变化明显,依次为黏性花粉团(sticky pollinium)、花粉小块和花粉团(Pacini & Hesse, 2002, 2005;Singer et al., 2008)。与此同时,在兰科的基部类群,还存在着一类“不发达的合蕊柱”(undeveloped column),指仅由雄蕊的花丝和雌蕊的花柱在基部或中部以下愈合,各见于拟兰亚科和杓兰亚科。这两个亚科的可育雄蕊数目差别明显,前者有3枚,后者有2枚,分别被称为三雄蕊兰(triandrous orchids)和双雄蕊兰(diandrous orchids)(Pacini & Hesse, 2002;Singer et al., 2008)。花药开裂时,两个亚科的花粉形态截然不同,前者为干燥的单粒花粉(dry pollen),后者为黏性花粉(sticky pollen)。因此,兰科雄蕊发育的研究内容主要包括可育雄蕊和不育雄蕊的功能分化及其器官发生、可育雄蕊数目的变化、花药成熟时散粉单元类型、不同散粉单元内花粉凝聚黏合的机制、花药发育胚胎学特征等。
1兰科可育雄蕊数目和散粉单元类型的分类系统学及传粉生态学意义
最新的分子系统学(Chase et al., 2015)支持兰科分为5个亚科,包括基部类群的拟兰亚科、次基部类群的香荚兰亚科和杓兰亚科、核心类群的兰亚科和树兰亚科,为进一步理解兰科雄蕊数目和散粉单元的系统学意义提供了可行性框架。基于分子系统学和形态证据,可育雄蕊数目的减少和花粉逐步愈合的特征在5个亚科的系统演化树上表现出明显的平行演化趋势,蕴含着重要的分类系统学和传粉生态学意义(Singer et al., 2008)。鉴于此,本文根据兰科分子系统树把这对关系密切的特征划分为5类:(1)三雄蕊兰-具花粉粒,(2)双雄蕊兰-具黏性花粉,(3)单雄蕊兰-具黏性花粉,(4)单雄蕊兰-具花粉小块,(5)单雄蕊兰-具花粉团,依次出现在拟兰亚科、杓兰亚科、香荚兰亚科、兰亚科和树兰亚科。
1.1 拟兰亚科: 三雄蕊兰-具花粉粒
三雄蕊兰-具花粉粒(triandrous orchids with pollens),指可育雄蕊有2~3枚,花药成熟开裂时散粉单元为干燥花粉单体(monad),呈颗粒状,出现在基部类群的拟兰亚科(图1:A1,A2)。该亚科为兰科其余4个亚科的姐妹群(Chase et al., 2015),包括2属约17种,是兰科里最小的一个亚科,为林下地生兰,分布于热带亚洲和大洋洲(Dressler, 1993)。拟兰亚科包括三蕊兰属(Neuwiedia Bl.)和拟兰属(Apostasia Bl.),其花形态更接近于兰科的姐妹群——仙茅科(Hypoxidaceae)(Cameron, 2009;Chase et al., 2015),如近辐射对称的花型,具3枚可育雄蕊,其花丝和花柱仅在基部愈合,柱头顶生呈球形。但是,可育雄蕊数目和花药开裂方式在属间不同,可作为属间界限的划分依据。三蕊兰属的可育雄蕊有3枚,花药纵裂,而拟兰属的可育雄蕊有2枚,另有1枚退化雄蕊,花药顶孔开裂(Kocyan & Endress, 2001)。
1.2 香荚兰亚科: 单雄蕊兰-具黏性花粉
单雄蕊兰-具黏性花粉(monandrous orchids with sticky pollens),指合蕊柱仅由1枚可育雄蕊和雌蕊的花柱及柱头高度愈合,花药成熟时的散粉单元为黏性花粉,呈浆糊状或粉状,可为具有黏性的单花粉粒(pasty pollen)、两两黏合的花粉单体或四合花粉,见于香荚兰亚科(图1:B1,B2)。该亚科是兰科的次基部类群,为多年生地生兰或附生兰,或攀援草本,广布全世界,包括2族15属约185种(Pridgeon et al., 2003)。香荚兰亚科花粉形态研究资料较少,现有研究结果认为其成熟花药散粉时的散粉单元类型与杓兰亚科的一致,但都不形成真正意义上的花粉团(Singer et al., 2008)。这两个亚科亲缘关系较近,均具黏性花粉粒,呈浆糊状或粉状,以涂片状(smear)的形式黏在传粉者背部(Dressler, 1993),但传粉机制不同。杓兰亚科具有囊状唇瓣,可作为吸引昆虫的陷阱,而香荚兰亚科部分物种的雄蕊有一个厚实有弹性的花丝朝前弯曲(bent/hyperimcumbent)(Dressler, 1993),在传粉者络绎不绝的拜访中,花粉慢慢释放,当传粉者离开花朵时,身体上覆盖着一层粉尘一样的花粉粒。
1.3 杓兰亚科: 双雄蕊兰-具黏性花粉
双雄蕊兰-具黏性花粉(diandrous orchids with sticky pollens),指具有2枚可育雄蕊,其花药开裂时露出的散粉单元为具黏性的花粉粒,呈浆糊状(pasty)的黏花粉粒(sticky pollens),可为花粉单体或四合花粉(tetrad),出现在杓兰亚科(图1:C1,C2)。该亚科与香荚兰亚科组成兰科的次基部类群,分布于欧亚大陆和美洲,包括5属和180种,每个属都有独立而特定的地理分布(Dressler, 1986;Pridgeon et al., 1999)。除了南美洲特有的3个小属以外,其余2个属在我国均有分布,包括杓兰属(Cypripedium L.)和兜兰属(Paphiopedilum Pfitz.)(郎楷永等,1999;Pridgeon et al., 2001;陈心启等,2009)。杓兰亚科的花部形态在兰科5个亚科里的识别度较高,包括由2枚侧萼片愈合的合萼片、特化为囊状的唇瓣、不发达的合蕊柱、1枚发达的退化雄蕊(staminode)和盾状柱头等。其中,该亚科的雄蕊和花药较为独特,具2枚可育雄蕊,其花丝粗短,花药开裂时散粉单元为一团表面光滑的黏性花粉团(a mass of sticky pollens),并位于传粉者的必经之路。虽然花粉黏性较大看似成团,但组织切片结果证实了紫纹兜兰的成熟花药内的花粉细胞排列稀疏,既有单粒花粉也有四合花粉,花粉间存在来自绒毡层降解后的黏性物质把所有花粉黏合成一体,以提高传粉效率(任玲和王伏雄,1987)。这些黏性花粉在长瓣兜兰(Paphiopedilum dianthum)(史军等,2007)和绿花杓兰(Cypripedium henryi)(Li et al., 2008)的传粉者身上清晰可辨。因此,黏性花粉、囊状唇瓣和发达的退化雄蕊等特征,构成了杓兰亚科特有的传粉综合特征(Li et al., 2006, 2008)。通常情况下,传粉者受诱惑于醒目的花形态或气味,很容易失足跌落囊状唇瓣内,为了逃离“陷阱”,昆虫必须通过唇瓣两侧靠近花药的通道往外爬。在逃离的过程中,传粉昆虫的背部就会蹭到囊口的黏性花粉粒,巧妙地帮助植物完成了传粉(Li et al., 2006, 2008; Zheng et al., 2011)。研究发现,这些黏在传粉者体表的花粉粒为花粉单体涂片(smears of monad)或四合花粉(van der Gingel, 1995;Bnziger, 1996;Bnziger et al., 2005)。此外,大部分杓蘭属的散粉单元多为黏性花粉,但部分成员(如section Sinopedilum, sensu, Perner, 2009) 的成熟花药的散粉单元为一个完整黏性较强的棒状花粉团,内部充满了类似于花粉鞘的黏性胶状物且具黏盘状附属物。
1.4 兰亚科: 单雄蕊兰-具花粉小块
单雄蕊兰-具花粉小块(monandrous orchids with sectile pollinia),指合蕊柱仅由1枚可育雄蕊和雌蕊的花柱高度愈合而成,成熟花药散粉时为易分割的花粉团。花粉团也称花粉小块,由于质地柔软,又叫做软花粉团(soft pollinium),主要见于兰亚科(图1:D1,D2)。该亚科是兰科演化系统中的核心类群之一,为多年生地生兰,包括了7族约180属和3 630种,约占兰科物种数的15%(Pridgeon et al., 2001),仅次于树兰亚科(约21 000种)。同一孢子囊的花粉小块排列形式多样,即数个楔形的同源花粉小块(fairly homogenous wedge-shaped massulae)集体附着在由不育隔膜组织降解形成的黏性结构上,充当了花粉团柄、黏盘、黏盘柄等附属结构(accessory structure),提高了传粉效率(Freudenstein & Rasmussen, 1997)。花粉团是一个孢子囊所有花粉的集合(Johnson & Edwards, 2000),在一定程度上提高了异花传粉效率(Singer & Sazima, 1999, 2000, 2001; Singer et al., 2008),是兰科演化路线上物种多样性加速急剧增加的重要变革性特征(Dressler, 1993; Endress, 2016)。
1.5 树兰亚科: 单雄蕊兰-具花粉团
单雄蕊兰-具花粉团(monandrous orchids with hard pollinia),指合蕊柱由1枚可育雄蕊和雌蕊的花柱和柱头高度愈合而成,花药成熟开裂时,花粉凝聚成一体的坚固花粉团,见于树兰亚科(图1:E1,E2)。该亚科是兰科的核心类群,通常为多年生地生兰或附生兰,分布在热带和亚热带地区,包括17族650属21 160种,其物种数占兰科组成的74% (Chase et al., 2015;Freudestin & Chase, 2015)。树兰亚科的花粉团是完整不可分割的散粉单元的集合体,其质地坚硬,表面光滑、呈蜡质,即经典兰科分类系统中所谓的蜡质或坚硬花粉团(so-called “waxy” or “hard” pollinium)(Pridgeon et al., 2005, 2009, 2014)。从外观形态结构而言,一个孢子囊里的花粉团可以是带附属结构的花粉器(pollinarium = pollinia with attachment)(Dressler, 1986, 1993),也可以为无附属结构的裸花粉团(naked pollinium without accessory structure)。显然,单独的裸花粉团不会被传粉者从花药里带走,但合蕊柱顶部位于花药和柱头腔之间的蕊喙组织在受到外界干扰时会分泌释放黏性物质,帮助花粉团黏在传粉者身上,完成传粉(Dressler, 1986, 1993)。这个花结构的形态机制普遍见于新热带分布的石豆兰属(Bulbophyllum Thouars)、亚洲分布的石斛属及其近缘类群(Dendrobium Sw. with their alliances)(Dressler, 1986, 1993)。另外,带有附属结构的花粉块特征对于树兰亚科的适应性传粉机制和系统演化显得至关重要,在族、亚族和属间都有不同的形态变异,形成不同的传粉机制,表现出高度专一而多样的传粉生态适应性演化机制(Pridgeon et al., 2005, 2014;Endress, 2016;Mosquera-Mosquera et al., 2019)。
2兰科退化雄蕊和可育雄蕊的器官发生与发育
兰科的花器官发生过程中,存在大量的融合、缺失或退化、滞留发育等次生现象(Rasmussen, 1982, 1986;Kurzweil, 1998;Freudestein & Rasmussen, 1996;Decraene & Smets, 2001;Rudall & Bateman, 2002;Endress, 2001, 2016),包括可育雄蕊数目及其功能分化、合蕊柱类型、花药成熟时散粉单元类型变化,以及杓兰亚科特有的两枚侧萼片愈合为合萼片的现象。围绕兰科可育雄蕊数目和功能分化及其系统学意义的理解,本文梳理了相关资料,发现以下4个特点。
2.1 兰科雄蕊数目起源分化的猜想
关于雄蕊数目及其功能分化的演化意义的观点大部分来自对不同类群成熟花结构的观察和比较,出现在兰科分类系统专著(Dressler, 1986, 1993;Pridgeon et al., 1999, 2001, 2003, 2005, 2009, 2014)。这些观点普遍认为,位于百合目的兰科祖先具有6枚可育雄蕊,在演化过程中伴随着3枚、4枚和5枚可育雄蕊的缺失或退化(Dahlgren & Bremer, 1985;Rasmussen, 1982, 1986),演化出目前兰科分子系统树上的三雄蕊的拟兰亚科、双雄蕊的杓兰亚科及单雄蕊的香荚兰亚科、树兰亚科和兰亚科。值得注意的是,这些猜想均基于对成熟花结构的观察。
2.2 扫描电镜可揭示花器官发生中雄蕊原基的分化和发育
随着扫描电镜技术的发展和广泛运用,更多研究可以选择不同雄蕊数目的代表类群,从花器官发生和花发育过程,系统地观察比较合蕊柱、柱头腔、蕊柱齿、蕊喙等附属结构的器官起源和发育特点,如拟兰亚科(Kocyan & Endress, 2001)、杓兰亚科(Kurzweil, 1993)、兰亚科(Kurzweil, 1987b, 1996;Luo & Chen, 2000;Kurzweil et al., 2005;Box et al., 2008)和树兰亚科(Kurzweil, 1987a)。值得关注的是,这些利用扫描电镜观察早期花器官发生并探讨其分类系统演化意义的研究结果大部分都是基于前人提出的假说,即兰科祖先具有6枚雄蕊,各有两轮,内轮雄蕊原基发育停滞,形成了退化雄蕊残迹,外轮雄蕊中的1或2枚退化,演化为双雄蕊和单雄蕊类群。
2.3 多学科手段探究兰科雄蕊发育多样性
扫描电镜和石蜡切片技术可为理解兰科可育雄蕊及花药发育的演化意义提供个体发育证据。扫描电镜从花器官发生的角度揭示了雄蕊原基和相邻花器官原基(花萼、花瓣、唇瓣、雌蕊)发生的相对位置和时空发育顺序;石蜡切片从组织切片水平揭示雄蕊原基數目及其维管束在花部维管束中的起源、分布和走向。这在拟兰亚科得到充分体现。五个亚科里,拟兰亚科的退化雄蕊和可育雄蕊的发育机制相对清楚(Stern et al., 1993;Kocyan & Endress, 2001),Chase等(2015)从器官发生和组织切片水平,揭示了该亚科仅有的两个属的雄蕊发育和功能分化的异同,证实了拟兰亚科的雄蕊发育模式更接近于兰科所在的天门冬目(Asparagales),支持它作为兰科的基部类群,得到了分子系统学证据的有力支持。
2.4 兰科雄蕊器官发生和发育的研究现状
长期以来,关于具单雄蕊的兰亚科和树兰亚科的雄蕊器官的起源及功能分化备受兰科植物学家的关注。其中,贡献最大的当数南非兰科分类学家Kurzweil的系列研究成果。Kurzeweil(1987a)先后利用扫描电镜系统地观察了不同亚科和族(sensu, Rasmussen,1986)具代表性的90种兰花的花器官发生,包括萼片、花瓣、唇瓣、雄蕊与雌蕊的器官发生的时空位置和顺序等,讨论了合蕊柱器官发生中退化雄蕊和可育雄蕊原基的时空位置和发育特点,揭示了合蕊柱的附属结构(蕊柱齿、耳状结构、蕊喙等)的器官来源(Kurzweil, 1987a, 1987b, 1989, 1990, 1996;Kurzweil et al., 2005)。树兰族(Epidendreae)和万代兰族(Vandeae)(sensu Ramussen, 1986)的39属47种兰花的花发育揭示了合蕊柱的两侧附属物(耳状结构,auricles)与两枚退化雄蕊原基同源,腹面的附属物则是近轴雄蕊原基发育的残留物,认为蕊喙为柱头中裂片的顶端,唇瓣是内轮花瓣,并简要讨论族级系统学意义(Kurzweil, 1987a)。相反,在兰亚科(sensu Ramussen, 1986)的11种红门兰族植物的花器官发生过程中,耳状结构见于可育雄蕊的腹面,因此不能解释为退化雄蕊的残迹。据此推断退化雄蕊原基起源较早,因其发育过程中出现了停滞和退化现象,所以成熟花结构里看不到退化雄蕊痕迹,同时三裂蕊喙完全源自中央心皮原基(Kurzweil, 1987a)。鸟巢兰亚科(Neottioideae sensu Ramussen, 1986),即19种鸟巢兰族物种里,退化雄蕊的器官发生为渐进式,即早期两枚侧生雄蕊分化明显,而后期大部分物种都出现了发育停滞和退化(Kurzweil, 1987a)。在萼距兰亚族(Disinae)的24种兰花中(Kurzweil, 1990),合蕊柱两侧的耳状结构是复合型起源,既有可育雄蕊的花丝,也有退化雄蕊原基成分,中央心皮完全发育为蕊喙。12种鸟足兰亚族(Saryriinae)的花器官揭示了退化雄蕊原基不明显,但合蕊柱两侧附属物的分叉结构应该是来自退化雄蕊和耳状结构的附属物,这也见于澳洲的粉药兰族(Cranichideae)和双尾兰族(Diurideae)的合蕊柱器官发生过程(Kurzweil et al., 2005)。
我国的兰科雄蕊发育的研究资料较少。Luo和Chen(2000)利用扫描电镜观察了红门兰亚族6属10种兰花的花器官发生,揭示了蕊喙裂片和黏盘等特殊结构的起源,为理解兰亚科的可育雄蕊的分类系统学意义提供了基础。同时,舌喙兰属(Hemipilia Lindl.)合蕊柱器官发生(Luo et al., 2005)和两种玉凤花属(Habenaria Willd.)植物的合蕊柱超微结构特征(陶凯锋等,2023)为解决它们与近缘属的亲缘关系提供了依据。
近年来,不断更新的研究手段为理解兰科雄蕊发育的器官发生和组织切片水平的发育模式提供了更多信息。除传统的石蜡切片和扫描电镜外,还结合X射线显微拍照技术,即显微-CT(Micro-CT)和功能基因分析手段(Gamisch et al., 2013;Pramanik et al., 2020),从器官发生、组织切片、组织化学染色等多手段研究花形态发育过程,为理解兰科雄蕊功能分化的系统学意义提供了新资料和新角度。
此外,在单雄蕊的兰亚科和树兰亚科里,有部分物种存在着2或3枚可育雄蕊的特例。例如,兰亚科的缘毛鸟足兰(Satyrium nepalense var. ciliatum)的部分植株存在退化雄蕊,形成功能性雌株,为兰科中少有的雌雄异株的典型代表(陈心启,1979)。本文作者观察了其雌雄同株的花药发育过程,发现结构较小的退化雄蕊也有花药发育,但在小孢子四分体时期发育停滞,出现败育(待发表)。树兰亚科的部分物种出现了2枚或3枚可育雄蕊的特例,但器官发生的研究资料缺乏。例如,鸟巢兰属(Diplandrorchis S. C. Chen) [ = (Neottia Guett.)]有2枚可育雄蕊,中国产的金佛山兰属(Tangtsinia S. C. Chen) [ =头蕊兰属(Cephalanthera Rich.)] 有5枚退化雄蕊和最外一枚雄蕊(陈心启,1982)。章鱼兰的变种(Encyclia cochleata var. triandra)拥有3枚可育雄蕊,被认为与自花授粉有关(Catling, 1990)。关于这些异常花结构的器官发生,Pabón-Mora和González(2008)利用扫描电镜和石蜡切片技研究了树兰亚科较为罕见的具有辐射对称花的类群毛顶兰属(Telipogon Kunth)及其近缘种的发育模式和系统学意义,以及树兰属(Epidendrum L.)及其近缘类群锥叶兰属(Microepidendrum Brieger ex W.E.Higgins)等花发育后期的结构特征(Valencia-Nieto et al., 2016)等。因此,从器官发生、组织切片、基因组水平等探究兰科里出现的这些“异常花”的发育和形成机制,可为深入理解兰科雄蕊发育提供新资料。
3兰科不同散粉单元花粉超微形态特征的研究现状
3.1 花粉超微特征的分类系统学意义
目前,尽管兰科的分类系统学在亚科水平上较为稳定并被广泛采纳,但亚科下的族、亚族、属、种间的分类群界限和亲缘关系争议较大,亟待澄清(Chase et al., 2015;Li et al., 2016)。兰科散粉单元类型的花粉外壁纹饰特征在亚科、族、亚族、属和种间的差异明显,具有重要的分类系统学意义(Burns-Balogh, 1983;Burns-Balogh & Bernhardt, 1985;Burns-Balogh & Hesse, 1988;Pacini & Hesse, 2002;Blackmore et al., 2007)。花粉形态和外壁纹饰特征在同一个属内较为相似,如手参属(Gymnadenia R. Br.)、兜被兰属(Neottianthe Schltr.)(席以珍等,2000)和玉凤花属(Passarelli & Rolleri, 2010; Mulgaonkar, 2011),可作为属间界限划分和物种鉴定的依据。具有一定的代表性的取样范围,有助于获得某个类群的花粉形态特征的演化趋势,具有重要的分类学意义。例如,18种石斛属(Dendrobium Sw.)植物里有3条明显的演化路线(Bhupendra et al., 2012),中国产的14种石斛属植物的花粉形态和超微形态特征在种间差异明显,为光滑、穴状或颗粒状等,可用于近缘种的物种鉴别(王艳萍等,2021)。分布于热带美洲的类群(Pleurothallidinae亚族21属)的花粉团的形态外壁纹饰在属间变化多样,具2条明显的演化路线(Stenzel, 2000)。玉凤花属(4种)的花粉团表面纹饰比较相似,均为网状纹饰(Passarelli & Rolleri, 2010)。
3.2 花粉超微特征的传粉生物学意义
花粉超微形态特征不仅在系统分类方面提供形态证据,而且对于理解兰科高度适应性进化的传粉生物学很有帮助。鸟巢兰族(Neottieae)是一类花粉散粉時以单粒或四合花粉为主的兰花,在树兰亚科中很少见(Pacini & Hesse, 2002)。Barone等(2014)利用扫描电镜观察鸟巢兰族5属10种兰花的花粉揭示了该族的花粉外壁的覆盖层特征在系统树上呈现为由薄到厚的演化趋势,同时单粒花粉仅出现在有花蜜回报的类群中,而四合花粉见于没有回报的欺骗性传粉的兰花。此外,花粉超微形态结果表明,兰科植物中存在着假花粉粒的现象,如石斛属(Davies & Turner, 2004)和腭唇兰属(Maxillaria Ruiz & Pav.)(Davies et al., 2013),两者在超微形态结构方面区别明显。假花粉粒的出现也许是兰科植物传粉生态适应性进化的一个机制(Davies & Turner, 2004)。
4兰科花药开裂时,散粉单元内花粉黏连的研究现状
在兰科4类主要散粉单元类型(花粉粒、黏性花粉、花粉小块和花粉团)中,最容易理解的是拟兰亚科的松散花粉粒(图1:A1,A2),花粉粒之间无黏性,这与大部分被子植物的花粉粒的形态特征一致。杓兰亚科花粉囊产生的单分体花粉或四合花粉外被一层黏性物质包裹(图1:C2),但不凝聚成黏性花粉团(任玲和王伏雄,1987;Singer et al., 2008)。香荚兰亚科中出现了由单分体花粉聚集成的花粉团(图1:B2)(Harder & Johnson, 2008)。兰亚科里出现了由四合花粉结合在一起形成的软花粉团或花粉小块(图1:D2)(Barone Lumaga et al., 2006)。占兰科85.7%物种数的树兰亚科的大部分物种的花粉则进一步凝聚成坚硬的蜡质花粉团(图1:E2)(Dressler, 1993;Johnson & Edwards, 2000)。
4.1 散粉单元内部花粉粒间的3类黏性物质
在兰科的花药发育后期,花药壁的绒毡层和不育隔膜组织的内绒毡层的降解,参与了成熟花粉黏连成不同散粉单元的过程,主要有3类黏性物质。第一类是花粉鞘(pollenkitt),主要由黏性的脂类物质组成,还包括一些疏水性脂肪、类黄酮、胡萝卜素和绒毡层蛋白等退化产物,存在于花粉或花粉团外部,该类物质可以将花粉凝聚四合花粉或花粉团,有防止水分蒸发、调控花粉与雌蕊识别反应等功能(Ackerman & Williams, 1981;任玲和王伏雄,1987;Pacini & Hesse, 2005)。第二类是弹性黏素(elastoviscin),是兰科中最常见的黏性物质,是一种高分子脂类化合物(Blackman & Yeung, 1983),与花粉鞘同源(Schill & Wolter, 1986),由花药内的内绒毡层组织降解形成,是花粉团柄的组成成分,负责将四合花粉或花粉小块黏合成花粉团,在兰亚科、树兰亚科中均有报道(Dressler, 1986;Blackman & Yeung, 1983;Hesse & Burns-Balogh, 1984)。第三类是其他黏性物质或黏丝(cohesion strands),源自绒毡层降解后释放的脂类粘贴剂,出现在花粉团发育后期,干燥后覆盖在花粉团上(Blackman & Yeung, 1983;Yeung, 1987)。此外,近期功能基因研究表明,除拟兰亚科外,其余4亚科中均丢失MIKC*类的P-亚类基因,致使花粉粒从分离向黏连转变,并逐渐凝结成花粉块(Kwantes et al., 2012)。
4.2 花粉外壁结构有助于花粉黏连为散粉单元
有研究利用扫描电镜和透射电镜观察了兰科花粉粒或花粉团之间的超微结构,认为散粉单元的外壁的覆盖层物质对于黏结花粉粒成团起到了外资聚合力。在树兰亚科的Diseae族里,花粉黏合成团是通过花粉团外壁的覆盖层桥实现的(Chesselet & Linder, 1993)。在那些具有粉状或粉质的花粉团的兰花中,所有的花粉都具同一外壁纹饰类型,它们凝聚在一起靠的是花药壁的绒毡层自我分解(autolysis)后释放出的一种脂类黏贴剂。这个物质最后会在整个花粉团内渗透并加固所有的小孢子(Fitzgerald et al., 1994)。早期释放的必需的加固胶质会覆盖所有的花粉粒。相反,在石斛属,加固成团的花粉团内部的花粉粒缺乏外壁纹饰层(Zavada, 1990)。不过,在树兰(Epidendrum ibaguense)中,成熟花粉团会出现分层(reveal layering)。花粉外壁明细分为形态不定的内壁层(amorphous nexine),覆盖着所有的花粉,同时外壁层(sexine)向花粉团周边凝集(Blackman & Yeung, 1983)。因此,花粉凝聚成团主要归功于花药发育后期的分泌物。这些分泌物又称为胶合剂材料(adhesive materials),由绒毡层细胞产生,但渗透范围仅限于两个四合花粉粒外壁之间。由于曝光和干燥,这一层多聚合物质会形成一个坚固的外壳(Fitzgerald et al., 1994)。在具花粉小块的种类里(如Loroglossurn hircinum)(Pandolfi & Pacini, 1995),花粉粒以四合花粉为最小单位,两两靠近黏连,形成花粉小块。因此,内部明显分为两层,靠外的一层保持着四合花粉的整体性,而最内一层为单花粉粒结构。其花粉外壁紋饰特征也仅局限于最外层的花粉。此外,在一些具有花粉小块的类群里(如Disinae),内部的四合花粉两两相伴(calymmate),但更大集合的花粉小块之间的距离较远(acalymmate)(Chesselet & Linder, 1993)。
由此可见,兰科4类散粉单元类型,即单花粉粒、黏花粉粒(四合花粉)、花粉小块和花粉团,既依靠花粉粒之间内在联系的黏贴剂,又需要花粉粒凝聚成复合花粉后外壁的加固胶着连接物质。因此,系统地选择一些有代表性的类群,从花药发育过程观察小孢子母细胞时期到成熟花粉时期,细胞壁之间的胼胝质、多糖或脂类等的积累特征和分布模式,将有助于理解兰科植物的不同散粉单元的形成原因。
5兰亚科花粉小块与树兰亚科花粉团发育
花药散粉单元的形态构成在兰亚科和树兰亚科差异明显,是划分两个亚科界限的关键依据(Dressler, 1986, 1993;Freudenstein & Rasmussen, 1997, 1999;Singer et al., 2008)。兰亚科的散粉单元为花粉小块,指同一个孢子囊内由不同数目的楔形花粉块围绕着一个固着桩着生的花粉集合,其数目、形态、结构和质地等在族、属和种间差异明显,具重要的分类学意义。斑叶兰亚族(Goodyerinae)和玉凤花亚族(Habenariinae)的花粉小块具有黏盘柄, Cloraeinae亚族的花粉小块无花粉团柄(Dressler, 1986, 1993;Rasmussen, 1982)。树兰亚科的散粉单元为不同数目或形态的花粉团,有时为带有附属结构的花粉器。花粉团仅指同个孢子囊内所有花粉粒黏连成团的花粉集合成团,组织成分简单,全部源于雄蕊组织。花粉器是指除了花粉团外,还有其他附属结构将不同数目的花粉团连成一体,其组织成分较为复杂,除了花粉团和花粉团柄源自雄蕊以外,充当附属结构的黏盘、黏盘柄和蕊喙等均来自雌蕊组织(Dressler, 1986, 1993)。因此,散粉单元类型的形成机制成为理解两个亚科分类系统学的主要内容。
5.1 兰亚科花粉小块的排列类型
兰亚科的花粉小块通常是有一串可分离的单元构成,其形态在族和属间变化明显,具有重要的分类学意义(Dressler, 1986, 1993;Rasmussen, 1986;Freudenstein & Rasmussen, 1997, 1999;Singer et al., 2008)。关于花粉小块发育及分类系统学意义,较为系统的研究见Freudenstein和Rasmussen(1997)的工作。他们选择了兰亚科主要族或亚族的代表类群,以约占该亚科30%的物种为研究对象,通过石蜡切片和扫描电镜观察了不同类群的花粉小块的形态结构及其系统亲缘关系。该研究结果表明,兰亚科的花粉小块有两种基本类型和一个过渡类型,具体如下。(1)红门兰型花粉小块(orchidoid type):指排列整齐且形态大小相似的花粉小块,每个花粉小块都着生或粘贴在有弹性的黏柱上(Dressler, 1986;Schill & Wolter, 1986),从而构成一层层覆瓦状排列的可分割的花粉团。这种类型见于兰亚科大部分类群中,如斑叶兰亚族、红门兰族(Orchideae)、Prasophyllinae亚族、竹茎兰亚族(Tropidiinae),以及肉药兰属(Stereosandra Blume)。肉药兰属没有叶子,现被放置在树兰亚科的芋兰族(Nervilieae),该属有两对花粉团,每一对花粉团都相互紧密贴靠在一起。(2)树兰型(epidendroid type):花粉小块的形态大小皆不规则,通常是多层排列,花粉小块之间通过有黏性的丝状体聚合在一起。这些有黏性的丝状体在虎舌兰(Epipogium roseum)中特别明显。虎舌兰的花粉团由好几层花粉小块组成,层数要多于其他该科物种。Vermeulen(1965)认为,虎舌兰的花粉小块以四合花粉为黏合单元聚合在一起,此特征在透射电镜(TEM)下可被观察到(Hesse et al., 1989)。由于虎舌兰的花粉块具有明显的由黏性丝状物组成的花粉团柄,因此,其花粉小块也是散生的四合花粉(Rasmussen, 1986)。(3)过渡类型花粉小块:指除了上述两种基本类型外,还有一些形态有所变异的过渡类型,尚未命名。例如,美髯兰属(Arethusa L.)的花粉小块上的四合花粉很容易被辨识,该属与血叶兰属(Ludisia A. Rich.)和Platytheles属均为花粉小块排列稀疏的类型;由于花粉排列紧密,贝母兰属(Coelogyne Lindl.)的花粉小块上的四合花粉则很难识别。此外,部分类群孢子囊中央的隔膜组织部分缺失,构成了中空的花粉团,如美髯兰属和美须兰属(Calopogon R. Br.),这在树兰亚科里很少见,因此认为这两个属具有一定的亲缘关系。
5.2 树兰亚科不同花粉团数目和形态的研究进展
树兰亚科的花粉团形态独特,其数目、排列(并列或重叠)、质地(易散或完整)及其附属物等在同一分类群中较为稳定,在族、亚族和属间具有重要的分类系统学意义。花粉团的数目在20 000多种的树兰亚科里差异显著。2个花粉团的特征出现在物种数多达1 300种的指甲兰亚族,包括万代兰属(Vanda Jones ex R. Br.)、指甲兰属(Aerides Lour.)和火焰兰属(Renanthera Lour.)等。4个花粉团普遍见于兰属(Cymbidium Sw.)、石斛属、石豆兰属等。8个花粉团则出现在虾脊兰属(Calanthe R. Br.)、竹叶兰属(Arundina Blume)、鹤顶兰属(Phaius Lour.)等。此外,6个花粉团仅出现在南美分布的Pleurothallidinae亚族,尚未有更多研究资料可供参考。关于树兰亚科的不同数目花粉团的形成及其系统学意义,兰科分类学家提出了一些猜测和推理(Burns-Balogh & Funk, 1986;Dressler, 1993)。其中,最普遍的观点认为花药发育在兰科系统演化种存在着大量的次生融合和退化以及次生分裂和增生等现象。若树兰亚科不同数目的花粉团起始于4个,演化路线则有两种方向,即通过次生融合或缺失形成2个和经次生分裂形成6或8个(Holttum, 1959;Burns-Balogh & Funk, 1986;Dressler, 1986, 1993)。这个观点被普遍接受,其部分原因是考虑到被子植物中最常见的药室或孢子囊数目也是4个(Johr et al., 1992)。同时,也有观点认为树兰亚科花粉团数目的演化路线为单向,既可通过次生分裂递增,从2个逐渐增加为4、6或8个,也可由次生融合或缺失递减,由8个减少为6、4或2个(Pridgeon, 1982)。然而,单向递增和递减的演化路线的推断都基于Pleurothallidinae亚族,该亚族的花粉团数目比较齐全(2、4、6、8)都有,这为物种丰富的树兰亚科花粉团多样性的演化带来了疑问。不过,Pleurothallidinae亚族的分子系统学研究(Neyland et al., 1995)并不支持单向递增或递减的观点。在该亚族的分子系统树上,8个花粉团出现的最早,可以算作祖征;2个或4个花粉团出现的较早,具有平行演化趋势。值得注意的是,上述观点均为根据成熟花药中花粉团的数目结合系统位置进行推断而得出。
现有资料表明,在兰科花药发育过程中,不育隔膜组织的分化和降解对于理解5个亚科不同散粉单元类型的形成至关重要,值得深入研究。在具有单雄蕊的兰亚科和树兰亚科的花药发育过程中,早期花药原基分化出的不育隔膜组织的数目、朝向和位置对花粉小块和花粉团的类型和数目具有决定性作用(Dressler, 1986, 1993;Freudestein & Rasmussen, 1996, 1997, 2002;Kant & Goel, 2013)。这是因为该不育隔膜组织在花药成熟时会发生降解,把成熟花粉囊分割为大小不同(等大或不等大)、數目不等(2、4、8)和形态多样(全缘、孔裂、浅裂、深裂)的散粉单元(Kant & Hossain, 2010;Kant et al., 2013;张锦等,2019;李璐等,2020;谭庆琴等,2020),具体如下。(1)4个花粉团的形成机制较为清楚,揭示了在花药发育早期,每个侧生药室的中央分化出一条贯穿小孢子囊的不育隔膜组织,在后期发生降解,发育为4个花粉团,见于石斛属、原沼兰属(Malaxis Sol. ex Sw.)(Kant & Hossain, 2010)、指甲兰亚族的盖喉兰(Smitinandia micrantha)(Bhanwra et al., 2006)以及兰属的纹瓣兰(Cymbidium pendulum)(Kant et al., 2013)。(2)8个花粉团的形成机制也相对清楚,认为花药原基分化出一对侧生药室,每个药室中的孢原细胞组织分化出2条纵横交错的不育隔膜组织,在花药成熟时发生降解,产生了8个花粉团,见于毛兰属(Eria Lindl.)、矮柱兰属(Thelasis Blume)和牛齿兰属(Appendicula Blume)(Freudestein et al., 1996)以及竹叶兰属(谭庆琴等,2020)。(3)一对全缘、或深裂或浅裂的花粉团形成机制尚存疑问。Freudenstein和Rasmussen(1996)的研究由于缺乏早期花药发育材料,根据成熟花药解剖特征推测2个花粉团是由于每个药室中央分化出不完整且没有贯穿花药室的一条不育隔膜组织,成熟花药发生降解,将每个药室的成熟花粉囊切割为一对深裂或中空的花粉团,见于合萼兰属(Acriopsis Blume)和万代兰族。这一点在纹瓣兰(Cymbidium aloiflolium)的一对深裂花粉团(Bhanwra et al., 2006)和大花万代兰(Vanda coerulea ) (张锦等,2019)的一对浅裂花粉团的发育过程中得到证实。值得注意的是,花粉团的数目和形态特征一直是万代兰族-指甲兰亚族(Vandeae-Aeridinae)类群分类系统重建的重要争议,主要是在同一分支类群里存在着全缘、浅裂或深裂或孔裂的花粉团特征(Dressler, 1986;Chase et al., 2015)。例如,有文献认为巾唇兰属(Pennilabium J. J. Sm.)的花粉团为全缘不裂(陈心启等,1999;Chen et al., 2009),但花药形态发育揭示了解剖镜下看似全缘的花粉团,在组织切片上表现为内侧浅孔裂(李璐等,2020)。因此,有必要从组织切片水平系统地研究指甲兰亚族形态变异较大的属的花粉团特征的发育模式,为其令人费解的系统分类学提供准确的花粉团形态证据。
6兰科花药发育的胚胎学特征
兰科花药发育的胚胎学特征具有显著的多样性和独特性,为散粉单元类型的形成和花药开裂方式提供了形态解剖学资料,也为系统演化提供了证据(Swamy, 1949;Sood, 1986, 1989; Sood & Mohana Rao, 1986, 1988)。這些特征在亚科、族和属间呈现出一定的普遍性和差异性,为理解兰科的胚胎发育多样性和系统演化提供了新证据(Mohana Rao & Sood, 1983, 1984, 1986; Bhanwra & Vij, 2003; Sriyot et al., 2015)。关于兰科可育雄蕊花药发育的研究资料近年来呈增加趋势(Kant & Bhanwra, 2010; Kant & Hossain, 2010; Kant et al., 2013; Gurudeva, 2012, 2015a, b, 2016; 张锦等,2019; 谭庆琴等,2020; 李璐等,2020),研究内容集中在以下4个方面:(1)兰科花药室数目及其发育过程中不育隔膜组织分化的细胞学特征;(2)兰科花药壁发育类型多样,药室内壁纤维性加厚类型的变异、绒毡层细胞核数目等特征;(3)小孢子母细胞减数分裂活动的胞质分裂方式与小孢子四分体排列形式之间的关系;(4)成熟花粉细胞核的数目以及花药开裂时散粉单元的形成机制。现有研究资料表明,花药发育的胚胎学特征在亚科、属和种等分类阶元水平上存在明显的差异,具有一定的分类系统学意义,值得继续积累资料。
6.1 花药室数目的判断
花药发育过程中,不育隔膜组织的分化和降解为有助于理解兰科的花药室数目的系统分类学意义。关于兰科花药室的数目,前人认为与其他被子植物一样,应该为4室(Swamy, 1949; Sood, 1989)。这在拟兰亚科的花药横切面结构里得到证实,拟兰亚科的花药虽具两对侧生花药室,但缺乏不育隔膜组织分化(Kocyan & Endress, 2001),这说明该亚科的起源分化时间较早,可以作为基部类群(Chase et al., 2015)。杓兰亚科的花药室也被记录为4室,不育隔膜组织分化明显,见于白唇杓兰(Cypripedium cordigerum)(Sood & Mohana Rao, 1988)和扇脉杓兰(C. japonicum)(Ghimire et al., 2020)。同时,大部分兰科植物(兰亚科和树兰亚科)均分化为一对侧生药室(Freudenstein & Rasmussen, 1996, 1997, 1999;谭庆琴等,2020;Kant,2023)。
6.2 花药壁发育的多样性
兰科的花药壁发育类型在被子植物里较为独特且多样。被子植物的花药壁层数通常为5层以下,可归为4种花药壁发育类型,包括基本型、单子叶型、双子叶型和简化型(Johri et al., 1992;胡适宜,1992)。现有资料表明,兰科的花药壁多为单子叶型,见于拟兰亚科(Kocyan & Endress, 2001)、杓兰亚科(Swamy, 1949;Ghimire et al., 2020)、兰亚科(Sood, 1986, 1988;Kant & Goel, 2013)和树兰亚科(Sood, 1992;李璐等,2020;Kant,2023)。同时,在一些物种里,花药壁层数6~7层,属于多层型(massive type)花药壁。多层型花药壁首次命名于羊耳蒜属(Liparis L.)(Sood, 1989),后来陆续见于兰属(Cymbidium Sw.)(Kant et al., 2013)、苞舌兰(Spathoglottis plicata)(Sriyot et al., 2015)、美冠兰属(Eulophia R. Br. ex Lindl.)(Bhanwra & Vij, 2003)等。在大花万代兰的花药壁超过7层,高达9层(张锦等,2019)。目前,由于资料较少,花药壁层数及类型在属级以上的分类学意义,尚未有明显的规律。
6.3 小孢子发生中胞质分裂方式多样
小孢子在发生过程中以胞质分裂的方式变化。在兰科花药发育中,同时型胞质分裂比较普遍,见于大部分兰科类群,包括拟兰亚科(Kocyan & Endress, 2001)、杓兰亚科的杓兰属(Sood & Mohana Rao, 1988)、兰亚科的阔蕊兰属(Peristylus Blume)(Gurudeva, 2018)、树兰亚科的天麻(Gastrodia alata)(梁汉兴,1983)、苞舌兰(Sriyot et al., 2015)、三棱虾脊兰(Calanthe tricarinata)(Kant, 2019)、云南巾唇兰(Pennilabium yunnanense)(李璐等,2020)和竹叶兰(谭庆琴等,2020)等。相反,连续型胞质分裂较少,见于兰亚科的眉兰属(Ophrys L.)(Aybeke, 2012)和绶草属(Spiranthes Rich.)(Kant et al., 2013)及树兰亚科的大花万代兰(张锦等,2019)等。关于胞质分裂方式的系统演化意义,已有研究认为同时型胞质分裂较为常见,是被子植物的祖征,而连续型较为少见,属于衍征(Furness et al., 2002)。这与兰科所在的天门冬目(Asparagales)及单子叶植物(Rudall et al., 1997;Furness & Rudall, 1999;Furness et al., 2002)的特征基本一致。
6.4 小孢子四分体排列形式多样
兰科花药发育过程中,小孢子四分体的排列形式多样。被子植物的小孢子四分体排列形式多为正四面体且同种植物仅有1~2种排列方式,极少出现3种以上。然而,兰科花药发育中,小孢子四分体的排列形式极为多样,归纳起来至少有5种,即正四面体、左右对称、十字交叉、T-形、线形。同一个科出现形式多样的四分体排列,这在被子植物中很少见(Johri et al., 1992)。同理,同种植物中,小孢子四分体排列形式至少有2种以上,有的可达4或5种,这在其他被子植物也极为罕见(Johri et al., 1992)。Furness和Rudall(1999)研究认为,单子叶植物中,小孢子四分体的排列形式通常与胞质分裂的方式有关系。然而,现有兰花发育资料并不认同这一点,虽然一种兰花只有一种胞质分裂,小孢子四分体的排列形式通常会有4种以上,但很难将两者联系起来。小孢子四分体多样的排列方式稳定,直接决定了四合花粉的排列形式,构成了不同结构的花粉小块和花粉团(Johri et al., 1992)。小孢子四分体的排列方式基本与花药成熟时四合花粉的排列方式保持一致,这在具有花粉小块的兰亚科(Kant & Bhanwra, 2010; Kant & Goel, 2013)和具坚固花粉团的树兰亚科(Kant, 2019; 王艳萍等,2021)的花粉超微特征中得到证实。
7问题与展望
本文初步归纳了兰科雄蕊发育多样性的研究进展,可归纳为六点。(1)兰科的分子系统学和花形态特征明确支持可育雄蕊数目的减少和花粉愈合程度的增加在五个亚科的系统发育树上明显呈平行演化趋势。(2)蘭科雄蕊数目的减少和功能分化与早期花器官发生过程中存在大量的缺失、退化、次生融合和分裂等密切相关。(3)现有资料揭示了兰科主要的4类散粉单元的花粉超微形态特征在亚科、族、亚族、属和种间差异明显,具有重要的分类学及传粉生物学意义。(4)兰科的黏花粉粒、花粉小块和花粉团的内部花粉黏性物质有3类,即花粉鞘、弹性黏素和其他黏性物质。(5)兰亚科的花粉小块的结构有3类(红门兰型、树兰型和过渡类型),树兰亚科的不同数目(2、4、8)和形态(全缘、浅裂、深裂、孔裂)的花粉团是由于早期花药原基分化出的不育隔膜组织的数目、朝向和位置而形成的。(6)兰科的花药发育过程中,花药室数目、花药壁发育类型、绒毡层细胞核数目、不育隔膜组织分化、胞质分裂类型、小孢子四分体排列形式、花粉细胞核数目等亚科和属间差异明显,具有重要分类学意义。
总体而言,兰科物种多样性丰富,而雄蕊发育特征或形成机制相对清楚的物种较少。虽然在亚科水平上,可育雄蕊和花药散粉单元类型等表现出明显的平行演化趋势,但族、亚族、属和组等分类系统阶元上的雄蕊发育多样性的相关资料却很少,因此值得深究。基于文献梳理,本文认为兰科雄蕊发育可从以下4个方面开展工作:(1)可育雄蕊和退化雄蕊的功能分化模式;(2)单花粉、黏花粉和花粉团等散粉单元的形成机制;(3)花药发育过程中不同花粉团数目和形态的发育模式;(4)花药发育过程中的关键胚胎学特征。
针对兰科雄蕊发育的研究进展和亟待解决的科学问题,本文认为有必要重视以下五个方面的工作。
第一,作为基础研究,有必要扩大选材范围,利用多学科手段,从野外调查收集的生态和生物学资料到实验室多学科技术的综合利用收集的微观形态特征,构建兰科花发育特征的基础数据库,为比较分析亚科、族、亚族和属间的雄蕊数目及花药发育特征提供详实资料。
第二,现有研究资料多集中于树兰亚科和兰亚科以及拟兰亚科,有必要重视均具黏性花粉的杓兰亚科和香荚兰亚科的雄蕊器官发生和花药发育的研究。这两个亚科均处于兰科分类系统树上的次基部类群,对于理解基部类群和核心类群的系统演化起着承前启后的关键作用。具双雄蕊的杓兰亚科植物具有发达的退化雄蕊结构和两枚可育雄蕊,是探究兰科雄蕊器官发生和雄蕊功能分化和发育的好材料。然而,现有研究只观察了3属4种植物的花器官发生(Kurzweil, 1993),缺乏兜兰属的研究资料。此外,现有单雄蕊的香荚兰亚科雄蕊发育研究资料非常少,值得重点关注。
第三,雄蕊可育数目和花药散粉单元类型在亚科水平上具有明显的平行演化趋势,但这两个特征在亚科下的不同类群(族、亚族和属间)表现出一定的特殊性和变异。关于它们的雄蕊功能分化及花药发育的研究资料都不全,值得重点关注。
第四,考虑到花粉形态和超微结构特征在分类学方面的重要作用,本文整理文献后发现兰科不同散粉单元的花粉外壁纹饰资料极为匮乏,散见于个别亚科的物种里,不能系统地揭示其分类系统学意义。建议今后的研究,选择分类系统学争议较大的关键类群,利用扫描电镜系统观察其花粉外壁结构和散粉单元内部结构黏性物质,为系统理解兰科的分类系统提供花粉形态依据。例如,兜兰属和杓兰属的分类系统、山珊瑚属和肉果兰属的属间界限划分被称为分类系统学“黑洞”的指甲兰亚族。
第五,兰科的花器官和雄蕊发育过程中的专业术语的中文名称亟待关注,通过查阅文献统一说法,包括散粉单元类型(黏性花粉团、花粉小块、花粉块、花粉团、花粉团柄)、散粉单元里花粉愈合方式及黏性物质(3个类型)、合蕊柱器官发生过程中出现的附属结构(合蕊柱齿、合蕊柱耳状结构、合蕊柱翅等)、花药发育过程中兰科特有的多层型花药壁类型、不育隔膜组织的细胞特征(内绒毡层、外绒毡层)等。其中,散粉单元类型的专业术语名称,包括花粉小块、花粉团和花粉块已被广泛使用,但其所定义的形态学描述也不准确(Harder & Johnson, 2008)。其他内容的专业术语由于中文研究资料较少,尚未被高度关注或广泛使用。随着研究资料的累积,将会涌现出尚未有中文名称的形态专业术语。如何翻译和使用这些英文术语,也将成为兰科雄蕊发育的研究范畴。因此,本文建议重视兰科特有的花形态特征专业术语中文名称的规范界定和准确描述,为更好地理解兰科雄蕊发育多样性在系统演化和适应性传粉生态学意义提供科学依据。
参考文献:
AYBEKE M, 2012. Anther wall and pollen development in Ophrys mammosa L. (Orchidaceae)[J]. Plant Syst Evol, 298(6): 1015-1023.
BNZIGER H, 1996. The mesmerizing wart: the pollination strategy of epiphytic lady slipper orchid Paphiopedilum villosum (Lindl.) Stein (Orchidaceae)[J]. Bot J Linn Soc, 121(1): 59-90.
BNZIGER H, SUN H, LUO YB, 2005. Pollination of a slippery lady slipper orchid in south-west China: Cypripedium guttatum (Orchidaceae)[J]. Bot J Linn Soc, 148(3): 251-264.
BARONE LUMAGA MR, COZZOLINO S, KOCYAN A, et al., 2014. Exine micromorphology and ultrastructure in Neottieae (Epidendroideae, Orchidaceae)[J]. Plant Syst Evol, 300: 505-515.
BHANWRA RK, VIJ SP, 2003. The development of anther and male gametophyte in Eulophia hormusjii Duthie (Orchidaceae)[J]. J Orchid Society Ind, 17(1/2): 87-91.
BHANWRA RK, VIJ SP, CHANDEL V, et al., 2006. Development of pollinium in two epidendroid orchids[J]. Curr Sci, 90: 1384-1388.
BHUPENDRA C, PRITAM C, NEETU V, et al., 2012. Understanding the phylomorphological implications of pollinia from Dendrobium (Orchidaceae)[J]. Am J Plant Sci, 3(6): 816-828.
BLACKMAN SJ, YEUNG EC, 1983. Structural development of the caudicle of an orchid (Epidendrum)[J]. Am J Bot, 70(1): 97-105.
BLACKMORE S, WORTLEY AH, SKVARLA JJ, et al., 2007. Pollen wall development in flowering plants[J]. New Phytol, 174(3): 483-498.
BOX MS, BATEMAN RM, GLOVER BJ, et al., 2008. Floral ontogenetic evidence of repeated speciation via paedomorphosis in subtribe Orchidinae (Orchidaceae)[J]. Bot J Linn Soc, 157(3): 429-454.
BURNS-BALOGH P, 1983. A theory on the evolution of the exine in Orchidaceae[J]. Am J Bot, 70(9): 1304-1312.
BURNS-BALOGH P, BERNHARDT P, 1985. Evolutionary trends in the androecium of the Orchidaceae[J]. Plant Syst Evol, 149: 119-134.
BURNS-BALOGH P, FUNK VA. 1986. A phylogenetic analysis of the Orchidaceae \[J\]. Smithson Contrib Bot, 61:1-79.
BURNS-BALOGH P, HESSE M, 1988. Pollen morphology of the Cypripedioid orchids[J]. Plant Syst Evol, 158(2): 165-182.
CAMERON KM, 2009. On the value of nuclear and mitochondrial gene sequences for reconstructing the phylogeny of vanilloid orchids (Vanilloideae, Orchidaceae)[J]. Ann Bot, 104(3): 377-385.
CATLING PM, 1990. Auto-pollination in the Orchidaceae[M]//ARDITTI J. Orchid biology: reviews and perspective: Vol. V. Portland, Oregonz: Timber Press: 121-158.
CHASE MW, CAMERON KM, FREUDENSTEIN JV, et al., 2015. An updated classification of Orchidaceae[J]. Bot J Linn Soc, 177(2): 151-174.
CHEN XQ(SC), 1979. Notes on bisexual and unisexual forms of Satyrium ciliatum Lindl.[J]. J Syst Evol, 17(4): 54-60. [陳心启, 1979. 关于缘毛鸟足兰两性型与单性型问题 [J]. 植物分类学报, 17(4): 54-60.]
CHEN XQ(SC), 1982. The orgin and early differentiation of the Orchidaceae[J]. J Syst Evol, 20(1): 1-22. [陈心启, 1982. 关于兰科起源与早期分化的探讨 [J]. 植物分类学报, 20(1): 1-22.]
CHEN XQ(SC), LIU ZJ, LUO YB, et al., 2009. A field guide to the orchids of China[M]. Beijing: China Forestry Publishing House.[陈心启, 刘仲健, 罗毅波, 等, 2009. 中国兰科植物鉴别手册 [M]. 北京: 中国林业出版社.]
CHEN XQ(SC), LIU ZJ, ZHU GH, et al., 2009. Orchidaceae[M]//WU ZY, RAVEN PH, HONG DY. Flora of China. Beijing: Science Press; St. Louis: Missouri Botanical Garden Press, 25: 1-506.
CHESSELET P, LINDER HP, 1993. Pollen morphology of the Diseae (Orchidoideae; Orchidaceae)[J]. Grana, 32(2): 101-110.
DAHLGREN R, BREMER K, 1985. Major clades of the angiosperms[J]. Cladistics, 1(4): 349-368.
DAVIES KL, STPICZYSKA M, KAMISKA M, 2013. Dual deceit in pseudopollen-producing Maxillaria ss (Orchidaceae: Maxillariinae)[J]. Bot J Linn Soc, 173(4): 744-763.
DAVIES KL, TURNER MP, 2004. Pseudopollen in Dendrobium unicum Seidenf.(Orchidaceae): reward or deception?[J]. Ann Bot, 94(1): 129-132.
DECRAENE LPR, SMETS EF, 2001. Staminodes: their morphological and evolutionary significance[J]. Bot Rev, 67(3): 351-402.
DRESSLER RL, 1986. Feature of pollinaria and orchid classification[J]. Lindleyana, 1(2): 125-130.
DRESSLER RL, 1993. Phylogeny and classification of the orchid family[M]. Cambridge: Cambridge University Press.
ENDRESS PK, 2001. Origins of flower morphology[J]. J Exp Zool, 291(2): 105-115.
ENDRESS PK, 2016. Development and evolution of extreme synorganization in angiosperm flowers and diversity: a comparison of Apocynaceae and Orchidaceae[J]. Ann Bot, 117(5): 749-767.
FITZGERALD MA, BARNES SH, BLACKMORE S, et al., 1994. Pollen development and cohesion in a mealy and hard type of orchid pollinium[J]. Int J Plant Sci, 155(5): 481-491.
FREUDENSTEIN JV, CHASE MW, 2015. Phylogenetic relationships in Epidendroideae (Orchidaceae), one of the great flowering plant radiations: progressive specialization and diversification[J]. Ann Bot, 115(4): 665-681.
FREUDENSTEIN JV, HARRIS EM, RASMUSSEN FN, 2002. The evolution of anther morphology in orchids: incumbent anthers, superposed pollinia, and the vandoid complex[J]. Am J Bot, 89(11): 1747-1755.
FREUDENSTEIN JV, RASMUSSEN FN, 1996. Pollinium development and number in the Orchidaceae[J]. Am J Bot, 83(7): 813-824.
FREUDENSTEIN JV, RASMUSSEN FN, 1997. Sectile pollinia and relationships in the Orchidaceae[J]. Plant Syst Evol, 205(3): 125-146.
FREUDENSTEINJV, RASMUSSEN FN, 1999. What does morphology tell us about Orchid relationships?—A cladistic analysis[J]. Am J Bot, 86(2): 225-248.
FURNESS CA, RUDALL PJ, 1999. Microsporogenesis in monocotyledons[J]. Ann Bot, 84(4): 475-499.
FURNESS CA, RUDALL PJ, SAMPSON FB, 2002. Evolution of microsporogenesis in angiosperms[J]. Int J Plant Sci, 163(2): 235-260.
GAMISCH A, STAEDLER YM, SCHONENBERGER J, et al., 2013. Histological and micro-CT evidence of stigmatic rostellum receptivity promoting auto-pollination in the madagascan orchid Bulbophyllum bicoloratum[J]. PLoS ONE, 8: 1-10.
GHIMIRE B, SON S, KIM JH, et al., 2020. Gametophyte and embryonic ontogeny: understanding the reproductive calendar of Cypripedium japonicum Thunb.(Cypripedoideae, Orchidaceae), a lady’s slipper orchid endemic to East Asia[J]. BMC Plant Biol, 20: 1-14.
GURUDEVA MR, 2012. Ontogeny of microsporangium and development of male gametophyte in Habenaria diphylla Dalz[J]. J Orchid Soc Ind, 26(1/2): 93-99.
GURUDEVA MR, 2015a. Ontogeny of microsporangium and development of male gametophyte in Malaxis versicolor (Lindl.) Abeyw (Orchidaceae)[J]. J Indian Bot Soc, 94(3): 195-201.
GURUDEVA MR, 2015b. Ontogeny of microsporangium and development of male gametophyte in Peristylus spiralis A. Rich.(Orchidaceae)[J]. J Orchid Soc Ind, 29: 39-46.
GURUDEVA MR, 2016. Development of male and female gametophytes in Dendrobium ovatum (L.) Kraenzl.(Orchidaceae)[J]. J Orchid Soc Ind, 30: 75-87.
GURUDEVA MR, 2018. Ontogeny of microsporangium and development of male gametophyte in Peristylus plantagineus Lindl[J]. J Orchid Soc Ind, 32: 1-8.
HARDER LD, JOHNSON SD, 2008. Function and evolution of aggregated pollen in angiosperms[J]. Int J Plant Sci, 169(1): 59-78.
HESSE M, BURNS-BALOGH P, 1984. Pollen and pollinarium morphology of Habenaria (Orchidaceae)[J]. Pollen Spores, 26(3/4): 385-400.
HESSE M, BURNS-BALOGH P, WOLFF M, 1989. Pollen morphology of the “primitive” epidendroid orchids[J]. Grana, 28(4): 261-278.
HOLTTUM RE, 1959. Evolutionary trends in the Sarcanthine orchids[J]. Am Orchid Soc Bull, 5: 399-423.
HU SY, 1992. Reproductive biology of angiosperms[M]. Beijing: Higher Education Press. [胡適宜, 1992. 被子植物生殖生物学 [M]. 北京: 高等教育出版社.]
JOHNSON SD, EDWARDS TJ, 2000. The structure and function of orchid pollinaria[J]. Plant Syst Evol, 222(1/2/3/4): 243-269.
JOHRI BM, AMBEGAOKAR KB, SRIVASTAVA PS, 1992. Comparative embryology of angiosperms: Vol.2[M]. Berlin: Springer.
KANT R, BHANWRA RK, 2010. Development of anther in relation to sectile pollinium in Zeuxine strateumatica (Lindl.) Schltr[J]. J Biol Life Sci, 1(1): 5-12.
KANT R, HOSSAIN MM, 2010. Development of pollinium in Malaxis muscifera (Lindl.) Kuntze[J]. Bangladesh J Bot, 39(2): 193-198.
KANT R, 2011. Development of monads and associated changes in anther in Cypripedium cordigerum D. Don.: A rare Orchid[J]. Vegetos, 24(1): 103-110.
KANT R, GOEL S, 2013. Development of anther in Goodyera repens (L.) R. Br.: a massulate orchid[J]. Vegetos, 26(1): 9-18.
KANT R, HOSSAIN MM, ATTRI LK, 2013. Pollinium development in Spiranthes sinensis (Pers.) Ames. and Cymbidium pendulum Sw.: a comparative study[J]. Bangladesh J Bot, 42(2): 307-314.
KANT R, 2019. Development of pollinium and associated changes in anther of Calanthe tricarinata Lindl., an epidendroid orchid[J]. Taiwania, 64(3): 269-279.
KANT R, 2023. Development of anther and sectile pollinium in Herminium lanceum (Thunb. ex Sw.) Vuijk — a massulate orchid[J/OL]. Isr. J. Plant Sci. DOI: 10.1163/22238980-bja10081 (online)
KOCYAN A, ENDRESS PK, 2001. Floral structure and development of Apostasia and Neuwiedia (Apostasioideae) and their relationships to other Orchidaceae[J]. Int J Plant Sci, 162(4): 847-867.
KURZWEIL H, 1987a. Developmental studies in orchid flowers. I: Epidendroid and vandoid species[J]. Nor J Bot, 7(4): 427-442.
KURZWEIL H, 1987b. Developmental studies in orchid flowers Ⅱ: Orchidoid species[J]. Nor J Bot, 7(4): 443-451.
KURZWEIL H, 1996. Floral morphology and ontogeny in subtribe Satyriinae (Fam. Orchidaceae)[J]. Flora, 191(1): 9-28.
KURZWEIL H, 1998. Floral ontogeny of orchids: a review[J]. Beitr Biol Pflanzen, 7: 45-100
KURZWEIL H, 1989. An investigation of the floral morphogenesis of Bonatea speciosa (Orchidaceae)[J]. S Afr J Bot, 55(4): 433-437.
KURZWEIL H, 1990. Floral morphology and ontogeny in Orchidaceae subtribe Disinae[J]. Bot J Linn Soc, 102(1): 61-83.
KURZWEIL H, 1993. Developmental studies in orchid flowers IV: Cypripedioid species[J]. Nord J Bot, 13(4): 423-430.
KURZWEIL H, KOCYAN A, 2002. Ontogeny of orchid flowers [M]//KULL T, ARDITTI J. Orchid biology: reviews and perspectives. Dordrecht, the Netherlands: Kluwer: 83-138.
KURZWEIL H, WESTON PH, PERKINS AJ, 2005. Morphological and ontogenetic studies on the gynostemium of some Australian members of Diurideae and Cranichideae (Orchidaceae)[J]. Telopea, 11(4): 11-33.
KWANTES M, LIEBSCH D, VERELST W, 2012. How MIKC* MADS-box genes originated and evidence for their conserved function throughout the evolution of vascular plant gametophytes[J]. Mol Biol Evol, 29(1): 293-302.
LANG KY, CHEN XQ(SC), LUO YB, et al., 1999. Flora Reipublicae Popularis Sinicae: Vol. 17[M]. Beijing: Science Press.[郎楷永, 陈心启, 罗毅波, 等, 1999. 中国植物志: 第17卷 [M]. 北京: 科学出版社.]
LIANG HX, 1981. The micro- and mega-sporogenesis and the formation of male and female gametophytes in Gastrodia elata Blume[J]. J Integr Plant Biol, 23(3): 186-191. [梁漢兴, 1981. 天麻大小孢子和雌雄配子体的发育 [J]. 植物学报, 23(3): 186-191.]
LI L, ZHANG J, LI CR, et al., 2020. Pollinia development in a new species of Pennilabium yunnanense (Orchidaceae)[J]. Bull Bot Res, 40(2): 161-171. [李璐, 張锦, 李楚然, 等, 2020. 兰科新种巾唇兰的花粉团发育及分类学意义 [J]. 植物研究, 40(2): 161-171.]
LI MH, ZHANG GQ, LAN SR, et al., 2016. A molecular phylogeny of Chinese orchids [J]. J Syst Evol, 54(4): 349-362.
LI P, LUO YB, BERNHARDT P, et al., 2006. Deceptive pollination of the ladys slipper Cypripedium tibeticum (Orchidaceae)[J]. Plant Syst Evol, 262: 53-63.
LI P, LUO YB, DENG YX, et al., 2008. Pollination of the lady’s slipper Cypripedium henryi (Orchidaceae)[J]. Bot J Linn Soc, 156: 451-459.
LUO YB, CHEN XQ(SC), 2000. The floral morphology and ontogeny of some Chinese representatives of orchid subtribe Orchidinae[J]. Bot J Linn Soc, 134(4): 529-548.
LUO YB, ZHU GH, KURZWEIL H, 2005. The gynostemium of Hemipiliopsis purpureopunctata and Senghasiella glaucifolia, two taxonomically disputed species of Habenariinae (Orchidaceae)[J]. Bot J Linn Soc, 147(2): 191-196.
MOHANA RAO PR, RAO KM, 1983. Embryology of Liparis viridiflora [J]. Acta Bot Indica, 11: 228-234.
MOHANA RAO PR, RAO KM, 1984. Embryology of Habenaria pectinata [J]. Phytomorphology, 34: 237-242.
MOHANA RAO PR, SOOD SK, 1986. Embryology of Cephalanthera ensifolia (Orchidaceae)[J]. Acta Bot Ind, 14: 38-44.
MOSQUERA-MOSQUERA HR, VALENCIA-BARRERA RM, ACEDO C, 2019. Variation and evolutionary transformation of some characters of the pollinarium and pistil in Epidendroideae (Orchidaceae)[J]. Plant Syst Evol, 305(5): 353-374.
MULGAONKAR MS, 2011. Study of pollinium of three beautiful Indian Orchids under electron microscopy[J]. Phytotaxonomy, 5: 89-92.
NEYLAND R, URBATSCH LE, PRIDGEON AM, 1995. A phylogenetic analysis of subtribe Pleurothallidinae (Orchidaceae)[J]. Botl J Linn Soc, 117(1): 13-28.
PABN-MORA N, GONZLEZ F, 2008. Floral ontogeny of Telipogon spp.(Orchidaceae) and insights on the perianth symmetry in the family[J]. Int J Plant Sci, 169(9): 1159-1173.
PACINI E, HESSE M, 2002. Types of pollen dispersal units in orchids, and their consequences for germination and fertilization[J]. Ann Bot, 89(6): 653-664.
PACINI E, HESSE M, 2005. Pollenkitt-its composition, forms and functions[J]. Flora, 200 (5): 399-415.
PANDOLFI T, PACINI E, 1995. The pollinium of Loroglossum hircinum (Orchidaceae) between pollination and pollen tube emission[J]. Plant Syst Evol, 196(3/4):141-151.
PASSARELLI LM, ROLLERI CH, 2010. Pollen grains and massulae in pollinia of four south American palustrine species of Habenaria (Orchidaceae)[J]. Grana, 49(1): 47-55.
PERNER H, 2009. Cypripediums in China: part 10: sections Trigonopedia and Sinopedilum[J]. Orchids, 78: 290-297.
PRAMANIK DN, DORST N, MEESTERS M, et al., 2020. Evolution and development of three highly specialized floral structures of bee-pollinated Phalaenopsis species[J]. Evodevo, 11: 1-20.
PRIDGEON AM, 1982. Diagnostic anatomical characters in the Pleurothallidinae (Orchidaceae)[J]. Am J Bot, 69(6): 921-938.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 1999. Genera Orchidacearum: Vol. 1. General introduction, Apostasioideae, Cypripedioideae[M]. Oxford: Oxford University Press.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 2001. Genera Orchidacearum: Vol. 2. Orchidoideae (Part I)[M]. Oxford: Oxford University Press.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 2003. Genera Orchidacearum: Vol. 3. Orchidoideae (Part two), Vanilloideae[M]. Oxford: Oxford University Press.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 2005. Genera Orchidacearum: Vol. 4.Epidendroideae (Part one)[M]. Oxford: Oxford University Press.
PRIDGEON AM, CRIBBPJ, CHASE MW, et al., 2009. Genera Orchidacearum:Vol. 5. Epidendroideae (Part one)[M]. Oxford: Oxford University Press.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 2014. Genera Orchidacearum: Vol. 6. Epidendroideae (Part three)[M]. Oxford: Oxford University Press.
RASMUSSEN FN. 1982. The gynostemium of the neottioid orchids[J]. Opera Bot, 65: 1-96.
RASMUSSEN FN. 1986. Ontogeny and phylogeny in Orchidaceae[J]. Lindleyana, 1: 114-124.
REN L, WANG FX, 1987. Embryological studies of Paphiopedilum godefroyae Stein[J]. J Integr Plant Biol, 29 (1): 14-21.[任玲, 王伏雄, 1987. 兜蘭胚胎学的研究 [J]. 植物学报, 29 (1): 14-21.]
RUDALL, PJ, BATEMAN RM, 2002. Roles of synorganisation, zygomorphy and heterotopy in floral evolution: the gynostemium and labellum of orchids and other lilioid monocots[J]. Biol Rev, 77(3): 403-441.
RUDALL PJ, FURNESS CA, CHASE MW, et al., 1997. Microsporogenesis and pollen sulcus type in Asparagales (Lilianae)[J]. Can J Bot, 75(3): 408-430.
SCHILL R, WOLTER M, 1986. On the presence of elastoviscin in all subfamilies of the Orchidaceae and the homology to pollenkitt[J]. Nord J Bot, 6(3): 321-324.
SHI J, CHENG J, LUO D, et al., 2007. Pollination syndromes predict brood-site deceptive pollination by female hoverflies in Paphiopedilum dianthum (Orchidaceae)[J]. J Syst Evol, 45(4): 551-560.[史军, 程瑾, 罗敦, 等, 2007. 利用传粉综合征预测: 长瓣兜兰模拟繁殖地欺骗雌性食蚜蝇传粉 [J]. 植物分类学报, 45(4): 551-560.]
SINGER RB, GRAVENDEEL B, CROSS H, et al., 2008. The use of orchid pollinia or pollinaria for taxonomic identification[J]. Selbyana, 29(1): 6-19.
SINGER RB, SAZIMA M, 1999. The pollination mechanism in the ‘Pelexia alliance’(Orchidaceae: Spiranthinae)[J]. Bot J Linn Soc, 131(3): 249-262.
SINGER RB, SAZIMA M, 2000. The pollination of Stenorrhynchos lanceolatus (Aublet) L. C. Rich.(Orchidaceae: Spiranthinae) by hummingbirds in southeastern Brazil[J]. Plant Syst Evol, 223: 221-227.
SINGER RB, SAZIMA M, 2001. Flower morphology and pollination mechanism in three sympatric Goodyerinae orchids from southeastern Brazil[J]. Ann Bot, 88(6): 989-997.
SOOD SK, 1986. Gametogenesis, integuments initiation and embryogeny in three species of Habenaria (Orchidaceae, Orchideae)[J]. Proc: Plant Sci, 96: 487-494.
SOOD SK, 1989. Embryology and systematic position of Liparis (Orchidaceae)[J]. Plant Syst Evol, 166(1/2): 1-9.
SOOD SK. 1992. Embryology of Malaxis saprophyta, with comments on the systematic position of Malaxis (Orchidaceae) \[J\]. Plant System Evol, 179: 95-105.
SOOD SK, MOHANA RAO PR, 1986. Development of male and female gametophytes in Herminium angustifolium (Orchidaceae)[J]. Phytomorphology, 36: 11-15.
SOOD SK, MOHANA RAO PR, 1988. Studies in the embryology of the diandrous orchid Cypripedium cordigerum (Cypripedieae, Orchidaceae)[J]. Plant Syst Evol, 160(3/4): 159-168.
SRIYOT N, THAMMATHAWORN A, THEERAKULPISUT P, 2015. Embryology of Spathoglottis plicata Blume: a reinvestigation and additional data[J]. Trop Natl Hist, 15(2): 97-115.
STERN WL,CHEADLEVI,THORSCHJ, 1993. Apostasiads, systematic anatomy, and the origins of Orchidaceae[J]. Bot J Linn Soc, 111(4): 411-455.
STENZEL H, 2000. Pollen morphology of the subtribe Pleurothallidinae Lindl.(Orchidaceae)[J]. Grana, 39(2/3): 108-125.
SWAMY BGL, 1949. Embryological studies in the Orchidaceae. I. Gametophytes[J].Am Midl Nat, 41(1): 184-201.
TAN QQ, LI L, ZHANG J, et al., 2020. Pollinia development in Arundina graminifolia (Orchidaceae) with taxonomic implications[J]. Guihaia, 40(1): 83-94. [譚庆琴, 李璐, 张锦, 等, 2020. 传统傣药竹叶兰的花粉团发育及分类学意义 [J]. 广西植物, 40(1): 83-94.]
TAO KF, ZHU Y, WANG YC, et al., 2023. Floral structure andcolumn ultrastructure of two Habenaria species with their taxonomic implications[J/OL]. Guihaia: 1-15 [2023-08-08] http://kns.cnki.net/kcms/detail/45.1134.Q.20230621.1730.002.html.[陶凯锋,朱永,王乐骋, 等, 2023. 两种玉凤花属植物的花结构和合蕊柱超微特征及其分类学意义 [J/OL]. 广西植物: 1-15 [2023-08-08] http://kns.cnki.net/kcms/detail/45.1134.Q.20230621.1730.002.html.]
VALENCIA-NIETO B, SOSA V, MRQUEZ-GUZMN J, 2016. Late stages of anther development and anther attributes in Microepidendrum differs from other genera of Epidendrum alliance (Orchidaceae)[J]. Flora, 218: 35-43.
VAN DER CINGEL NA, 1995. An atlas of orchid pollination: European orchids [M]. Boca Raton: CRC Press.
VERMEULEN P, 1965. The place of Epipogium in the system of Orchidales [J]. Acta Bot Neer, 14(2): 230-241.
WANG YP, LI L, YANG CX, et al., 2021. Pollinia morphology of 14 species in Dendrobium (Orchidaceae) and taxonomic significance[J]. Bull Bot Res, 41(1): 12-25. [王艳萍, 李璐, 杨晨璇, 等, 2021. 14种石斛属(兰科)植物的花粉团形态及分类学意义 [J]. 植物研究, 41(1): 12-25.]
XI YZ, LANG KY, HU YS, 2000. Pollen morphology of Gymnadenia R. Br. (Orchidaceae) and its taxonomic significance[J]. J Syst Evol, 38(2): 137-140. [席以珍, 郎楷永, 胡玉熹, 2000. 手参属花粉形态及其分类学意义 [J]. 植物分类学报, 38(2): 137-140.]
YEUNG EC, 1987. The development and structure of the viscidium in Epidendrum ibaguense H.B.K. (Orchidaceae)[J]. Bot Gazette, 148(2): 149-155.
ZAVADA M, 1990. A contribution to the study of pollen wall ultrastructure of orchid pollinia[J]. Ann Miss Bot Garden, 77: 785-801.
ZHANG J, ZHANG H, LI L, et al., 2019. Pollinia development in rare orchid of Vanda coerulea with its taxonomic implications[J]. Acta Bot Boreal-Occident Sin, 39(7): 1143-1153.[張锦, 张辉, 李璐, 等, 2019. 珍稀濒危植物大花万代兰的花粉团发育及其分类学意义 [J]. 西北植物学报, 39(7): 1143-1153.]
ZHENG G, LI P, PEMBERTON R,et al., 2011. Mixed bumblebee and blowfly pollination of Cypripedium flavum (Orchidaceae) in Sichuan, China[J]. Ecol Res, 26: 453-459.

