水氮调控对棉花生理性状及产量的影响*
孟妍君,马鑫颖,宋晨,孙红春,刘连涛,张科,张永江,白志英**,李存东**
(1.河北农业大学生命科学学院 保定 071000;2.华北作物改良与调控国家重点实验室/河北省作物生长调控重点实验室/河北农业大学农学院 保定 071000)
水分是限制植物生长发育和产量的主要环境因子之一。干旱胁迫诱使植物体内产生过氧化物反应,导致细胞中活性氧的产生与消除失去平衡,形成氧化胁迫,细胞膜受到损坏,膜脂过氧化产物丙二醛(MDA)含量增加[1]。植物可在超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等抗氧化酶的协调作用下,有效地清除对植物细胞有害的活性氧自由基,降低MDA 含量,从而减轻植物受到的伤害[2]。光合作用是植物生长发育和植物体内碳素的重要来源,叶绿素含量是光合作用的基础,叶绿素荧光参数是探讨光合作用的有效探针[3]。研究发现,干旱胁迫导致植物叶片气孔关闭,蒸腾降低,叶绿素荧光参数下降,光合能力减弱[3-4]。王允[5]发现,随着干旱胁迫程度加重,棉花(Gossypium herbaceumL.)叶片叶绿素含量降低,生长受到抑制。干旱胁迫可引起植株主根伸长,侧根变短,导致株高、茎粗、叶面积下降,从而降低产量[6-8]。
氮是植物必需的大量矿质元素,低氮胁迫严重影响植物的抗氧化酶系统,抑制根系伸长,降低平均根直径,影响植物对氮素的吸收效率,导致生长速度缓慢[9];而过量施用氮肥,导致植株旺长,生殖器官积累量降低[10];适宜增加施氮量可提高POD、CAT 活性和叶绿素含量,增强光合能力,提高产量[11]。硝酸还原酶(NR)和谷氨酰胺合成酶(GS)是植物中参与氮代谢的关键酶。NR 可将植物根系吸收的硝酸盐还原成亚硝酸盐,然后经亚硝酸还原酶还原成铵离子,铵离子经过GS 途径转化为氨基酸。研究发现,随着氮肥施用量的增加,叶片的NR 和GS 活性增强,提高了氮代谢能力[12-13]。
水分和氮肥均是影响植物生长发育的关键因子,水分和肥料之间可产生耦合效应,实现以肥调水和以水促肥[14]。相关研究表明,干旱胁迫下,棉花株高、叶面积和单株棉花产量随着施氮量的增加而增加[15]。干旱胁迫下NR 活性受到抑制,适量增加施氮量可提高植株中的抗氧化酶活性及氮代谢酶活性,促进生长发育,提高产量[16];在低氮胁迫下,增加灌水量亦可提高植株中的光合能力,增加单粒重和单粒株数,从而提高了产量[17]。
棉花是我国重要的经济作物之一,在世界经济发展过程中亦具有重要作用。但目前农业用水资源短缺、氮肥施用过量以及随之带来的土壤酸化等生态环境问题,严重阻碍了棉花高产、优质、减施水肥等目标的实现。目前国内外学者对水分和氮素单一因素对棉花的影响进行了大量研究,但是二者对棉花生长发育的耦合调控效应报道较少。因此,本研究以‘农大棉36 号’为材料,研究水分和氮素调控下棉花地上部和根系形态、叶片光合性状、抗氧化酶活性、氮代谢酶活性以及产量的变化,为棉花的合理灌溉和施氮提供理论依据。
1 材料与方法
1.1 试验材料
材料采用‘农大棉36 号’(冀中棉区高产、转基因抗虫品种),由河北农业大学培育。
1.2 试验设计
试验于2021-2022 年在河北农业大学科研大楼智能气候室进行,室内昼夜温度为28 ℃/25 ℃,14 h/10 h昼夜循环,相对湿度45%~50%,光强300 μmol·mol-1。利用直径为22 cm、高50 cm 的PVC 圆桶进行盆栽试验,每个容器装土15.5 kg。土壤选用深层土,其中有机质含量为3.68 g·kg-1、碱解氮20.14 mg·kg-1、有效磷8.80 mg·kg-1、速效钾139.17 mg·kg-1、全氮0.28 g·kg-1,pH 8.07。土壤风干后过20 目筛。在每个容器中施加磷70 mg(P)·kg-1和钾14 mg(K)·kg-1,分别使用过磷酸钙和氯化钾作为磷和钾的来源,所有肥料均被磨碎并过20 目筛。磷肥和钾肥作为基肥施入。
利用盆栽控水方法模拟干旱胁迫。设置两个水分处理(干旱,相对含水量为45%±5%,W1;正常供水,相对含水量[18]为70%±5%,W2)及3 个氮素水平[0 mg(N)·kg-1(N0);低 氮,69 mg(N)·kg-1(N1);常规施氮[9],138 mg(N)·kg-1(N2)],共6 个处理,即干旱不施氮肥(W1N0)、干旱低氮(W1N1)、干旱常规施氮(W1N2)、正常供水不施氮肥(W2N0)、正常供水低氮(W2N1)以及正常供水常规施氮(W2N2),每个处理12 次重复,供试氮肥为尿素。

表1 水分和氮素调控对棉花相对叶绿素含量(SPAD)的影响Table 1 Effects of water and nitrogen regulation on relative chlorophyll content (SPAD) of cotton
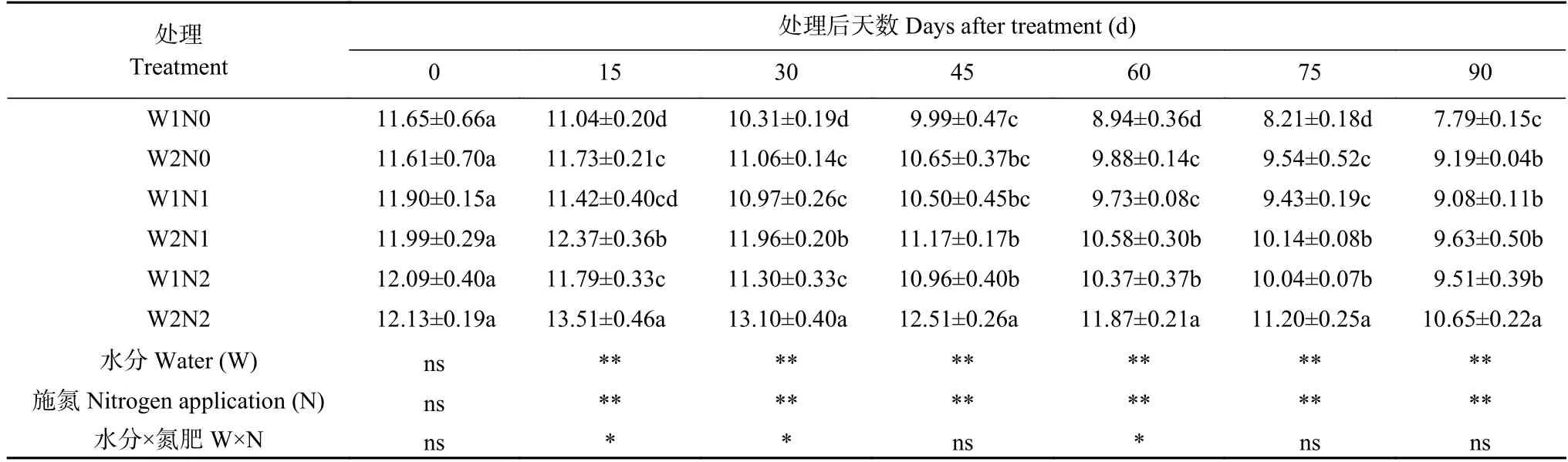
表2 水分和氮素调控对棉花净光合速率的影响Table 2 Effects of water and nitrogen regulation on net photosynthetic rate of cotton μmol·m-2·s-1
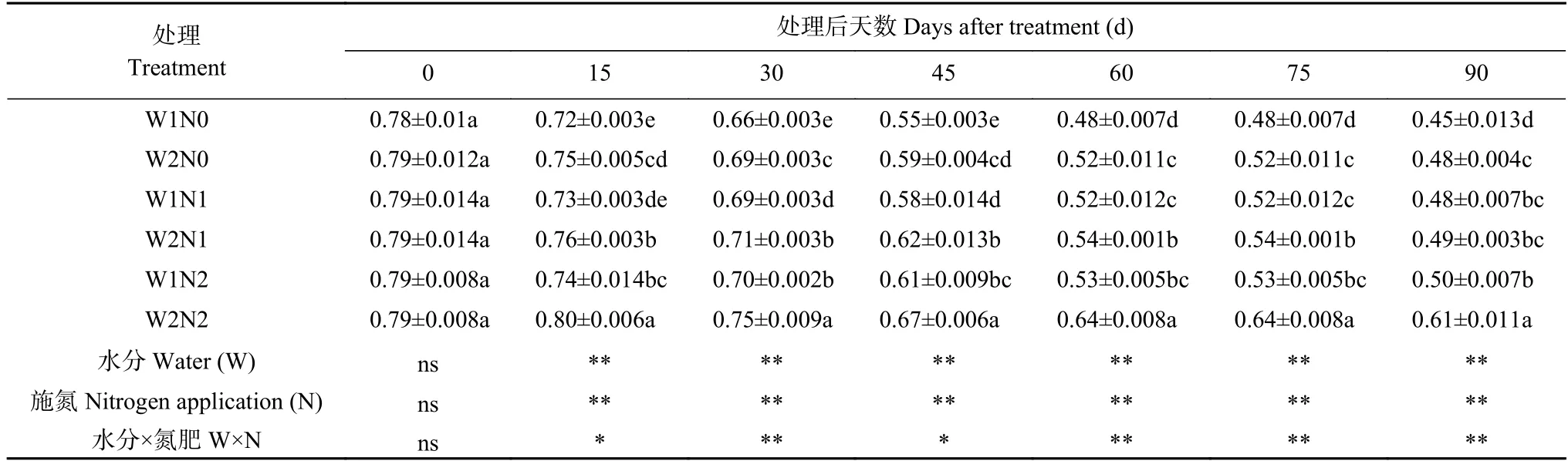
表3 水分和氮素调控对棉花PSⅡ反应中心光能转换效率(Fv/Fm)的影响Table 3 Effects of water and nitrogen regulation on light energy conversion efficiency of PSⅡ reaction center (Fv/Fm) of cotton
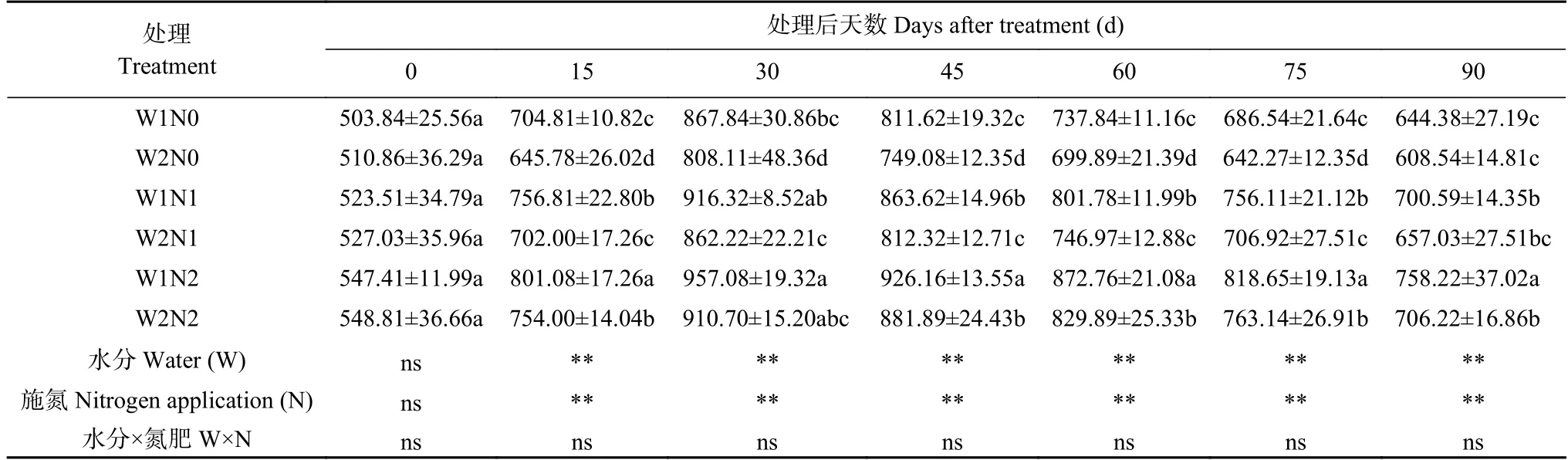
表4 水分和氮素调控对棉花超氧化物歧化酶(SOD)活性的影响Table 4 Effects of water and nitrogen regulation on superoxide dismutase (SOD) activity of cotton U·g-1(FW)

表5 水分和氮素调控对棉花过氧化物酶(POD)活性的影响Table 5 Effects of water and nitrogen regulation on peroxidase (POD) activity of cotton U·mg-1(FW)
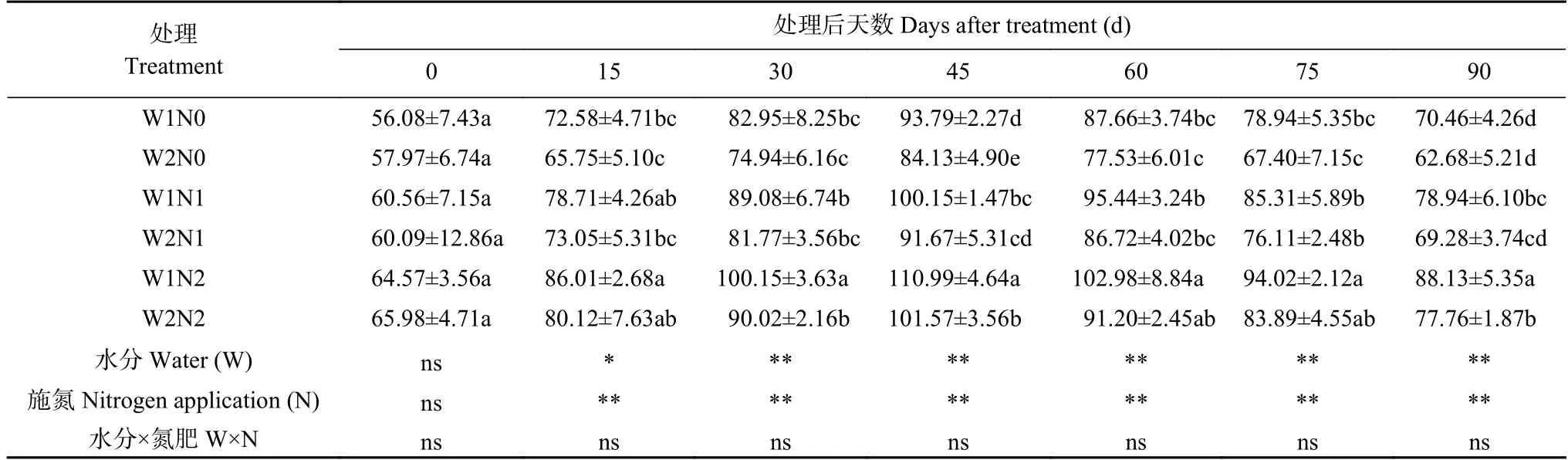
表6 干旱胁迫和氮素调控对棉花过氧化氢酶(CAT)活性的影响Table 6 Effects of water and nitrogen regulation on catalase (CAT) activity of cotton U·mg-1(protein)
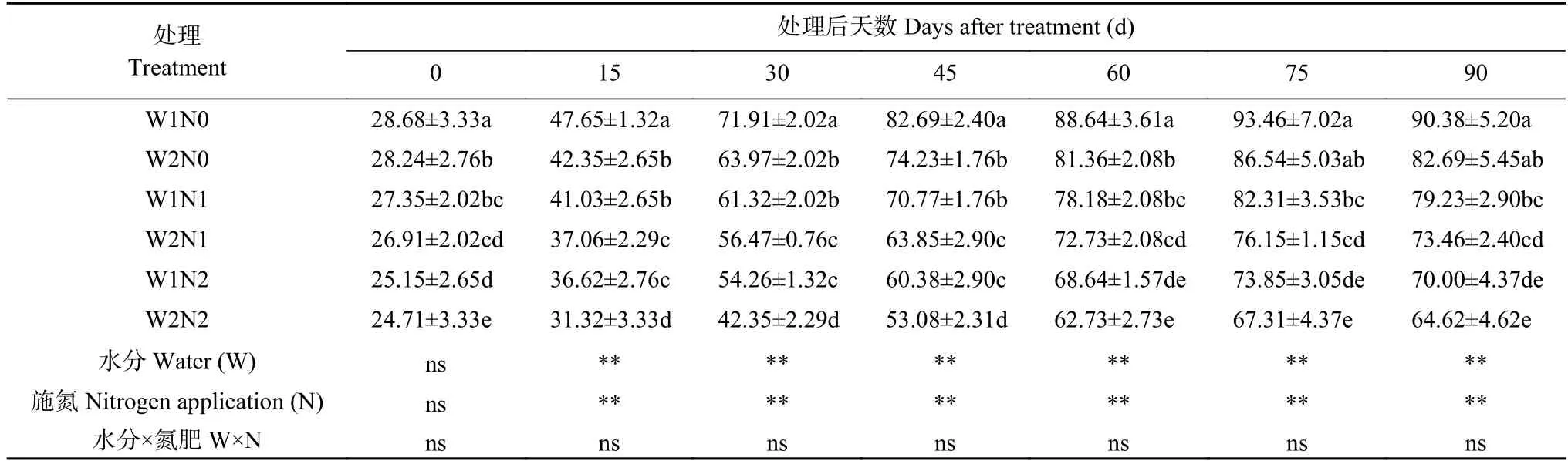
表7 水分和氮素调控对棉花丙二醛(MDA)含量的影响Table 7 Effects of water and nitrogen regulation on malondialdehyde (MDA) content of cotton μmol·g-1(FW)
播种棉花之前,不同氮素处理所需的肥料作为基肥施入,后期不再施肥。待棉花长至4 叶一心时进行干旱处理并直至成熟收获。每隔1 周浇水1 次,浇水前进行称重,以确定浇水量,并及时补水到设定土壤含水量。
1.3 测定指标及方法
在干旱处理0 d、15 d、30 d、45 d、60 d、75 d和90 d 时选取3 株长势均匀的棉花进行地上形态和生理指标测定,根系形态和产量在收获后进行测定分析。
1.3.1 形态指标测定
株高: 利用直尺测量棉花子叶节到生长点的高度;茎粗: 利用游标卡尺测量子叶节上1 cm 的茎直径;叶面积: 利用直尺测量全株叶片长度和宽度,采用长宽系数法(叶面积=0.75×最大长度×最大宽度)计算全株叶面积;根系形态测定: 于棉花收获后,将根系冲洗干净后,无重叠摆放于含1 cm 深水的亚克力透明盒中,采用爱普生扫描仪(EPSON-V700,日本)对根系进行扫描(600 dpi)。用WinRHIZO 软件分析(WinRHIZOREG2009,加拿大)根系图片,获取根长、根表面积和根直径。
1.3.2 生理指标测定
相对叶绿素含量采用SPAD-502 叶绿素计测定棉花主茎倒四叶的相对叶绿素含量(SPAD 值)。利用LI-6800 便携式光合仪测定系统对棉花主茎倒四叶进行测定,设置光强为300 μmol·m-2·s-1,CO2浓度为400 μmol·mol-1,于上午9:00-11:00 测定净光合速率。叶绿素荧光参数采用PAM-2500 便携式叶绿素荧光仪测定。
测定棉花主茎倒四叶的各指标。SOD 活力测定采用WST-1 法;POD 活力测定采用愈创木酚法[19];CAT 活力测定采用钼酸铵法;MDA 含量测定采用TBA法[20];谷氨酰胺合成酶活性测定参照Zhang 等[21]的方法,以单位μmol·g-1(FW)·h-1表示;硝酸还原酶(NR)活性测定参照刘洁等[22]的方法,以单位μmol·g-1(FW)·h-1表示。
1.3.3 棉花产量测定
吐絮后,收集植株中的所有棉铃,记录籽棉重量。
1.4 数据处理
采用Microsoft Excel 2010 进行数据统计和整理,采用DPS 9.50 软件进行双因素分析,用LSD 法比较处理间在P<0.05 水平的差异显著性。采用Graph-Pad Prism 8.0 进行作图分析。
2 结果与分析
2.1 水分和氮素调控对棉花植株形态的影响
2.1.1 对棉花地上部形态的影响
株高、茎粗以及叶面积是反映植株生长发育的形态指标。由图1 可知,株高和茎粗均随棉花生长呈现逐渐增长的变化趋势。干旱对棉花株高与茎粗的影响显著,不同氮肥水平间差异显著,总体变化趋势为N2>N1>N0,但二者交互作用对株高与茎粗均无显著影响。
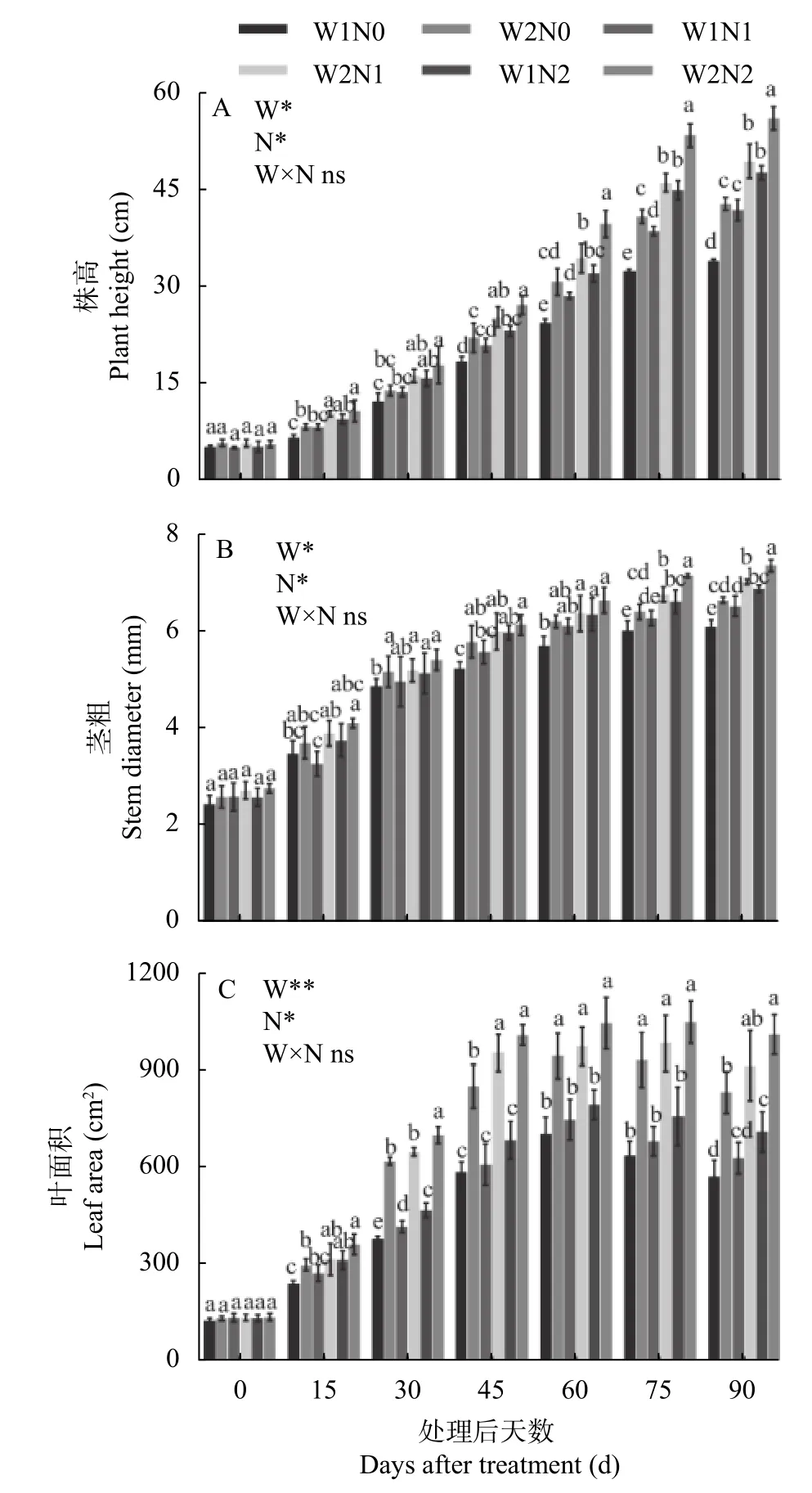
图1 水分和氮素对棉花株高(A)、茎粗(B)以及叶面积(C)的影响Fig.1 Effects of water and nitrogen regulation on plant height(A),stem diameter (B) and leaf area (C) of cotton
由图1A 可知,W1 处理显著降低了棉花的株高;株高随着施氮量的增加而升高。干旱处理15 d、30 d,W1 与W2 处理间株高无显著差异,N2 处理显著高于N0 处理。处理60~90 d,W1 与W2 处理间株高差异显著,W1 处理显著降低了棉花株高;不同氮肥之间差异显著,N0 和N1 处理均显著降低了棉花株高。处理90 d,W2N2 处理棉花株高最高,为55.97 cm,比W1N2 处理显著提高17.51%;W2N1 比W1N1 处理显著提高18.10%,W2N0 比W1N0 处理显著提高26.14%。而W1N0 处理株高最低,为33.93 cm,分别比W1N1、W1N2 处理显著降低18.89%、28.76%,表明干旱和低氮胁迫显著降低了棉花株高,干旱胁迫下增施氮肥、低氮下增加灌水量可以促进棉花株高增加。
由图1B 可知,W1、N0 和N1 处理显著降低棉花的茎粗。处理后15 d 和30 d,各处理间茎粗并未出现显著差异。处理45 d,在水分处理一致时,W1N0显著低于W1N2 处理;氮素处理一致时,W1N0 显著低于W2N0 处理。处理75 d、90 d,W1 处理下的茎粗明显低于W2 处理,不同氮肥处理间差异显著,表现为N2>N1>N0。处理90 d,W2N2 处理的茎粗最粗,为7.36 cm,比W1N2 处理显著增加6.98%;而W1N0的茎粗最低,为6.09 cm,分别比W1N1 和W1N2 显著降低6.60%和11.48%。
由图1C 可知,不同处理下棉花叶面积均呈现先增后降的趋势,干旱对叶面积影响极显著,不同氮肥水平对叶面积影响显著,但二者交互作用对叶面积影响并不显著。处理60 d 后,W1 处理的叶面积开始下降;处理75 d 后,W2 处理叶面积开始下降。处理15 d,N0 处理的叶面积显著低于N2 处理,W1N0 显著低于W2N0。处理30 d,W2N2 处理的叶面积显著高于N0 和N1 处理;W1 处理下,各氮肥水平间差异显著,即N2>N1>N0;与W2 相比,W1 处理显著抑制叶面积增加。处理45 d、60 d、75 d,各氮素之间差异不显著,W1 与W2 之间差异显著。处理90 d,W1处理叶面积显著低于W2 处理,N0 与N2 之间差异显著;W2N2 处理的叶面积最大,为1014.13 cm2,比W1N2 处理显著增加42.16%;W2N1 比W1N1 处理显著提高45.32%,W2N0 比W1N0 处理显著提高45.34%;而W1N0 处理的叶面积最小,为575.38 cm2,分别比W1N1、W1N2 处理显著降低8.94%、19.34%。由此可知,干旱和低氮胁迫显著降低了棉花叶面积,但干旱下增加氮肥、低氮下增加灌水量却促进了棉花叶面积的增加。
2.1.2 对棉花根系形态的影响
根系是棉花吸收水分养分的重要器官。如图2所示,水分和氮素对棉花总根长、总根表面积以及根平均直径均产生了显著影响,但二者交互作用却无显著影响。分析图2A 可知,与N2 相比,N0 和N1处理显著降低了棉花总根长(W2N1 除外);与W2 相比,W1 处理抑制了棉花总根长的伸长(N2 水平下两处理差异不显著),W1N0 比W2N0 显著降低24.93%,W1N1 比W2N1 显著降低16.56%,W1N2 比W2N2降低12.20%。W1 处理下,W1N2 总根长最长,比W1N1 显著增加20.91%,比W1N0 显著增加74.45%。由图2B 可知,与N2 相比,N0 处理显著降低了棉花总根表面积;W1N0 的总根表面积比W2N0 显著降低21.32%,W1N1 比W2N1 显著降低13.16%,W1N2比W2N2 降低8.24%。W1 处理下,W1N2 总根表面积最大,比W1N1 显著增加15.57%,比W1N0 显著增加62.91%,W1N1 比W1N0 显著增加40.96%。分析图2C 可知,与N2 相比,N0 处理显著降低了棉花平均根直径;与W2 相比,W1 处理显著降低了平均根直径,W1N0 比W2N0 显著降低23.53%,W1N1 比W2N1 显著降低16.67%,W1N2 比W2N2 显著降低13.16%。由此可知,干旱以及低氮处理均降低了棉花的总根长、总根表面积以及平均根直径;在干旱胁迫下,棉花的总根长、总根表面积以及平均根直径随着施氮量的增加而增加;在低氮胁迫下,棉花的总根长、总根表面积以及平均根直径随着灌水量的增加而增大,表明在干旱胁迫下增施氮肥有助于改善棉花根系形态,在低氮环境下常规灌溉亦能改善棉花根系形态。

图2 水分和氮素调控对棉花总根长(A)、总根表面积(B)以及平均根直径(C)的影响Fig.2 Effects of water and nitrogen regulation on total root length (A),total root surface area (B) and average root diameter (C) of cotton
2.2 水分和氮素调控对棉花光合特性的影响
由表1 可知,水分、氮素和二者交互作用均对SPAD 产生显著抑制效应。随着处理时间延长,各处理棉花SPAD 均呈先升后降趋势。其中W1 处理在处理15 d 后开始下降,W2 处理在处理30 d 后开始下降。处理15~90 d,与W2 处理相比,W1 处理显著降低棉花SPAD;与N2 相比,N1、N0 处理显著降低,且N0 抑制作用大于N1。处理90 d,W2N2 处理的SPAD 最大,比W1N2 处理显著增加20.51%;W2N1比W1N1 处理显著提高40.20%,W2N0 比W1N0 处理显著提高39.84%;而W1N0 处理的SPAD 最小,分别比W1N1、W1N2 处理显著降低22.90%、41.53%。由此可知,干旱和低氮胁迫显著降低了棉花SPAD,但干旱下增加氮肥、低氮下增加灌水量均促进了棉花SPAD 的增加。
由表2 可知,水分和氮素处理显著影响了棉花净光合速率,且二者交互作用亦影响显著。随处理时间的延长,W1 处理下净光合速率呈下降趋势;W2 处理下净光合速率呈先增后降的趋势,0~15 d 增加,30 d开始下降。处理15 d、30 d、60 d、75 d,与W2 处理相比,W1 处理显著降低了棉花光合速率;与N0 相比,N1 和N2 在大部分时间显著促进了棉花净光合速率的增高。处理90 d,W2N2 处理的净光合速率最高,比W1N2 处理显著增加11.99%;W2N1 处理比W1N1 处理显著增加6.06%,W2N0 比W1N0 处理显著提高17.97%;而W1N0 净光合速率最低,分别比W1N1、W1N2 处理显著降低14.21%、18.09%。表明干旱和低氮胁迫抑制棉花净光合速率,但干旱下增施氮肥、低氮下增加灌水量均可促进棉花光合作用增强。
由表3 可知,水分和氮素以及二者交互作用均对光能转换效率(Fv/Fm)产生显著影响。随处理时间延长,W2N2 处理呈现先增长后下降的趋势,其余处理Fv/Fm均呈下降趋势。处理15 d,除W2N2 处理外,其他处理的Fv/Fm开始下降;处理30 d,W2N2 处理的Fv/Fm开始下降。处理15~75 d,与W1 相比,W2 处理
显著增加了Fv/Fm;各氮素水平之间亦出现显著差异,表现为N2>N1>N0。处理90 d,W2N2 处理的Fv/Fm最高,比W1N2 处理显著增加22.00%;W2N1 处理比W1N1 处理显著增加2.08%,W2N0 比W1N0 处理显著提高6.67%;而W1N0 处理的Fv/Fm最低,分别比W1N1 和W1N2 处理显著降低6.25%和10.00%。表明干旱和低氮胁迫抑制Fv/Fm,但干旱下增施氮肥、低氮下增加灌水量均可提高棉花PSⅡ反应中心的光能转换效率。
2.3 水分和氮素调控对棉花抗氧化酶活性和丙二醛含量的影响
2.3.1 对超氧化物歧化酶(SOD)活性的影响
由表4 可知,水分和氮素对棉花SOD 活性均产生了显著影响,但二者的交互作用并不显著。随着处理时间的延长,棉花叶片的SOD 活性呈现先升后降的趋势,处理30 d 出现最大值。处理15~75 d,各处理差异显著,且规律基本一致,即W1 处理的SOD活性高于W2 处理,N2>N1>N0。处理90 d,W1N2 处理的SOD 活性最高,比W2N2 处理显著增加7.36%;W1N1 处理比W2N1 处理增 加6.63%,W1N0 比W2N0 处理提高5.89%。W2N0 处理的SOD 活性最低,分别比W2N1、W2N2 处理降低7.38%、13.83%。由此得知,干旱胁迫可导致棉花SOD 活性增加,用来清除棉花体内多余活性氧,促使棉花适应干旱胁迫。
2.3.2 对过氧化物酶(POD)活性的影响
由表5 可知,水分和氮素均对棉花POD 活性产生了显著影响,但二者交互作用并不显著。随着处理时间的延长,POD 活性与SOD 变化趋势基本一致,均呈现先增加后下降的趋势,处理30 d 出现最大值。处理45 d、60 d,N0 处理的POD 活性显著低于N2处理。处理75 d,各处理间存在显著差异。处理90 d,W1N2 处理的POD 活性最高,比W2N2 处理增加7.24%;W1N1 处理比W2N1 处理增加11.21%,W1N0比W2N0 处理显著提高14.34%。W2N0 处理的POD活性最低,分别比W2N1、W2N2 处理降低10.09%、22.67%;表明干旱胁迫下,棉花提高POD 活性以缓解干旱造成的损伤。
2.3.3 对过氧化氢酶(CAT)活性的影响
由表6 可知,水分和氮素均对棉花CAT 活性产生了显著影响,但二者交互作用并不显著。随着处理时间的延长,各处理CAT 活性呈现先增后降的趋势,处理45 d 出现最高值。处理15 d、30 d,N0 显著低于N2 处理。处理45 d,W1 处理的CAT 活性显著高于W2 处理;各氮素之间差异显著,表现为N2>N1>N0。处理60 d,W1 处理下N2 显著高于N1 和N0 处理;W2 处理下,N2 显著高于N0 处理。处理90 d,W1N2 处理CAT 活性最高,比W2N2 处理显著增加13.34%;W1N1 处理比W2N1 处理提高13.94%,W1N0 比W2N0 处理提高12.41%。W2N0 处理CAT活性最低,分别比W2N1 和W2N2 处理降低9.53%和19.39%。
2.3.4 对丙二醛(MDA)含量的影响
由表7 可知,干旱和氮素均会对棉花MDA 含量产生显著影响,但二者交互作用并不显著。随处理时间延长,MDA 含量呈先增后降的趋势,处理75 d出现最高值。处理15~45 d,与W1 相比,W2 处理MDA含量显著降低;各氮素水平间表现为N0>N1>N2,处理75 d 各氮素处理间差异显著。处理90 d,MDA变化趋势与处理75 d 一致;W1N0 处理MDA 含量最高,比W2N0 处理增加9.30%;W1N1 处理比W2N1处理增加7.85%,W1N2 比W2N2 处理提高8.33%。W2N2 处理MDA 含量最低,分别比W2N0、W2N1处理显著降低21.85%、12.03%。表明干旱、零氮以及减氮均可提高棉花叶片的MDA 含量,但干旱下增施氮肥、低氮增加灌水量均降低了棉花叶片的MDA 含量,可缓解干旱以及低氮对棉花造成的氧化损伤。
2.4 水分和氮素调控对棉花氮代谢关键酶活性的影响
谷氨酰胺合成酶活性(GS)和硝酸还原酶活性(NR)是参与植物体内氮代谢的关键酶,其活性反映了植物对氮素的吸收状况。如图3A 所示,水分和氮素对棉花GS 活性均产生了显著影响,但二者交互作用对GS 活性影响并不显著。GS 活性随处理时间的延长呈先增后降的趋势,处理45 d 出现最高值。处理15 d,与N0 相比,N2 处理显著升高了GS 活性。处理30 d、45 d、75 d,W1 处理的GS 活性低于W2 处理,N0 处理的GS 活性显著低于N2 处理。处理90 d,W2N2 处理的GS 活性最高,为13.59 μmol·g-1(FW)·h-1,比W1N2 处理增加30.42%;W2N1 比W1N1 处理提高14.63%,W2N0 比W1N0 处理提高63.77%。而W1N0 处理的GS 活性最低,为5.30 μmol·g-1(FW)·h-1,分别比W1N1、W1N2 处理显著降低44.21%、49.14%。由此可知,干旱和低氮胁迫处理降低了棉花GS 活性,但干旱下GS 活性随着施氮量的增加而提高,低氮胁迫下GS 活性随着灌水量的增加而提高。
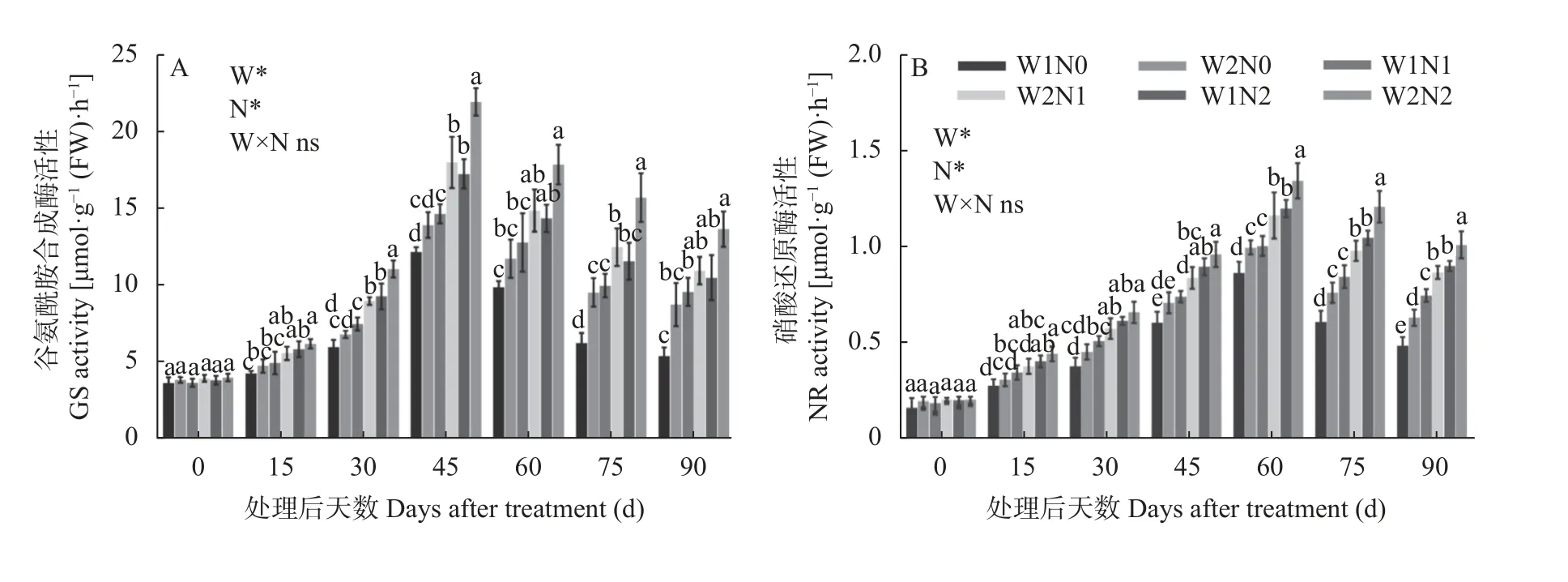
图3 水分和氮素调控对棉花谷氨酰胺合成酶活性(A)和硝酸还原酶活性(B)的影响Fig.3 Effects of water and nitrogen regulation on activities of glutamine synthetase (GS,A) and nitrate reductase (NR,B) in cotton
如图3B 所示,水分和氮素对棉花NR 活性均产生了显著影响,但二者交互作用对NR 活性影响并不显著。各处理的NR 活性随着棉花生育时期进行呈现先增后降的趋势,处理60 d 出现峰值。处理15~45 d,水分对NR 活性未产生显著影响,N0 与N2 之间差异显著。处理60~90 d,W1 处理NR 活性显著低于W2 处理;N0 和N1 处理NR 活性显著低于N2处理。处理90 d,W2N2 处理的NR 活性最高,为1.01 μmol·g-1(FW)·h-1,比W1N2 处理显著增加12.22%;W2N1 比W1N1 处理显著提高16.00%,W2N0 比W1N0 处理显著提高31.25%。而W1N0 处理的NR活性最低,为0.48 μmol·g-1(FW)·h-1,分 别比W1N1、W1N2 处理显著降低36.00%、46.67%。因此,干旱和低氮胁迫处理降低了棉花NR 活性;但干旱下增施氮肥、低氮下增加灌水量促进了NR 活性增强。
2.5 水分和氮素调控对棉花产量的影响
由图4 可知,水分和氮素对棉花产量产生了显著影响,且二者交互作用对产量亦有显著影响。不同处理下,W2N2 产量最高,为34.42 g·株-1,W1N0 最低,为11.00 g·株-1。W2 处理下,不同氮肥处理之间差异显著,与W2N0 相比,W2N1 与W2N2 分别增加44.32%、133.99%。W1 处理下,不同氮肥处理之间差异显著,与W1N0 相比,W1N1 与W1N2 分别增加38.73%、111.64%,表明增施氮肥提高了干旱胁迫下的棉花产量。W2N0 比W1N0 增加33.73%,W2N1比W1N1 增加39.12%,W2N2 比W1N2 增加47.85%,表明增加灌水量提高了低氮胁迫下的棉花产量。由此可知,W1、N0 和N1 处理显著抑制了棉花产量,干旱胁迫下棉花产量随着施氮量的增加而增加,低氮胁迫下棉花产量随着灌水量的增加而增加。
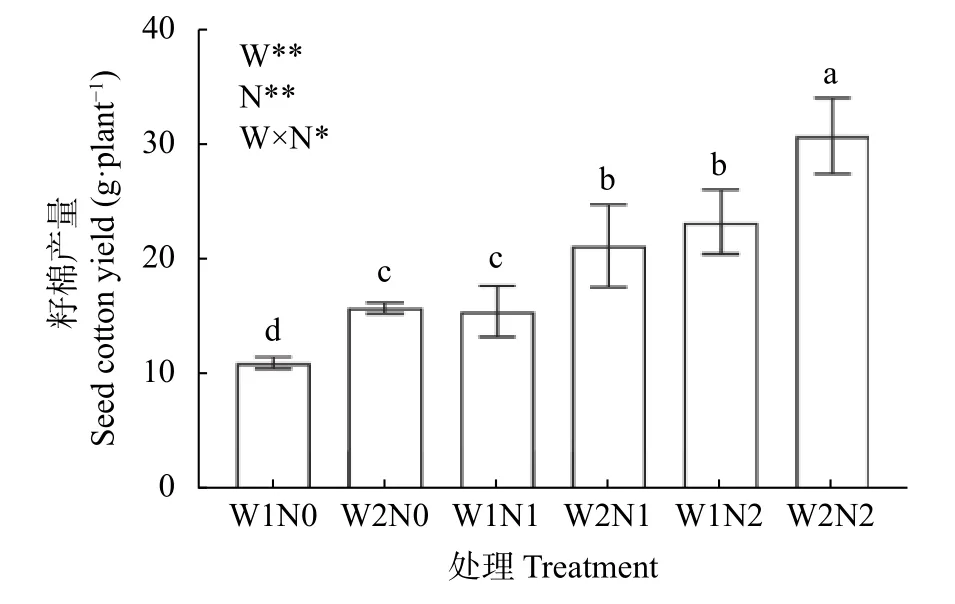
图4 水分和氮素调控对棉花籽棉产量的影响Fig.4 Effects of water and nitrogen regulation on cotton seed yield
3 讨论
3.1 水分和氮素对棉花植株形态及光合特性的调控效应
水分是影响植物生长的重要环境因素之一,不合理的水分管理对植物产生不利影响。研究发现,干旱胁迫导致棉花、番茄(Solanum lycopersicumL.)和马铃薯(Solanum tuberosumL.)株高、茎粗及叶面积指数下降,且随着干旱程度的加深愈加明显[5,23-24]。适度干旱可促进根系伸长,但严重干旱则抑制根系的生长[24-25]。氮素作为棉花生长发育必不可少的营养元素之一,直接影响了其生长发育和产量形成。低氮胁迫可造成棉花总根长变短,总根表面积变小以及平均根直径变细[9]。杜红霞等[16]研究了水、氮调控对夏玉米(Zea maysL.)根系特性的影响,发现水分对根表面积分布的影响大于氮素。何佩云等[17]研究表明,干旱胁迫下高氮处理对苦荞[Fagopyrum tataricum(L.) Gaertn.]株高具有促进作用;而干旱胁迫下低氮处理对苦荞根系长度以及根表面积具有促进作用。刘海光[15]研究发现,干旱胁迫下,棉花株高、叶面积下降,但随着施氮量的增加而增加。本研究结果显示,干旱以及低氮处理均降低了棉花的总根长、总根表面积以及平均根直径,影响了根系和地上部发育;而干旱胁迫下增施适量氮肥、低氮胁迫下增加适宜灌水量均促进了棉花根系发育,从而促进棉花的株高、茎粗和叶面积增加,这与何佩云等[17]的干旱胁迫下高氮处理对株高具有促进作用的研究结果相同,而与干旱胁迫下低氮处理对苦荞根系长度以及根表面积具有促进作用的结论并不一致,这可能与物种对水分和氮素的适应性紧密相关,还有待于进一步深入研究。
光合作用是植物生长中必不可少的生理活动和产量形成的基础。氮素和水分不足均可造成光合作用减弱。研究发现,干旱胁迫下,棉花叶片相对叶绿素含量(SPAD)、净光合速率和最大光化学效率(Fv/Fm)降低[26],但干旱胁迫下适量增施氮肥却增高了棉花主茎叶的叶绿素含量和花铃期的净光合速率,缓解了干旱胁迫对光合作用的抑制作用[27-28]。本研究表明,干旱胁迫降低了棉花SPAD、净光合速率和Fv/Fm,但增施氮肥促进了光合作用;低氮胁迫亦降低了棉花SPAD、净光合速率及Fv/Fm,但随着灌水量增大,光合作用增强,表明水分和氮素以及二者交互作用均对光合性状产生了显著影响。这是由于干旱胁迫下增加施氮量以及低氮胁迫下增加灌水量均促进了棉花根系对土壤养分的吸收,促进了地上部发育,叶面积增大,叶绿素含量增加,从而促进了光合作用,缓解了干旱和低氮胁迫对棉花造成的损伤。
3.2 水分和氮素对棉花抗氧化酶和氮代谢关键酶活性的调控效应
植物在遭遇逆境胁迫时,可通过酶促以及非酶促抗氧化系统清除细胞内过量的活性氧。SOD、POD、CAT 是植物体内主要的抗氧化酶,MDA 含量是反映植物组织脂质过氧化速率和强度的重要指标[29]。研究发现,干旱胁迫提高了棉花SOD、POD、CAT 活性以及MDA 含量[30]。不同水分处理下,SOD、POD、CAT 活性均随着施氮量的增加而增强,MDA含量则与之相反[31]。本研究结果显示,在干旱胁迫下,SOD、POD、CAT 活性随着施氮量的增加而提高,MDA 含量则随着施氮量的增加而下降,说明在一定范围内,常规施氮可以缓解干旱胁迫对棉花造成的氧化损伤。植物在受到干旱胁迫时,自身通过增加抗氧化酶活性来去除体内多余的活性氧,缓解干旱胁迫带来的损伤,但植物在低氮胁迫下抗氧化酶活性下降。在低氮条件下,SOD、POD、CAT 活性和MDA 含量随着灌水量的增加而降低,表明增加灌水量亦可缓解低氮胁迫对棉花产生的氧化伤害。此外,本研究还发现,水分和氮素对棉花光合性状的影响存在显著互作效应,但二者交互作用对抗氧化酶活性的影响并不显著,表明水分和氮素在协同作用中可能存在着相互影响,这有待于进一步研究。
GS 和NR 是氮代谢过程中的关键酶,对作物氮素吸收具有重要调控作用。相关研究表明,随着施氮量的增加,棉花GS 和NR 活性增强[32]。水氮交互作用下,GS 和NR 的活性与氮素利用特征和产量存在显著相关性,水分和氮素对水稻(Oryza sativaL.)生长具有显著的交互调控效应[33]。谈建鑫[34]研究发现,灌水量和施氮量对NR 活性均产生了显著影响,当灌水量一致条件下,NR 活性可随着施氮量的增加而增加;在施氮量一致条件下,NR 活性亦随着灌水量的增加而增强。本研究表明,在施氮量一致条件下,干旱胁迫可导致GS 活性和NR 活性下降;在水分一致条件下,GS 活性和NR 活性亦随着施氮量的增加而增加。这表明在一定范围内,干旱胁迫下增施氮量可促进GS 和NR 活性提高,促进了氮素的吸收转化,水分和氮素对棉花氮素吸收同样具有调控效应。
3.3 水分和氮素对棉花产量的调控效应
水分和氮素是影响作物产量的关键因素,二者可产生耦合效应以促进作物生长发育[17]。相关研究表明,干旱条件下棉花皮棉产量显著降低[35]。氮肥对棉花产量以及产量构成具有显著影响,增加施氮量可以提高棉花产量以及单铃重[36];增施氮肥亦可显著提高棉花单位面积成铃数和产量;但过度施入氮肥,可导致棉花贪青晚熟以及僵铃脱落增加[37-38]。何佩云等[17]研究发现,干旱胁迫降低了苦荞产量,而增施氮肥提高了苦荞产量。王艳哲等[39]研究表明,在干旱胁迫下小麦(Triticum aestivumL.)产量可随施氮量的增大而增加。本研究结果表明,水分和氮素以及二者交互作用对棉花产量产生了显著影响;干旱胁迫以及低氮处理均降低了棉花籽棉产量,而在干旱条件下棉花籽棉产量却随着施氮量的增大而增加,这是由于增施氮肥可调节土壤水分,促进根系发育,增强根系吸水能力,提高棉花叶面积及叶绿素含量,增强光合作用,使干物质积累增加,从而促进产量提高。在低氮条件下,增加灌水量促进了养分运输,促进了氮素的转化,增强了氮代谢能力,扩大了“源”,对低氮条件下棉花产量具有促进作用,实现了以肥调水、以水促肥的调控效应[17]。因此,本研究对明确氮素胁迫和水分胁迫下合理的水肥管理具有重要意义。
4 结论
本研究从棉花植株形态(地上部、地下部)、光合特性、抗氧化酶活性、氮代谢酶活性以及产量等指标研究了水分与氮素调控对棉花生长、生理特性以及产量的影响。结果表明,干旱与低氮胁迫抑制了棉花的生长发育,降低了产量。干旱胁迫下,常规施氮处理可促进棉花地上和地下生长,提高了净光合速率和最大光化学效率(Fv/Fm),增强了抗氧化酶(SOD、POD、CAT)活性和氮代谢酶(GS 和NR)活性,缓解了干旱胁迫对其造成的伤害,提高了棉花产量。低氮条件下,正常供水处理亦促进了棉花的生长,增强其光合作用和氮代谢酶活性,减缓了低氮胁迫对其产生的不利影响,从而提高棉花产量。因而可通过增施氮肥提高干旱胁迫下的棉花产量,亦可通过适当增加灌水量提高低氮胁迫下的棉花产量,这为氮素胁迫和水分胁迫下合理的水肥管理提供了理论依据。

