蓝藻生长与衰亡对太湖水体氮素迁移转化的影响
李昌杰,许 海,詹 旭,朱广伟,肖 曼,朱梦圆,邹 伟
1.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008
2.江南大学环境与土木工程学院,江苏 无锡 214122
氮是生命活动所必需的营养元素,在自然界中的存在形式多样,以大气中的氮气(N2)为主[1],但能被生物直接利用的大多为氨氮(NH4+-N) 和硝态氮(NO3--N)等活性氮[2].在人类活动的影响下,原有的氮循环被破坏[3],使得大量的活性氮进入水环境[4-5],造成水体富营养化,产生了一系列的环境问题[6-7],氮循环机制也受到了国内外学者的广泛关注.
湖泊生态系统是脱氮的热点区域,NiRReLa 模型预测全球每年约有19.7 Tg 氮被湖泊水库脱去[8].由微生物主导的反硝化作用将NO3--N 逐步还原为N2(NO3-→NO2-→NO→N2O→N2),被认为是脱氮的主要过程.反硝化速率受到温度、NO3--N 浓度和溶解氧(DO)浓度等多种环境因素的影响[9],而NO3--N 作为反硝化作用的底物,能够显著影响反硝化基因丰度和反硝化酶的活性[10-11],因此其浓度往往被认为是影响反硝化速率的首要因素[12-13].而在湖泊中,氮会通过各种生物地球化学循环在不同形态中进行转换[1,14],当NO3--N 被转化为其他形态的氮时,可能会降低反硝化脱氮的速率,从而导致氮素在水体中滞留,加剧湖泊富营养化程度.
蓝藻生长和衰亡的不同时期会给湖泊水体带来不同的物理化学环境,从而影响氮的循环过程.在蓝藻水华暴发期间,随着外源氮的输入,湖泊氮素脱除的速率显著增加[15],Shen 等[16]研究表明,微囊藻将沉积物-水界面的硝酸盐还原效率提高了76.5%~84.7%.刘志迎等[17]通过控制试验表明,部分反硝化细菌可以附着在蓝藻颗粒上,使得蓝藻水华成为反硝化脱氮的另一场所,进而提高湖泊水体的脱氮效率.在蓝藻水华暴发的末期,大量蓝藻降解导致水体DO 浓度急剧下降,为反硝化作用提供了有利条件,在此期间反硝化细菌的丰度远高于非藻华期间[18].Chen 等[19]研究表明,沉降的微囊藻细胞可直接提供DOC 作为碳源,进而增强沉积物水界面的反硝化作用.而由蓝藻衰亡导致的厌氧环境虽然可以促进反硝化作用,但有可能抑制硝化作用的进行[20].蓝藻的生长过程同样会和反硝化作用竞争NO3--N,这是否会影响湖泊的脱氮速率尚未可知.
基于此,本研究于2022 年11 月在太湖竺山湾采集无扰动泥柱和新鲜蓝藻进行培养试验,分别分析了蓝藻生长和衰亡的不同时期对氮迁移转化的影响,以期深入了解蓝藻水华暴发时氮素的归趋情况,并为太湖的氮素管理提供理论支撑和科学指导.
1 材料与方法
1.1 研究区域概况
太湖是我国第三大淡水湖泊,是长江三角洲重要的水源地.自2007 年无锡饮用水危机事件以来,太湖的富营养化问题被人们高度重视,国家也对其进行了高强度的治理[21],但至今蓝藻水华问题经年不断[22].竺山湾位于太湖西北部,与多条入湖河道相连,承担着较高的入湖氮负荷,蓝藻水华频发.由于太湖地区春夏季盛行东南风[23],蓝藻多漂浮在水体表面[24],在风力和水动力的作用下迁移至下风口,使得竺山湾成为蓝藻水华最为严重的湖湾之一.
1.2 采样点位及样品采集
本研究于2022 年11 月使用柱状采泥器和有机玻璃采泥柱(内径85 mm)在太湖竺山湾(120°1'54″E、31°23'51″N)采集10 根无扰动泥柱,调整柱中沉积物高度在15 cm 左右,并用橡胶塞密封,随机抽取1 根泥柱使用切环现场切表层2 cm 泥样带回实验室分析;使用浮游生物网(64 μm)采集藻浆装入1.5 L 聚乙烯瓶内;同步采集上覆水50 L.
1.3 室内培养试验及样品分析
试验设置如图1 所示,设置1 个对照组和4 个处理组,分别为湖水对照组(A0)、湖水加藻避光培养处理组(A1)、泥柱避光培养处理组(A2)、泥柱加藻避光培养处理组(A3)、A4 湖水加藻光照培养处理组(A4)、泥柱加藻光照培养处理组(A5),每组3 个平行.其中避光以模拟蓝藻衰亡状态,光照以模拟蓝藻繁殖状态.蓝藻漂浮在水体表面,由于底部存在沉积物,无法充分搅动均匀准确地测量叶绿素a 浓度,本文使用DO 浓度表征蓝藻的生长状况(与A0 对照组相比,DO 浓度高说明蓝藻进行光合作用正在生长,DO 浓度低说明蓝藻衰亡降解消耗了DO).

图1 模拟试验系统设计示意Fig.1 Design of simulation experiment system
泥柱带回实验室后静置一夜.第二天使用浮游生物网(64 μm)对湖水进行过滤,向过滤后的水中加入NaNO3,使NO3--N 浓度达到2 mg/L,并置换出泥柱中的上覆水,此过程缓慢进行确保不扰动沉积物.另取9 个空柱子注入过滤后的湖水,使水的体积和水面高度与泥柱中的水相同.随机抽取6 个水柱和6 个泥柱加入5 mL 藻浆.将18 个柱子同时放入25 ℃恒温水浴锅中,其中使用锡纸包裹A0、A1、A2 和A3 处理组的柱子以达到避光的目的,另使用28 W 日光灯(光照强度2 000 lx)对A4 和A5 处理组进行12 h 循环光照.试验持续4 d,每天光照结束后使用注射器采集A2、A3、A5 处理组沉积物上方5 cm 处水样,A0、A1 和A4 处理组在相同的高度取样,测定DO、NO3--N、NO2--N、NH4+-N 和DTN 浓度,取样和蒸发损失的水量使用过滤后的湖水进行补充.
DO 浓度使用便携式溶解氧仪测定;溶解态总氮(DTN)、NO3--N、亚硝态氮(NO2--N)和NH4+-N 浓度使用Skalar 连续流动分析仪(荷兰Skalar 公司,SAN++型)测定.
1.4 数据处理及图形绘制
数据处理使用Excel 2021 软件,图形绘制使用Origin 2018 软件.
2 结果与分析
2.1 DO 浓度的变化
各组DO 浓度的变化如图2 所示,A1、A2 和A3处理组的DO 浓度都低于A0 对照组,表明蓝藻在不断衰亡降解.其中A3 处理组下降最快,在第4 天达到最低值〔(0.40±0.06) mg/L〕,这是蓝藻降解和微生物共同作用的结果.A2 处理组的DO 浓度下降趋势与A0 对照组相似,而A1 与A3 处理组相似.添加光照的A4 和A5 处理组DO 浓度都高于A0 对照组,表明蓝藻在此期间在不断生长,其中不含沉积物的A4处理组在第1 天达到了最高值〔(11.50±0.21) mg/L〕,而A5 处理组存在沉积物中微生物的作用,导致其DO 浓度低于A4 处理组.

图2 各组DO 浓度随时间的变化Fig.2 The change of the DO concentration in each group with time
2.2 DTN 浓度的变化
DTN 浓度变化如图3 所示.A2 处理组低于A0对照组,表明A2 处理组中沉积物存在脱氮作用,在第1~3 天时A0 对照组和A2 处理组的DTN 浓度出现略微升高,可能是使用浮游生物网过滤后的水体仍存在少量蓝藻,在其衰亡后引起的DTN 浓度升高.而由于蓝藻的衰亡降解使得A1 和A3 处理组的DTN 浓度极大地升高,最终A1 处理组DTN 浓度为(3.48±0.20)mg/L,升高了77.6%;A3处理组DTN浓度为(3.12±0.17)mg/L,升高了59.2%.而A4 和A5 处理组的DTN 浓度持续下降,A4 处理组DTN 浓度为(1.05±0.16) mg/L,下降了46.4%;A5处理组DTN浓度为(0.77±0.16) mg/L,下降了60.7%.

图3 各组DTN 浓度随时间的变化Fig.3 The change of the DTN concentration in each group with time
2.3 NO3--N 浓度的变化
NO3--N 浓度的变化如图4 所示,A0 对照组和A1 处理组的NO3--N 浓度变化不大,表明水体和蓝藻的反硝化作用可能很弱.其他处理组都出现了不同程度的下降,其中A5 处理组下降最快,第4 天NO3--N浓度为(0.38±0.01) mg/L,比初始时降低了80.6%,其次为A4 处理组,最终NO3--N 浓度为(0.75±0.13) mg/L,降低了61.7%.避光处理组中A3 处理组下降最快,第4 天NO3--N 浓度为(0.85±0.09) mg/L,降低了56.6%,A2 处理组最终NO3--N 浓度为(1.16±0.13) mg/L,降低了40.8%.

图4 各组NO3--N 浓度随时间的变化Fig.4 The change of the NO3--N concentration in each group with time
2.4 NO2--N 浓度的变化
NO2--N 浓度的变化如图5 所示,A0 对照组和A4 处理组较为平稳,NO2--N 浓度一直接近于0 mg/L.A1 处理组在第2 天出现升高迹象,第4 天时达到(0.05±0.01) mg/L.A5 处理组在第1 天时NO2--N浓度升至最高,后持续缓慢下降,最终NO2--N 浓度为(0.02±0.00) mg/L.A3 处理组的NO2--N 浓度上升最为迅速,最终NO2--N 浓度为(0.16±0.01) mg/L.A2处理组的NO2--N 浓度也出现了明显的升高,第4 天时达到(0.12±0.00) mg/L.
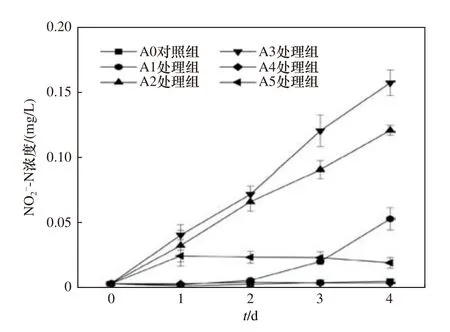
图5 各组NO2--N 浓度随时间的变化Fig.5 The change of the NO2--N concentration in each group with time
2.5 NH4+-N 浓度的变化
如图6 所示,避光并且添加蓝藻的A1 和A3 处理组的NH4+-N 浓度呈指数级增加,结合DTN 和NO3--N 浓度表明,蓝藻降解产生的主要为NH4+-N.第4 天 时A1 处理 组的NH4+-N 浓度 为(1.49±0.21)mg/L,A3 处理组的NH4+-N 浓度为(2.09±0.12) mg/L.同样避光而没有添加蓝藻的A2 处理组的NH4+-N 浓度升高相对缓慢,最终NH4+-N 浓度为(0.53±0.22) mg/L.有光照并且添加蓝藻的A4 和A5 处理组的NH4+-N浓度始终保持较低水平,甚至低于A0 对照组.
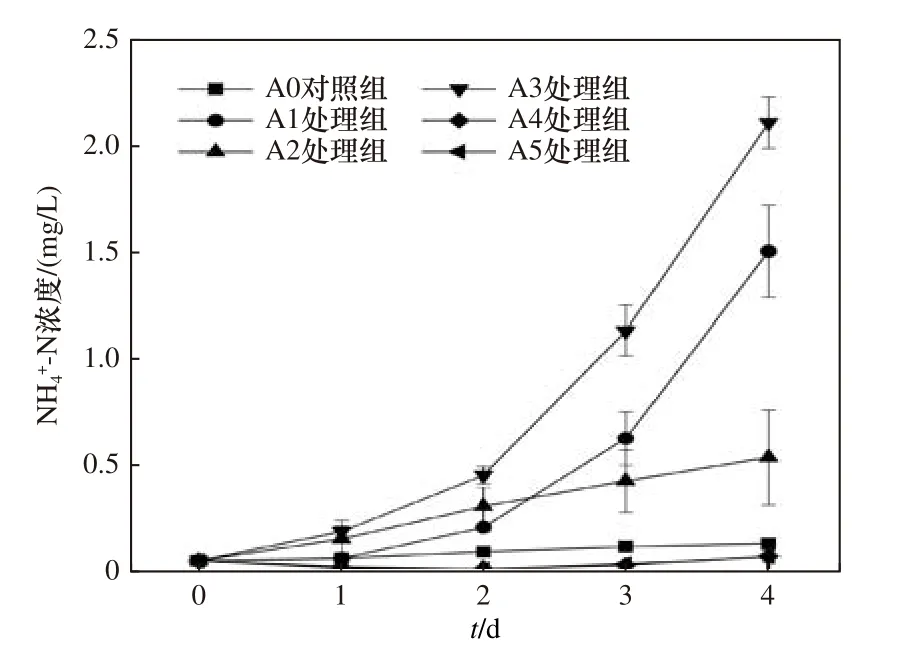
图6 各组NH4+-N 浓度随时间的变化Fig.6 The change of the NH4+-N concentration in each group with time
3 讨论
3.1 蓝藻生长对氮迁移转化的影响
本研究用A4 和A5 处理组设置了光照以模拟蓝藻生长,试验期间两组DO 浓度显著高于A0 对照组,表明蓝藻发生了光合放氧作用.在此期间A4 和A5处理组DTN 浓度显著下降,而NO3--N 浓度的降幅比DTN 更大,表明硝酸盐被大量吸收,同时有其他形态的氮素产生,可以判断蓝藻在生长过程中也会有部分蓝藻衰亡.蓝藻衰亡后向水体中释放出NH4+-N 和溶解态有机氮,其中NH4+-N 会被正在生长的蓝藻吸收或经硝化作用转化为NO3--N[25],这也是NH4+-N 浓度基本为0 mg/L 的原因(见图7),而未经氨化的溶解态有机氮浓度成为了DTN 与NO3--N 浓度的差异部分.韩菲尔等[26]研究表明,太湖浮游植物优先摄取NH4+-N,这代表着蓝藻的生长同样会与硝化作用产生竞争,进而减少反硝化底物NO3--N 的补充.
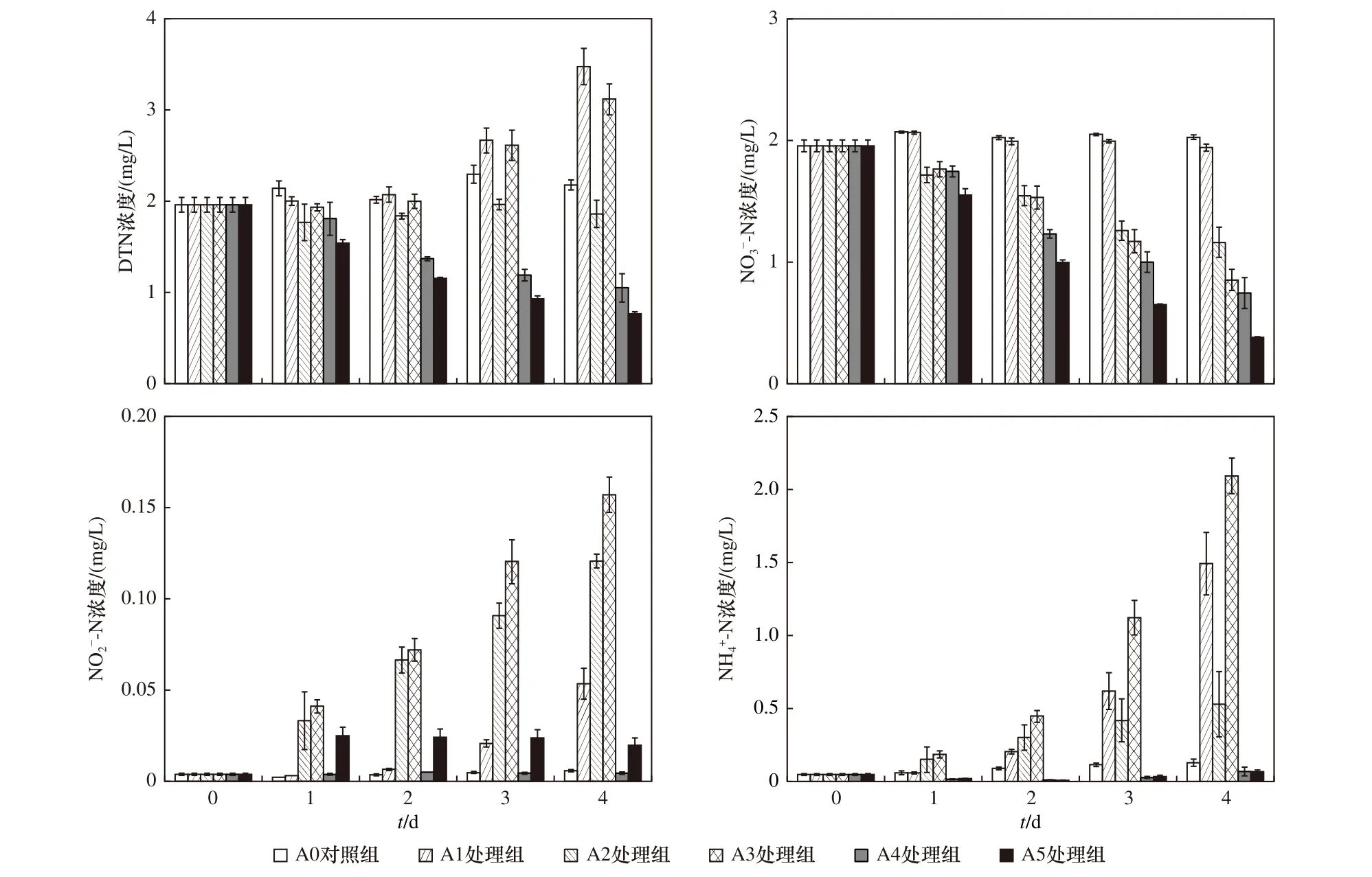
图7 不同形态氮浓度随时间的变化Fig.7 The change of concentration of different nitrogen forms with time
与A0 对照组相比,A1 处理组的NO3--N 浓度并没有明显降低(见图7),说明A1 处理组中的反硝化作用并不强,由于A4 处理组仅比A1 处理组多了光照,所以A4 处理组中NO3--N 浓度降低的主要方式为蓝藻吸收.A2 处理组中NO3--N 浓度降低的主要方式为反硝化作用,将A4 与A2 处理组进行对比发现,在蓝藻生长和反硝化都适宜的温度下[27],蓝藻对NO3--N 的吸收速率更快,这代表着蓝藻生长在与反硝化作用对NO3--N 的竞争中处于优势地位.A5 处理组中的NO3--N 一方面被蓝藻吸收,另一方面被底部沉积物的反硝化作用脱除,因此其浓度下降更为迅速.将A4 处理组中NO3--N 浓度与A5 处理组中NO3--N浓度的差值近似代表为A5 处理组的反硝化脱氮量,同理将A0 对照组与A2 处理组的差值代表为A2 处理组的反硝化脱氮量,相比得知A5 处理组中反硝化脱氮量要小于A2 处理组中反硝化脱氮量,这表明蓝藻在生长过程降低了反硝化的脱氮效率.
蓝藻生长会将NO3--N 同化吸收为自身的组成部分,从而减少反硝化作用的底物浓度.大量研究表明,NO3--N 浓度是影响反硝化速率的关键因素之一,一般随着NO3--N 浓度的降低反硝化速率随之降低[28-29].Senga 等[30]对日本的一个富营养化湖泊研究表明,由于大型藻类的竞争,沉积物中反硝化作用受到氮浓度的限制.祖瑶等[31]对太湖水华水样分析结果表明,Chla 浓度与TN 浓度的比值平均为0.156 mg/μg,干藻样的氮含量平均为16%.太湖水华暴发时,蓝藻会将水体中大量的NO3--N 转化为不可反硝化脱除的惰性氮,虽然在蓝藻生长过程中同样会有蓝藻衰亡降解将氮素释放进水体,但其释放进水体的氮素又会被生长中的蓝藻重新摄取.彭宇科等[32]研究发现,随着蓝藻水华的发展,反硝化功能基因丰度下降甚至消失.虽然蓝藻水华能够为反硝化作用提供场所,但反硝化微生物多为厌氧菌,光合作用产生大量的DO 会抑制反硝化作用[33].综上所述,蓝藻生长会通过降低水体中NO3--N 浓度抑制反硝化脱氮的效率.
3.2 蓝藻衰亡对氮迁移转化的影响
由图7 可见,蓝藻的衰亡和生长两个过程对水体中氮形态的影响具有极大的差异.A1 和A3 处理组中的蓝藻在死亡降解后将自身所含的氮素主要以NH4+-N 的形式释放进水体[17],从而导致DTN 浓度的增长(见图7).A1 处理组中NO3--N 的浓度变化不大,却积累了少量的NO2--N,证明其发生了反硝化作用,但反硝化作用可能很弱,加之硝化作用的补充,使得NO3--N 浓度总体没有发生太大的变化.A2 处理组中由于沉积物中的反硝化作用使得NO3--N 浓度持续下降,并且积累了更多的NO2--N,与A1 处理组对比可知,沉积物中的反硝化作用要远强于蓝藻水华.
朱梦圆等[34]研究发现,水华堆积衰亡能够引起沉积物营养盐释放量的增加.这与本研究的结果相似,即用A3 处理组与A1 处理组NH4+-N 浓度的差值近似代表为A3 处理组中沉积物的释放量,对比发现其大于A2 处理组中沉积物的释放量.增长最快的NH4+-N浓度并没有使A3 处理组的DTN 浓度也增长最快,这得益于NO3--N 浓度的降低,在第4 天时A3 处理组还原了56.6%的NO3--N,比A2 处理组高出15.8%,这足以证明蓝藻水华的衰亡能够提高沉积物的反硝化效率[16,19].Peng 等[35]研究表明,蓝藻衰亡加剧的缺氧环境有利于反硝化过程.本研究中A3 处理组的DO 浓度下降最快,并在第4 天时接近于0 mg/L,说明这种缺氧状态有利于反硝化过程的发生.
蓝藻的降解能够为反硝化作用提供氮源,而问题是蓝藻降解产生的NH4+-N 能否顺利转化为可供反硝化作用进行的NO3--N.虽然缺氧条件能够促进反硝化作用的进行,但前提是有足够的底物存在[13,28].Zhu等[20]研究发现,大量蓝藻堆积导致底层缺氧抑制了硝化作用,使得反硝化作用的底物NO3--N 得不到补充,从而导致反硝化脱氮的效率降低.本研究中A3处理组的NH4+-N 浓度呈指数级增长,其增长速率远大于NO3--N 的脱除速率,似乎印证了Zhu 等[20]的研究结论.但模拟试验是静态的,实际太湖水深较浅,在风浪的扰动下会使水体处于厌氧-耗氧交替过程,强化耦合硝化-反硝化过程.因此,欲加快太湖对氮素的脱除,需防止大量蓝藻长时间堆积,构建硝化-反硝化耦合的快速脱氮过程[25].
4 结论
a) 蓝藻的生长过程会与反硝化作用竞争NO3--N,降低反硝化作用的底物浓度,进而在短期内降低沉积物的脱氮速率;
b) 蓝藻的衰亡会降低水体DO 浓度,这有利于反硝化作用的发生,但大量蓝藻衰亡造成的缺氧状态可能会抑制硝化作用,使得NH4+-N 无法转化为NO3--N,从而短期打破硝化-反硝化耦合的脱氮过程;
c) 太湖水深较浅,风浪的扰动作用会使水体处于厌氧-耗氧交替过程,强化耦合硝化-反硝化过程,因此,从蓝藻生长-衰亡的整个生命周期来看,蓝藻水华的发生会加强湖泊氮素的脱除.

