芪苈强心胶囊对慢性心衰大鼠认知功能障碍的影响及机制研究❋
窦晋芳,赵 跃,常佩芬,高瑜倩,彭嘉冉,黑穆荣,王志淼,张洪嘉,朱海燕,2,3△
(1.北京中医药大学东直门医院,北京 100700;2.北京中医药大学中医内科学教育部重点实验室,北京 100700;3.北京中医药大学心血管病研究所,北京 100700)
慢性心力衰竭(chronic heart failure,CHF)简称慢性心衰,是一种由不同致病因素损伤心脏功能及结构,导致心功能逐渐减退或丧失,供血难以满足机体代谢需要及心脏内分泌功能失调的疾病[1]。研究发现CHF住院患者中约有50%会逐渐出现程度不同的认知功能障碍,严重影响其生存质量、护理难度和预后,但具体机制尚不明确[2]。CHF的发生往往会激活体内的肾素-血管紧张素系统(renin-angiotensin system,RAS),研究表明,血管紧张素Ⅱ转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)不但能够改善CHF患者的心功能,还能改善其认知功能障碍[3]。益气温阳、活血利水中药芪苈强心胶囊在临床治疗CHF疗效显著,研究证实其还可抑制体内血管紧张素(angiotensin,Ang)Ⅱ的过度产生及激活[4-5],在此基础上推测芪苈强心胶囊有改善CHF后认知障碍的作用,机制可能与AngⅡ有关。本课题采用心梗后心衰大鼠模型,观察中药芪苈强心胶囊对CHF后认知功能障碍的干预作用。本研究经北京中医药大学东直门医院动物伦理委员会审批,编号21-36。
1 材料
1.1 动物
12周龄雄性SPF级SD大鼠,体质量(210±10)g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006,于东直门医院屏障环境动物室饲养。饲养环境温度20~24 ℃,相对湿度40%~45%,每日光照10~12 h。所有动物食水自由并保持垫料清洁。
1.2 药物及主要试剂
芪苈强心胶囊,国药准字Z20040141,石家庄以岭药业有限公司;缬沙坦片,国药准字H20051350,鲁南贝特制药有限公司;大鼠AngⅡ、β淀粉样蛋白(amyloid-β,Aβ)42 ELISA试剂盒,货号CSB-E04494r、CSB-E10786r,武汉华美生物工程有限公司;注射用青霉素钠,货号140051248,江西科达动物药业有限公司;4%组织细胞固定液,货号P1110,北京索莱宝科技有限公司。
1.3 主要仪器
MD-021型Morris水迷宫系统,上海移数信息科技有限公司;FX-7202型心电图机,日本CardiMax公司;ALC-V8S型小动物呼吸机,上海奥尔科特生物技术有限公司;Ve-vo2100型超高分辨率小动物超声影像系统,探头型号MS-201,加拿大Visual Sonics公司;BX60型光学显微镜,日本Olympus公司。
2 方法
2.1 心梗后心衰大鼠造模
适应喂养1周后,大鼠按0.5 g/100 g 体质量腹腔注射1%戊巴比妥钠麻醉后连接呼吸机,参照文献中的方法造模[6],顺肋间隙于大鼠胸骨旁第3、4肋间作1.5 cm切口,逐层分离皮下组织、肌肉,打开胸腔和心包膜,在动脉圆锥与左心耳之间下约2 mm处结扎左冠状动脉前降支。假手术组大鼠只在同样位置穿线而不结扎。大鼠以术后24 h心电图出现明显ST段抬高和病理性Q波,至少分布于 I、aVL、V3~V6导联,可兼有V1、V2导联,且病理性Q波大于7个为心梗造模成功标准。
2.2 分组及给药
将造模成功的大鼠随机分为模型组、芪苈组和缬沙坦组,每组18只。假手术组大鼠18只。药物采用去离子水充分溶解形成均匀的混悬液。按60 kg成人临床用量的10倍进行换算,芪苈组给予芪苈强心胶囊0.6 g/kg/d,缬沙坦组给予缬沙坦片13.3 mg/kg/d。每日给予假手术组和模型组大鼠等体积去离子水。术后第2天开始灌胃给药,持续2个月后进行后续检测。
2.3 Morris水迷宫实验
药物干预结束后进行Morris水迷宫实验。定位航行实验:历时3 d,每日固定时间段,从除平台所在象限外的3个象限中分别任选一点将大鼠放入水池,大鼠找到平台后结束,记录大鼠找到平台的时间。空间探索试验:历时1 d,撤除平台后将大鼠从除原平台所在象限外的3个象限中分别任选一点放入水池,120 s后实验结束,记录大鼠在120 s内跨越平台区的次数。
2.4 超声心动图检测心功能
水迷宫实验后进行超声心动图检测。大鼠麻醉后,取左室乳头肌短轴切面,测量心室射血分数(ejection fraction,EF)和心室缩短分数(fractional shortening,FS),每次取3~5个心动周期,重复3次取平均值。
2.5 血流动力学检测心功能
大鼠麻醉后颈部备皮,沿正中线剪开4 cm的切口,将颈前肌群钝性分离以暴露右颈总动脉并于远心端处结扎,于近心端夹闭动脉夹,于右颈总动脉上作1.5 mm切口,将灌洗过肝素钠溶液的导管插入动脉,推向心脏直至进入左心室,待信号稳定后测定左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end diastolic pressure,LVEDP)、左心室内压最大上升速率(the maximal rate of increase of left ventricular pressure,+dp/dt max)和左心室内压最大下降速率(the maximal rate of decrease of left ventricular pressure,-dp/dt max)。
2.6 处死与取材
记录大鼠体质量(body mass,BM)。大鼠麻醉后从腹主动脉处采血,开胸后摘下心脏,于4 ℃预冷的0.9%氯化钠溶液中涮洗后擦干,电子天平称取心脏质量(heart mass,HM)。心脏质量指数(heart mass index,HMI)=HM(mg)/BM(g)。同时,用照相机拍摄各组大鼠心脏大体结构照片。于大鼠心脏的最大横截面处切取组织块,立即浸泡于4%组织细胞固定液中固定。用铡刀切掉动物头部,剥离皮毛及颅骨,暴露右侧枕叶皮质下海马区,镊子夹取海马放入冻存管,迅速投入液氮。
2.7 心肌HE染色和海马尼氏染色
心肌组织经石蜡包埋后切片,于二甲苯中充分脱蜡,梯度乙醇下行各2 min,苏木素染色8 min,1%盐酸酒精分化30 s,伊红染色2 min,梯度乙醇上行各2 min,二甲苯透明后封片,光学显微镜下观察大鼠心肌组织;大鼠脑组织制成冰冻切片,去离子水中洗3 min,避光加入尼氏染色试剂盒A液,37 ℃温育15 min,梯度乙醇下行各5 s,B液中分化,梯度乙醇上行各1 min,二甲苯透明后封片,光学显微镜下观察大鼠海马神经元。
2.8 ELISA检测血浆和海马AngⅡ、海马Aβ42浓度
按试剂盒说明书进行操作,向96孔板中依次加入标准品和待测样本、抗体工作液、辣根过氧化物酶、底物混合液和终止液,于450 nm波长下读取光密度(optical density,OD)值,检测血浆和海马中AngⅡ、海马Aβ42浓度。
2.9 统计学方法
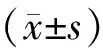
3 结果
3.1 各组大鼠术后24 h心电图比较
术后24 h,假手术组大鼠心电图未见明显异常,但模型组、芪苈组和缬沙坦组大鼠心电图可见明显的ST段抬高和病理性Q波,至少分布于 I、aVL、V3~V6导联,可兼有V1、V2导联,且病理性Q波大于7个,符合心梗造模成功标准,见图1。

A.假手术组;B.模型组;C.芪苈组;D.缬沙坦组
3.2 各组大鼠逃避潜伏期、穿越平台次数比较
在定向航行实验中,从第1天到第3天,各组大鼠逃避潜伏期时间均呈现递减的趋势。在空间探索实验中,与假手术组大鼠比较,模型组大鼠穿越平台次数明显减少(P<0.01);与模型组大鼠比较,芪苈组和缬沙坦组大鼠穿越平台次数明显增多(P<0.05),见图2。
注:与假手术组比较**P<0.01;与模型组比较# P<0.05
3.3 各组大鼠EF值、FS值比较
与假手术组比较,模型组大鼠EF值和FS值明显降低(P<0.01);与模型组比较,芪苈组大鼠EF值和FS值显著升高(P<0.05),缬沙坦组大鼠EF值和FS值较模型组有升高趋势,但差异无统计学意义(P>0.05),见图3。

注:与假手术组比较**P<0.01;与模型组比较# P<0.05,##P<0.01;心室射血分数(EF);心室缩短分数(FS)
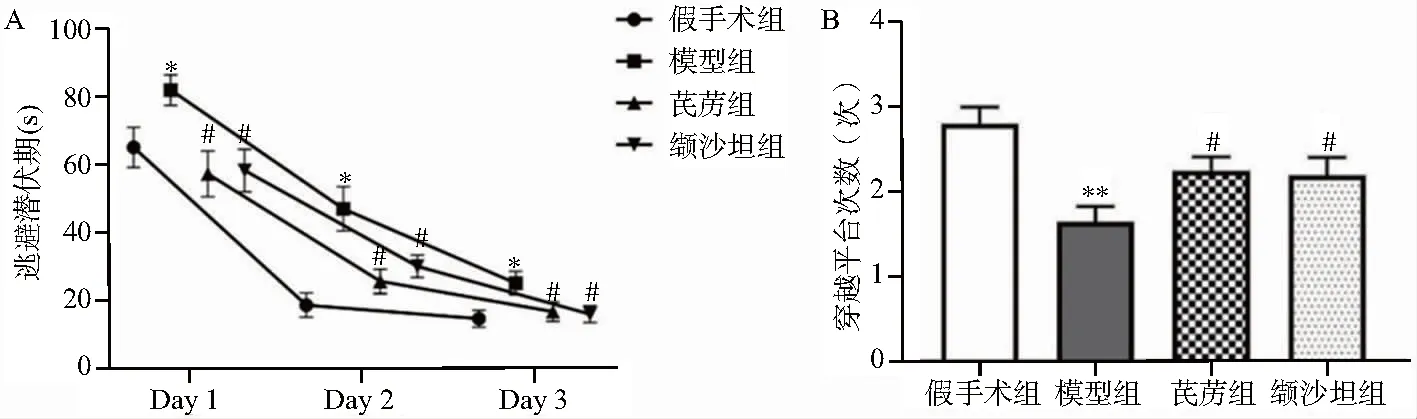
3.4 各组大鼠血流动力学指标比较
与假手术组比较,模型组大鼠+dp/dt max、-dp/dt max和LVSP显著降低(P<0.05),LVEDP显著升高(P<0.05);与模型组比较,芪苈组大鼠LVSP显著升高(P<0.05),缬沙坦组大鼠LVSP显著升高(P<0.05)、LVEDP显著降低(P<0.05),见图4。
注:与假手术组比较*P<0.05,**P<0.01;与模型组比较# P<0.05;左心室收缩压(LVSP);左心室舒张末压(LVEDP);左心室内压最大上升速率(+dp/dt max);左心室内压最大下降速率(-dp/dt max)
3.5 各组大鼠HMI比较
各组大鼠HMI比较差异均无统计学意义(P>0.05),见图5。
图5 各组大鼠心脏质量指数(HMI)比较(n=6)
3.6 各组大鼠心脏大体结构比较
通过观察大鼠心脏大体照片,与假手术组比较,术后第60天模型组大鼠心脏体积变大,心室壁尤其左室前壁结构发生明显变化,室壁变薄,心尖塌陷范围较大,表现为广泛的苍白色纤维化;与模型组比较,芪苈组和缬沙坦组大鼠心脏大体结构略有改善,但差异不明显,见图6。
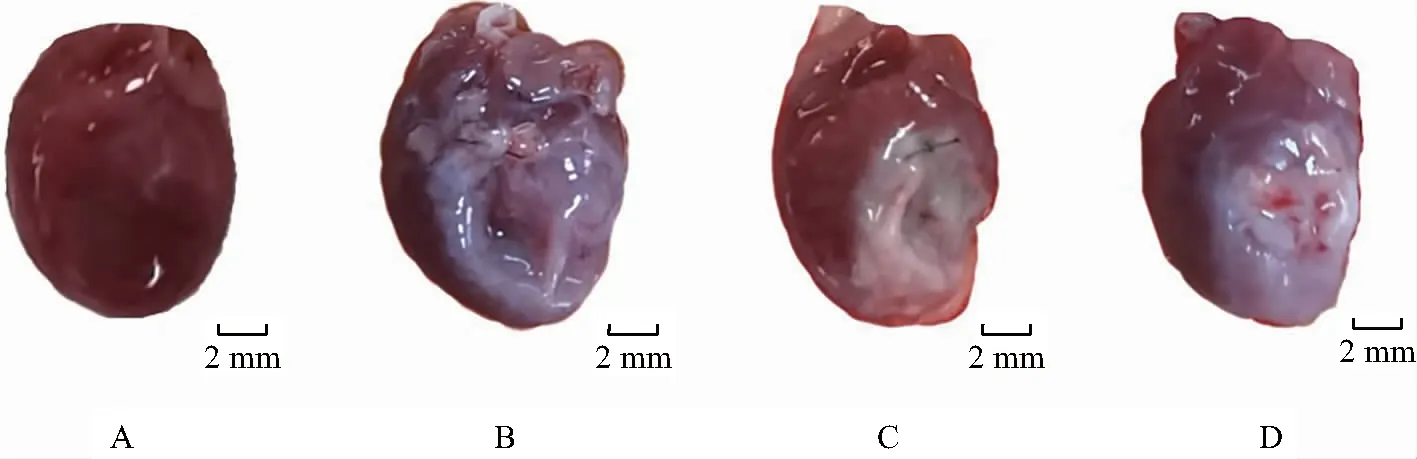
A.假手术组;B.模型组;C.芪苈组;D.缬沙坦组
3.7 各组大鼠心肌组织HE染色及海马尼氏染色结果比较
假手术组大鼠心肌细胞形态正常,结构完整,排列整齐致密,胞核居中,染色均匀;模型组大鼠心肌细胞结构模糊,出现水肿,细胞间隙增大,细胞排列紊乱,有明显的炎性细胞浸润;芪苈组及缬沙坦组大鼠的心肌结构较模型组有不同程度改善,心肌纤维更完整,有少量炎性细胞浸润,细胞染色相对较均匀。假手术组大鼠海马神经元多且染色深,模型组大鼠海马神经元数目减少且染色较浅,芪苈组和缬沙坦组大鼠较模型组有不同程度改善,神经元数目增加,染色加深,见图7。

A.假手术组;B.模型组;C.芪苈组;D.缬沙坦组
3.8 各组大鼠血浆和海马AngⅡ、海马Aβ42浓度比较
与假手术组比较,模型组大鼠的血浆AngⅡ、海马AngⅡ和海马Aβ42浓度显著升高(P<0.01);与模型组比较,芪苈组和缬沙坦组大鼠的血浆AngⅡ和海马Aβ42浓度显著降低(P<0.05),芪苈组大鼠的海马AngⅡ浓度明显降低(P<0.05),缬沙坦组大鼠的海马AngⅡ浓度较模型组有降低趋势,但差异无统计学意义(P>0.05),见图8。

注:与假手术组比较**P<0.01;与模型组比较# P<0.05,##P<0.01;血管紧张素Ⅱ(AngⅡ);β淀粉样蛋白42(Aβ42)
4 讨论
心脑之间的关系自古以来密不可分,心主神明,脑为髓海[7]。CHF的主要病机是心气虚造成脉络瘀阻,进而形成痰湿水停。如心气不足影响气机的运行和血液的灌注,就会影响气血流通和神机运转,神机失用从而发生认知障碍。芪苈强心胶囊是当前临床治疗CHF的有效中药组方[8-9],由黄芪、附子、人参、丹参、红花、葶苈子等组成,具有益气温阳、活血通络、利水消肿的作用。已有研究表明,芪苈强心胶囊既能增强心肌收缩力,增加心排血量[10],又可以抑制RAS过度激活,从而减缓CHF的进展[4-5]。
本研究采用心梗后心衰大鼠模型,模型组大鼠的心功能较对照组明显下降,EF值约34.39%,符合EF≤45%的心衰标准[11-12]。超声心动图、血流动力学、心脏大体结构和组织病理结果表明,芪苈强心胶囊确实能够改善心梗后心衰大鼠的心功能,减轻心肌组织的损伤。ELISA结果显示,芪苈强心胶囊和阳性对照药缬沙坦均能抑制血液中AngⅡ的浓度。CHF发生时,RAS的激活十分关键,而AngⅡ是RAS中最重要的活性因子,它与血管紧张素1型受体(angiotensin Ⅱ type 1 receptor,AT1R)结合后能够导致心肌肥厚,心脏负荷增加,从而加速心脏纤维化和心衰的进程[13]。降低AngⅡ浓度或抑制其与AT1R结合,能够显著提高心衰患者的心功能,减慢心衰的进展[14-15]。
除了循环系统外,脑部也有自己的RAS系统[16],参与学习、记忆、压力和性行为等调节[17]。AngⅡ与AT1R结合可导致炎症、氧化应激增加,血脑屏障破坏,减少脑血流并增加Aβ的沉积,产生神经毒性或损伤神经元,从而对认知功能产生影响[18-19]。ELISA结果发现,模型组大鼠脑内AngⅡ浓度较假手术组显著增加,芪苈强心胶囊能够降低脑内AngⅡ浓度,但缬沙坦组与模型组比较仅有下降趋势,这可能与芪苈强心胶囊能够透过血脑屏障有关,而目前关于缬沙坦能否通过血脑屏障的研究结果尚不一致[20]。
Morris水迷宫实验表明,心衰模型大鼠的认知能力受损主要表现在空间学习记忆能力上,而芪苈强心胶囊和缬沙坦能有效改善心衰大鼠的空间学习记忆能力。海马作为学习、记忆的神经中枢和解剖基础,与认知功能密切相关。尼氏染色发现,模型组大鼠海马神经元较假手术组稀疏且染色浅,芪苈组和缬沙坦组均有改善。ELISA结果发现,模型组大鼠海马组织Aβ42含量较假手术组明显升高,芪苈组和缬沙坦组较模型组显著降低,这与Morris水迷宫实验中心衰模型大鼠的认知受损结果相一致。因此有一定的理由推测,在AngⅡ影响慢性心衰导致认知功能损害的病理环节中,海马Aβ42异常增多参与了学习记忆功能的损害。而芪苈强心胶囊可以通过抑制海马AngⅡ 浓度,降低Aβ42含量,从而改善认知能力。
综上所述,芪苈强心胶囊在改善慢性心衰大鼠心功能的同时,还能对其认知功能障碍起到一定的治疗作用,其机制可能与抑制外周和海马AngⅡ及脑内Aβ42水平有关,具体仍有待深入研究。

