炎症标志物检测联合术前多模态MRI特征预测肝细胞癌微血管侵犯
张霈, 王娅囡, 叶航, 朱金成, 李斌
肝细胞癌是世界第二常见恶性肿瘤,我国确诊恶性肿瘤病例超过一半是肝细胞癌,肝细胞癌死亡率高,我国每年有近40万人死于肝细胞癌,是对群众生命健康的严重威胁[1-2]。临床上对肝细胞癌的治疗方法很多,其中根治切除和肝移植是最有效的方法,但术后极易复发,严重影响患者生命健康[3]。微血管侵犯 (microvascular invasion,MVI)是指癌细胞集团仍存在于内皮细胞的血管腔内,周边组织被癌细胞侵犯,造成复发或转移[4]。大量研究表明MVI是肝细胞癌复发的危险因素,因此,术前预测MVI对控制肝细胞癌复发有重要意义[5-6]。影像学在肝细胞癌术前监测和方案制定中有重要作用,有助于对患者诊疗情况进行了解分析并有效改善患者预后,其中术前多模态MRI检查是目前临床常用的检查方法。MRI可清晰显示病灶,且无辐射、分辨率高,对肝细胞癌的早期诊断有很大帮助[7]。相关研究证实炎性因子与肝细胞癌发生MVI有相关性[8],但少有研究分析炎性因子联合MRI对MVI的预测价值。本研究通过回顾性分析肝细胞癌患者的临床资料及MVI发生情况,旨在探讨中性粒细胞/淋巴细胞比率 ( neutrophil-to-lymphocyte ratio,NLR)、全身免疫炎症指数(systemic immune-inflammation index,SII)联合术前多模态MRI特征对肝细胞癌MVI的预测价值。
材料与方法
1.病例资料
选取2018年12月至2021年12月我院收治的120例肝细胞癌手术切除治疗患者,根据术后是否发生MVI将患者分为MVI组和非MVI组,其中MVI组69例,非MVI组51例。病例纳入标准:①术后病理确诊为肝细胞癌;②年龄18~80岁;③首次进行根治性切除术。病例排除标准:①术前检测有血管栓或大血管侵犯;②患有心、肝、肾类疾病;③肿瘤已合并转移;④Child Pugh C分级患者。所有患者均签署知情同意书,本研究经本院医学伦理委员会批准。
2.检查方法
MRI检查采用德国西门子MagnetomAvanto1.5T磁共振扫描仪,8通道表面相控阵线圈,外加呼吸门控软管。患者取仰卧位,常规扫描层厚5 mm,层间距1.5 mm。扫描序列包括T2WI、T1WI以及横轴面、冠状面容积式内插值法屏气检查序列。T2WI使用单次激发快速自旋回波序列,扫描参数:TR 300 ms,TE 2.5 ms,翻转角80°,带宽62.5 KHz,矩阵288×224,视野350 mm×270 mm,层厚5 mm,层间隔2 mm,激励次数0.75。DWI采用单次激发自旋回波-平面回波成像序列,扫描参数:TR 1700 ms,TE 73 ms,翻转角150°,矩阵192×139,视野342 mm×344 mm,层厚6.5 mm,层间隔1.5 mm。MRI增强扫描采用LAVA序列,扫描参数:TR 4.5 ms,TE 1.7 ms,视野350 mm×270 mm,层厚5 mm,层间距2.5 mm。增强扫描对比剂使用钆喷替酸葡甲胺,高压注射器静脉注射,剂量0.2 mmol/kg,流率2 mL/s。患者空腹6 h后进行检查,扫描范围包括肝脏到十二指肠。
术前清晨收集120例患者的空腹10 h以上静脉血,检测血小板数、中性粒细胞数和淋巴细胞数,并计算NLR和SII值。
3.图像处理与分析
将患者MRI图像上传至PACS系统(美国锐科公司),由两位有5年以上经验的MRI诊断医师共同分析审阅,若意见不统一,则由一位副主任医师加入讨论并达成一致意见。主要评估的图像特征包括:①肿瘤直径:定义为图像测量得出的最大肿瘤直径;②病灶数量:根据MRI图像显示的病灶数目分为单灶或多灶。③ADC平均值(ADCmean):通过ADC图对肿瘤强化最显著层面勾画感兴趣区,多瘤灶需逐个进行勾画,并由有10年以上工作经验的放射科医师进行校对,最终确认,并计算得出ADCmean。④肿瘤边缘:根据MRI图像将肿瘤边缘分为光滑和不光滑。观察到肿瘤轮廓为光滑的结节状肿块为肿瘤边缘光滑,观察到非结节状肿块且边缘不规则的为肿瘤边缘不光滑。⑤肿瘤包膜:观察MRI图像,根据包膜完整情况分为包膜完整和包膜不完整。
4.统计学分析
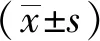
结 果
1.一般资料对比
120例患者中MVI组69例,非MVI组51例,对两组患者的一般资料进行对比分析,结果显示MVI组的NLR和SII均明显高于非MVI组,差异均具有统计学意义(P均<0.05,表1),其他指标在两组间差异均无统计学意义(P均>0.05)。
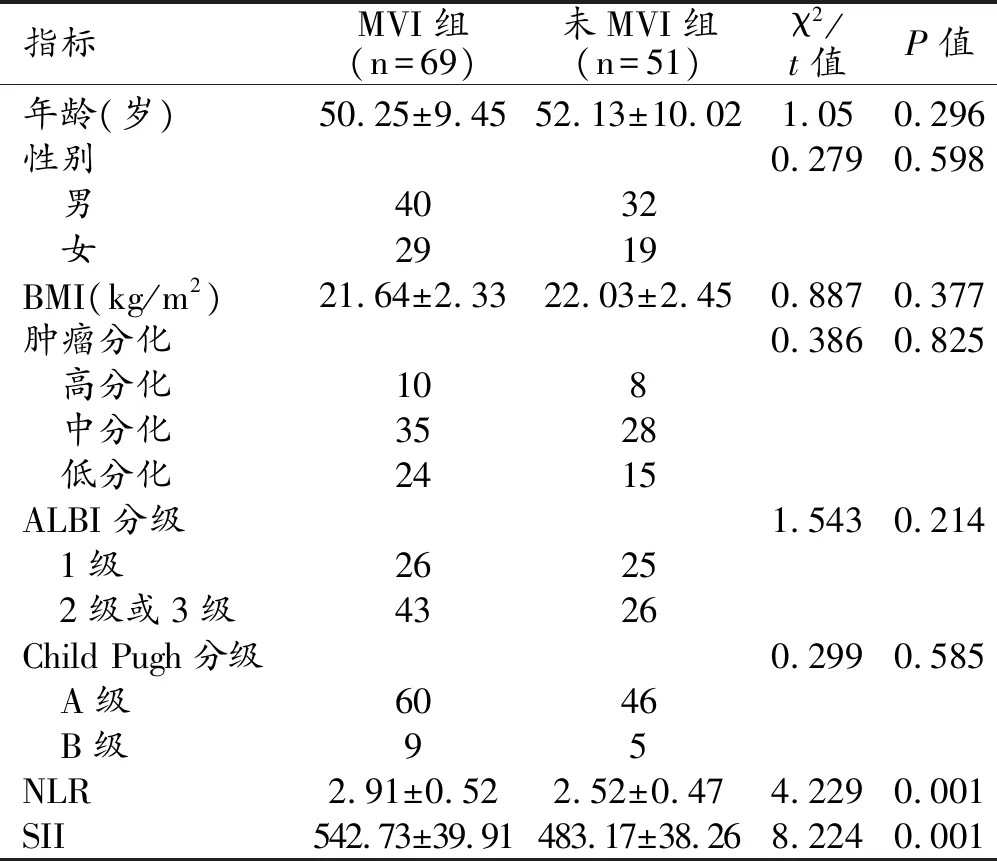
表1 MVI组与非MVI组患者的一般资料对比 (例)
2.两组MRI特征对比
对两组患者的MRI影像学特征进行对比分析(图1、2),结果显示MVI组的ADCmean和肿瘤直径都明显高于非MVI组,差异均具有统计学意义(P均<0.05,表2)。
3.多因素分析结果
以术后是否发生MVI作为因变量, NLR、SII、ADCmean和肿瘤直径作为自变量,纳入Logistic风险比例回归进行多因素分析。分析结果显示NLR、SII、ADCmean和肿瘤直径均是影响肝细胞癌术后是否发生MVI的危险因素(P均<0.05,表3)。
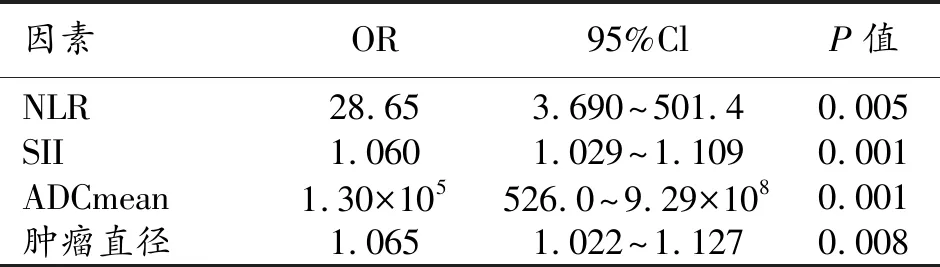
表3 Logistic回归分析结果
4.预测价值分析
ROC曲线分析结果显示,单参量中ADCmean 的预测效能最高(AUC=0.829,P<0.001);联合后NLR+SII+ADCmean+肿瘤直径的预测效能最高(AUC=0.889,P<0.001)(表4)。
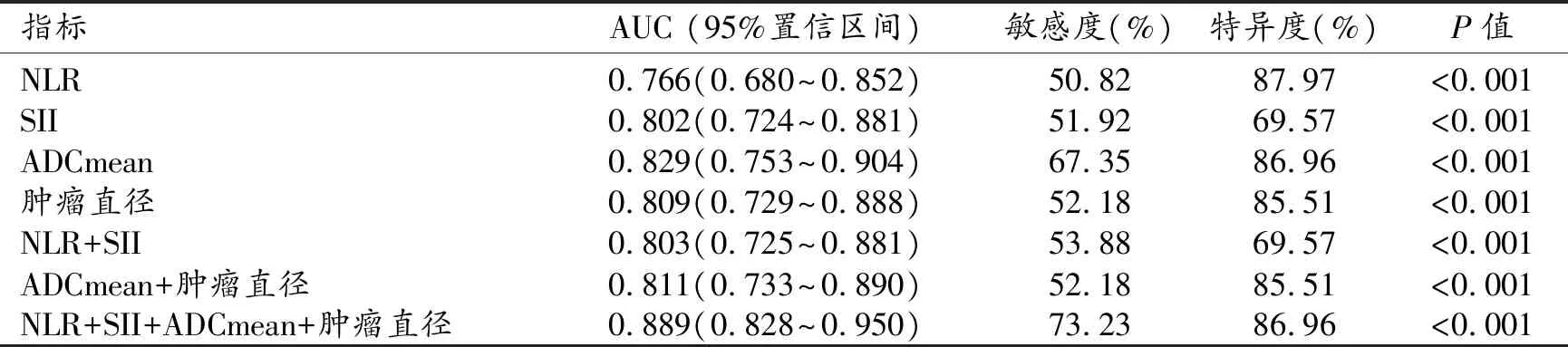
表4 炎症标志物和MRI特征对MVI的预测价值
讨 论
肝细胞癌是致死率极高的恶性肿瘤之一,肿瘤根治切除术是治疗肝细胞癌的首选方案,但切除术术后癌细胞容易发生转移,肿瘤复发率很高。由于肝细胞癌数量不断增加,对肝细胞癌患者进行早期诊断和治疗可以有效降低死亡率[9]。MVI是肝细胞癌发生转移的早期阶段,研究认为MVI对肝细胞癌预后有影响,所以,对MVI进行术前预测可以反映肝细胞癌的预后[10],在术前对患者进行影像学检查必不可少[11]。
多模态MRI能够提供肿瘤更多的影像信息,还能观察肿瘤内部血流动力学特征,对于肝细胞癌的早期诊断和及时治疗都有很大帮助[12]。本研究6个MRI图像特征中有2个(肿瘤直径和ADCmean)在MVI组与非MVI组间差异有统计学意义。多项研究表明肿瘤直径是MVI的重要影响因素[13],较大的肿瘤直径与更多的血管数相关,从而增加了发生MVI的概率,这与本研究结论一致。不仅如此,ADCmean值在本研究中也被发现是肝细胞癌术后发生MVI的危险因素。然而,其他研究表明,肿瘤包膜的完整性也是预测MVI的独立危险因素[14],这与本研究结论有所不同;笔者推测,这种差异可能是由于MRI对肿瘤包膜完整性评估存在一定误差所导致的。
炎症是癌症的标志物之一,大量研究证实,炎症反应与癌症的发生和复发具有相关性,炎症标志物对于肝细胞癌切除术的术后预后有很高预测价值[15-16]。NLR是中性粒细胞与淋巴细胞的比值,作为反映机体炎症和应激程度的指标,对多种感染性疾病及免疫疾病有良好的预后预测作用。SII是血小板数*中性粒细胞数/淋巴细胞数所得,综合了炎症和促凝的因素,是一种新兴的炎症指标。两种指标均已被证实与恶性肿瘤和心血管等疾病有相关性和预测价值[17]。本研究也证实NLR、SII是肝细胞癌术后发生MVI的危险因素。
根据本研究结果,笔者发现炎症标志物NLR、SII以及MRI特征ADCmean、肝细胞癌的肿瘤直径在术后发生MVI方面扮演了危险因素的角色。此外,我们还进一步评估了联合炎症标志物和多模态MRI特征绘制的ROC曲线对肝细胞癌术后预后的预测价值,结果显示炎症标志物与MRI特征的联合在预测肝细胞癌术后预后方面显示出了更高的预测价值。这表明了炎症反应与肿瘤生物学、组织特征之间的密切关系,综合利用炎症标志物和MRI特征进行预测可以更准确地评估术后患者的预后情况。
综上所述,炎症标志物检测联合术前多模态MRI特征对肝细胞癌发生MVI有很好的预测价值。但本研究存在以下局限性:首先,本研究为单中心研究,并且样本量相对较小,可能存在选择偏差和样本不足的问题;此外,由于本研究为回顾性研究,存在信息获取和记录的限制。因此,本研究结论需要未来大规模、多中心的前瞻性研究进一步验证,并进一步探索预测肝细胞癌术后预后的可靠指标。尽管存在以上局限性,本研究结果仍然提供了有关炎症标志物和MRI特征在肝细胞癌术后预后预测方面的初步信息。进一步的研究可以进一步明确这些预测因素的生物学意义和临床应用价值,以指导更精准的治疗策略和改善患者的预后。

