空心李酿酒酵母的酿造学性能分析
李银凤,黎华,唐小玉,朱文丽,刘晓柱
(贵州理工学院,贵州 贵阳 550003)
空心李(Prunus salicina Lindl. cv‘Kongxinli’),蔷薇科李属植物,因其果实成熟后果核和果肉分离而得名,主要分布在贵州省东北部、湖北省西南部以及重庆市的东部[1]。空心李果实营养丰富,酸甜可口,风味独特,深受人们的喜爱[2]。特别是贵州沿河的空心李,品质更为独特,已成为国家地理标志产品。但空心李的采收期为炎热的夏季,其保鲜贮藏手段还不成熟,导致鲜果保质期和货架期较短,易褐化,品相、口感和风味均易受到影响[3]。因此,对采摘后的鲜果进行精深加工,如加工成饮品[4-5](如发酵果酒、饮料)、果脯[6]等,是一种有效延长鲜果保存期的手段。但目前空心李果酒酿造所用菌种均为葡萄来源的商业化酿酒酵母,缺乏优质的空心李野生酵母菌株。
酿酒酵母(Saccharomyces cerevisiae)为果酒发酵的主要菌种,其乙醇耐受性高,发酵性能强,可将果汁原料中的糖类代谢成乙醇、二氧化碳以及各种风味物质[7-9]。利用酿酒酵母进行果酒的生产,操作简单、品质易于控制[10-11]。但目前商业化的酿酒酵母,大多分离于葡萄果实,为葡萄酒生产专用菌种,缺乏其它类果酒生产菌株,更未见有针对空心李果酒生产酿酒酵母的相关报道。
本课题组前期采用纯培养法对贵州沿河空心李酵母多样性进行了鉴定,从空心李果皮上分离鉴定出包括酿酒酵母在内的5 大类酵母[12]。在此基础上,本研究对分离出的2 株酿酒酵母的酿造学特性进行深入分析,以期为空心李果酒的生产提供优质菌株。
1 材料与方法
1.1 材料与试剂
酿酒酵母H9、H18:分离于沿河空心李,保存于贵州理工学院非酿酒酵母生理生化研究实验室;商业化酿酒酵母ZYMAFLORE X16(X16)、果胶酶:法国LAFFORT 公司;空心李:市售;葡萄糖、蛋白胨、酵母浸粉、琼脂粉、亚硫酸铋培养基:贵州博奥瑞杰生物科技有限公司;蔗糖、麦芽糖、乳糖、半乳糖、对硝基苯基-β-D吡喃葡萄糖苷(p-nitrophenyl-β-D glucopyranoside,p-NPG):上海源叶生物科技有限公司。
1.2 仪器与设备
紫外分光光度计(UH5300):日本日立公司;pH 计(PHSJ-3F):上海仪电科学仪器股份有限公司;体视显微镜(SZM):宁波舜禹仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪(Biorad T100TM):美国伯乐公司;离心机(H3-18KR):湖南可成仪器设备有限公司;手持式糖度计(PAL-1):日本爱拓公司;超低温冰箱(DW-86L388J):青岛海尔特种电器有限公司;恒温摇床(ZD-85A):常州朗越仪器制造有限公司;恒温培养箱(DHP-420):天津天泰仪器有限公司;电子舌味觉分析系统(SA402B):日本INSENT 公司;气相色谱-质谱联用仪(TQ8040NX):日本岛津公司;顶空固相微萃取系统(TQ8040):美国安捷伦公司。
1.3 方法
1.3.1 菌株活化
将超低温冰箱保存的酿酒酵母H9、H18 以及X16(对照菌株) 划线至酵母提取物蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD)(酵母浸粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L)固体平板上,28 ℃倒置培养48 h,4 ℃保存备用。
1.3.2 菌株生长曲线测定
采用刘晓柱等[13]的光密度法测定菌株的生长曲线。将菌株H9、H18 以及X16 接种至YEPD 液体培养基中,28 ℃、180 r/min 振荡培养40 h,每4 h 进行取样,于600 nm 波长处测定其光密度值(OD600nm)。测定结束后,以各时间点为横坐标,以对应的OD600nm为纵坐标,绘制菌株的生长曲线。
1.3.3 菌株糖代谢性能测定
将菌株H9、H18 以及X16 分别接种至0.6%的酵母浸粉溶液中,并添加2%的不同糖类(葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖)。然后在发酵液中倒置一支杜氏小管。28 ℃发酵48 h,观察杜氏小管顶部是否有气泡产生。有气泡产生,则表明可代谢该糖,标记为“+”,反之,则标记为“-”。
1.3.4 菌株酿造环境耐受性分析
将菌株H9、H18 以及X16 分别接种至YEPD 培养基中。YEPD 含有不同浓度的葡萄糖、乙醇、二氧化硫或柠檬酸。各处理组置于摇床上,28 ℃、180 r/min 培养34 h。培养结束后,测定各处理组的OD600nm。
1.3.5 菌株产β-葡萄糖苷酶性能测定
菌株H9、H18 产β-葡萄糖苷酶性能采用刘晓柱等[14]的p-NPG 法进行测定。酶活力单位(U)定义为pH5.0、50 ℃条件下,1 min 水解p-NPG 产生1 μmol 对硝基苯酚所需酶量。
1.3.6 菌株产硫化氢性能测定
参考Loira 等[15]的方法对菌株H9、H18 产硫化氢性能进行测定。比较菌株H9、H18 在亚硫酸铋培养基上的颜色深浅从而确定其产硫化氢性能强弱。
1.3.7 菌株发酵性能测定
1.3.7.1 发酵空心李果酒的制备
选取成熟、新鲜、无霉烂的空心李,破碎榨汁,加入100 mg/L 偏重亚硫酸钾和20 mg/L 果胶酶处理12 h,调整糖度至24 °Brix,并分成2 组。一组为H9 组,接种终浓度为107cfu/mL 的H9 菌株;另一组为H18 组,接种终浓度为107cfu/mL 的H18 菌株。每组平行重复3 次,25 ℃静置发酵。发酵结束后,将空心李发酵液以3 000 r/min 离心20 min,作为空心李果酒的基酒,用于果酒基本理化指标与香气成分分析。
1.3.7.2 空心李果酒基本理化参数测定
空心李果酒的乙醇体积分数、总糖与总酸含量的测定参照刘晓柱等[13]的方法进行测定。空心李果酒的pH 值采用pH 计进行测定。
1.3.7.3 空心李果酒香气成分测定
采用顶空固相微萃取系统于40 ℃条件下对空心李果酒香气成分进行萃取,萃取时间为30 min。以环己酮为内标,采用气相质谱联用(gas chromatographymass spectrometer,GC-MS) 系统测定空心李果酒香气成分[16]。
1.4 统计分析
数据结果以平均值±标准差表示,采用SPSS 21.0进行数据单因素方差分析检验差异显著性,P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 空心李酿酒酵母的生长特性
菌株H9、H18 的生长曲线如图1 所示。
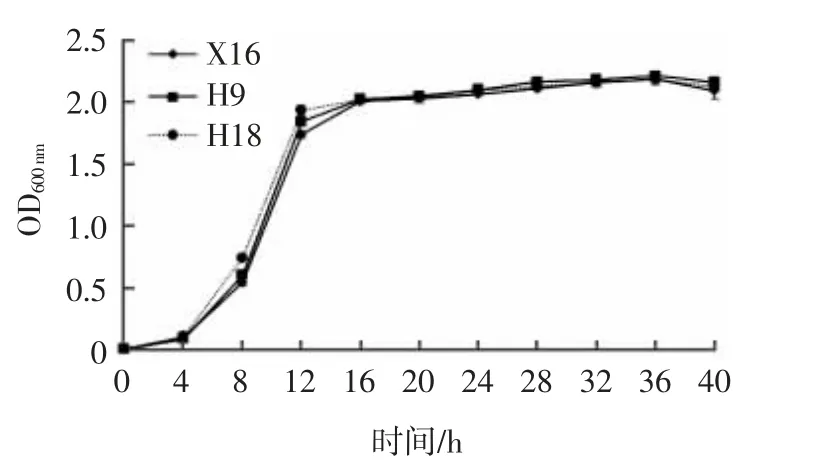
图1 菌株H9、H18 的生长曲线Fig.1 Growth curves of strains H9 and H18
由图1 可知,在培养期40 h 内,包含了适应期、对数生长期、减速期和稳定期4 个阶段。前4 h 为适应期,4~12 h 为对数生长期,16~20 h 为减速期,20 h 以后为稳定期。在对数生长期菌株H18 的生长速率高于商业化酿酒酵母X16;在减速期,菌株H9、H18 的生长速率较为一致,高于X16;在稳定期,菌株H9 和H18 的生长特性与X16 一致。因此,菌株H9 和H18 在对数生长期的生长特性优于X16,在稳定期,菌株H9 和H18 生长特性与X16 一致。综上,菌株H9、H18 生长特性优于X16。
2.2 空心李酿酒酵母的糖代谢特性
菌株H9、H18 的糖代谢特性结果见表1。

表1 菌株H9、H18 糖代谢特性Table 1 Characteristics of sugar metabolism of strains H9 and H18
由表1 可知,2 株空心李酿酒酵母均可代谢所测试的葡萄糖、蔗糖、麦芽糖、乳糖和半乳糖,与商业化的酿酒酵母X16 的特性一致。因而,菌株H9、H18 具有较好的糖代谢特性。
2.3 空心李酿酒酵母的酿造环境耐受性
菌株H9、H18 酿造环境耐受性结果见图2。

图2 菌株H9、H18 酿造环境耐受性Fig.2 The brewing environment tolerances of strains H9 and H18
由图2 可知,菌株H9、H18 在葡萄糖浓度为100~300 g/L、SO2浓度50~300 mg/L 以及柠檬酸浓度15~40 g/L 处理下均可生长,菌体的OD600nm与X16 之间无显著差别(P>0.05)。因此,2 株空心李酿酒酵母对葡萄糖、SO2以及柠檬酸具有较好的耐受性。菌株H9、H18在3%~6%乙醇处理下生长较好;在9%乙醇处理下可以生长,但菌体的OD600nm低于3%和6%乙醇处理组;在12%乙醇处理下,菌体几乎不能生长。因此,H9 和H18 可耐受9%乙醇胁迫环境。各处理组,H9、H18 和X16 菌体的OD600nm没有显著差异(P>0.05),因此,菌株H9、H18 对酿造环境的耐受性与商业化酿酒酵母X16性能一致。
2.4 空心李酿酒酵母的产β-葡萄糖苷酶特性
β-葡萄糖苷酶是一类可水解含β-葡萄糖苷键化合物的酶,有助于游离态香气化合物的释放,可用于食品、化妆品等领域的增香[17-18]。采用p-NPG 法测定的菌株H9、H18 的β-葡萄糖苷酶产生能力结果如表2 所示。

表2 菌株H9、H18 产β-葡萄糖苷酶能力Table 2 β-glucosidase activities of strains H9 and H18
由表2 可知,菌株H9、H18 的β-葡萄糖苷酶的产量分别为(25.52±0.00)U/L 和(25.18±0.02)U/L,与商业化酿酒酵母X16 产酶量无显著差异(P>0.05)。
2.5 空心李酿酒酵母的产硫化氢特性
硫化氢是一种具有臭鸡蛋味道的气体,会对酒体的风味产生不良影响[19-20]。不同菌株产硫化氢特性的比较如图3 所示。

图3 不同菌株产硫化氢特性的比较Fig.3 Analysis of hydrogen sulfide production ability of strains H9 and H18
由图3 可知,菌株H9、H18 滤纸片颜色为棕黄色,与商业化酿酒酵母X16 的颜色基本一致。因此,菌株H9、H18 的产硫化氢性能与X16 一致。
2.6 空心李酿酒发酵性能分析
2.6.1 空心李果酒基酵母本理化参数
采用H9 和H18 酿造的空心李果酒的基本理化参数如表3 所示。

表3 空心李果酒的理化指标Table 3 Basic physical and chemical indicators of Prunus salicina Lindl. cv 'Kongxinli' fruit wine
由表3 可知,2 组发酵空心李果酒的酒精度之间没有显著差异(P>0.05),2 组空心李果酒的总糖含量、总酸含量和pH 值具有显著差异(P<0.05)。其中,菌株H18 发酵空心李果酒的总糖含量和pH 值显著高于H9 组(P<0.05),而总酸含量显著低于H9 组(P<0.05)。
2.6.2 空心李果酒挥发性香气特性
空心李果酒香气化合物检测结果如图4 所示。
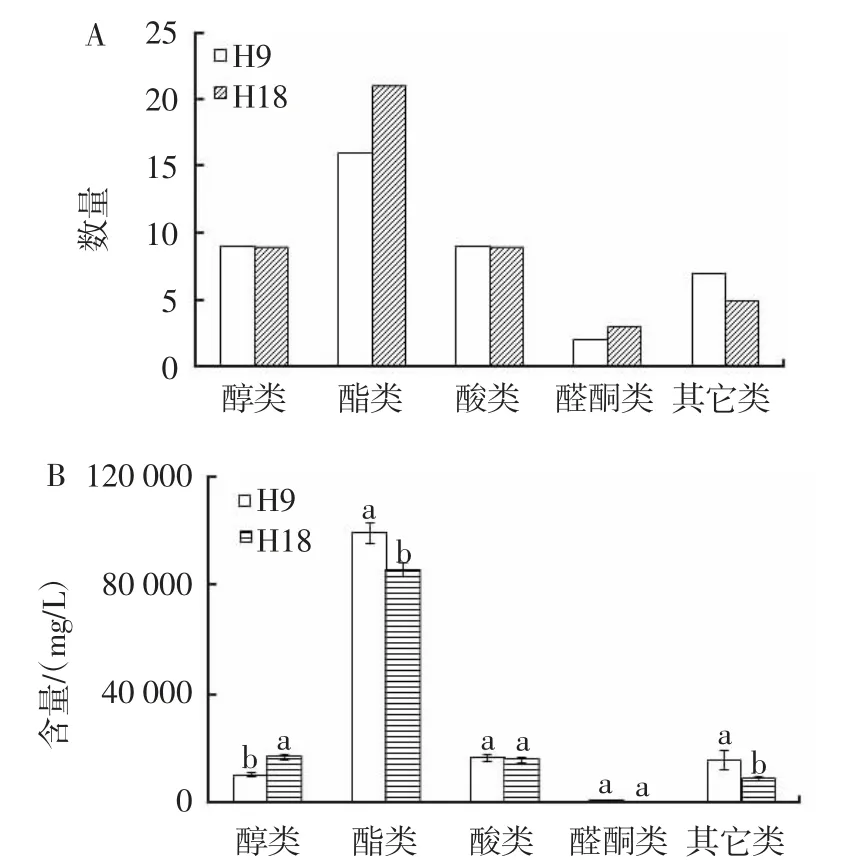
图4 空心李果酒挥发性香气化合物种类与含量Fig.4 Types and amounts of volatile aroma compounds in Prunus salicina Lindl. cv 'Kongxinli' fruit wine
由图4A 可知,2 组空心李果酒中共检测出52 种挥发性香气化合物,其中醇类物质10 种、酯类物质22 种、酸类物质9 种、醛酮类物质4 种、其它类物质7 种。H9 和H18 发酵的空心李果酒中检测出相同数量的醇类和酸类化合物;H18 发酵的空心李果酒含有更多数量的酯类和醛酮类化合物,但其它类化合物的数量低于H9 组。
由图4B 可知,尽管H9 和H18 两组发酵空心李果酒中醇类化合物的种类相同,但H18 酵母发酵的空心李果酒中醇类化合物的含量显著高于H9 酵母发酵的空心李果酒(P<0.05)。此外,H18 组中酯类化合物和其它类化合物的含量显著低于H9 组(P<0.05)。
综上,2 株空心李酿酒酵母对空心李果酒香气特性的影响不同,H18 菌株可增加发酵果酒中酯类和醛酮类化合物的种类,提高醇类化合物的含量;而菌株H9 则增加其它类化合物的种类,提高酯类和其它化合物的含量。因而,菌株H9 和H18 可调节空心李果酒的香气特性,发酵的空心李果酒香气特性各具特色。
3 结论与展望
本研究分析了2 株空心李来源的酿酒酵母的酿造学特性。结果表明,菌株H9 和H18 生长性能整体优于商业化的酿酒酵母X16,对来自于酿造环境的胁迫因素均具有较好的耐受性,与X16 基本一致。此外,产β-葡萄糖糖苷酶和硫化氢的性能也与X16 之间无明显差别。因此,2 株空心李酿酒酵母具有较优的生理性能。
H9、H18 可较好地发酵空心李果酒,发酵酒的酒精度高、总糖含量低。2 株酵母发酵的空心李果酒香气特性迥异,H9 菌株具有调节挥发性酯类和其它类化合物的能力,而菌株H18 则具有调节挥发性酯类和醛酮类化合物的特性。因此,2 株空心李酿酒酵母具有酿造空心李果酒的潜能。但本研究仅局限于实验室规模的测试,其是否具有较好的工业应用潜能,还需要进行中试以及工业化性能的深入分析。

