胚胎干细胞发育相关基因PLK1在细粒棘球绦虫体外不同发育时期差异表达研究
帕力塔吉·麦麦提祖农,吴川川,田梦潇,齐文静,艾柯代·卡得,焦红杰,龚巧巧,李 军,张文宝,,张亚楼,
棘球蚴病是一种被忽视的慢性人兽共患病,通常称为“包虫病”。囊型棘球蚴病(cystic echinococcosis,CE)是一种世界性分布的疾病,由细粒棘球绦虫幼虫引起。CE的高流行区包括中国西部以及中亚、沿地中海、北非和南美洲的国家或地区[1-4]。棘球绦虫是一种寄生在犬科动物肠道中的小型绦虫[5]。细粒棘球绦虫需要两种哺乳动物宿主,包括终末宿主(犬和狼)和中间宿主(牛羊)完成其生活史[5]。犬等食肉动物吞食被感染的牲畜内脏如肝脏或肺,其中含有原头蚴的棘球蚴被肉食动物吞食后在其肠道中发育成成虫。自然状态下细粒棘球绦虫在感染后45 d可以在宿主体内产卵(或孕节脱落的方式将虫卵排除宿主体外)并通过宿主粪便释放到环境中[5]。中间宿主误食虫卵,在其体内发育成为含原头蚴的包囊。当原头蚴被食肉动物吞食后进入下一个循环。
CE是慢性寄生虫病,在人体内可以无症状发展长达15年[6]。国外研究报告显示,新西兰通过每45 d给犬喂食一次驱虫药等措施已成功控制CE在当地的传染[7]。然而至今CE仍然在全球范围内流行,需要控制技术的突破[3,7]。
包虫病在我国高发流行,但目前缺乏有效的技术手段控制该病。新疆流行病区合并的总发病率为4.04%,新疆地区为我国包虫病高发地区之一[8],2005-2020年新疆塔城地区共报告棘球蚴病2 356例,年平均发病率为14.39/10万[9]。2021-2022年对北疆阿勒泰、塔城和伊犁部分牛和绵羊屠宰场进行包虫病调查,查出被感染牛羊141头(只),牛、羊总感染率为2.07%[10]。犬为传播的核心传染源,与人类频繁接触,是感染的主要途径。在流行地区犬远远少于羊,如果可以接种疫苗,将是经济有效的控制手段[11]。但因为成虫发育的研究较少,成虫发育的关键基因研究的更少,目前犬抗细粒棘球绦虫的疫苗研发极为困难。只有对成虫的发育,尤其成虫发育的关键基因进行深入的生物学研究,才能取得疫苗研发的突破。这些研究应当包括对原头蚴向成虫发育的体外模型、关键的分子与调节机制、节片生长与分节、性器官的分化与发育以及虫卵的生成机制等。
Polo样激酶(Polo Like Kinese,PLKs)蛋白家族在哺乳动物干细胞发育分化的生理过程中起重要作用[12]。哺乳动物中PLK1(Polo Like Kinese 1)在多种肿瘤细胞中高表达,是抗癌治疗的重要靶点。曼氏血吸虫SmPlk1的结构和功能分析表明其与哺乳动物PLK1具有高度同源性,在血吸虫有丝分裂和减数分裂中影响卵子生成和精子发生[13],表明PLK1在寄生虫繁殖中的起到关键作用。通过RT-PCR、转录组学和原位杂交实验验证Emplk1在多房棘球绦虫的干细胞中的特异表达[14]。因此,PLK1可作为泡状棘球蚴病、血吸虫病等寄生虫病候选疫苗靶标。
Koziol等人[15]通过基因组学检测不同发育阶段的多房棘球绦虫虫体,发现胚胎干细胞在幼虫阶段特异表达,尤其在其绦虫原头蚴阶段的胚胎层细胞里。有学者提出假设,绦虫生长来源于发育中的成虫颈部区域的生发细胞[16-18]。PLK1抑制剂BI2536体外实验可明显减少虫体存活率,抑制虫体生长发育[14]。PLK1可能是虫体发育、生殖器官生成的关键基因,可能影响胚胎干细胞的产生。本研究利用分子克隆及生物信息学分析的方法对细粒棘球绦虫胚胎发育相关基因PLK1进行克隆并分析其分子特征,为包虫病重组免疫诊断抗原和亚单位疫苗的研发提供理论基础。目前在GenBank中可以查到与编码PLK1蛋白的相似序列EgPlk1和EmPlk1,国内外对于细粒棘球绦虫PLK1蛋白的功能及其胚胎干细胞发育相关研究尚未报道。本试验通过建立细粒棘球绦虫原头蚴向成虫方向发育体外培养模型,用荧光定量PCR方法确定不同发育时期PLK1的表达情况,为探索PLK1基因在细粒棘球绦虫成虫发育中的功能奠定基础。
1 材料与方法
1.1 伦理申明 本研究获得了新疆医科大学第一附属医院伦理委员会的批准(批准号:IACUC-2015,IACUC-2013),所有动物实验和操作均按照中华人民共和国实验动物管理条例进行。
1.2 虫株 细粒棘球绦虫(Echinococcusgranulosus)原头蚴(PSCs)采自于新疆乌鲁木齐市华凌屠宰场的自然感染细粒棘球蚴的绵羊肝脏。
1.3 主要试剂 PRMI-1640培养基、胎牛血清和青霉素链霉素双抗均购于Hyclone公司;酵母提取物、葡萄糖、犬胆汁、胰蛋白酶、胃蛋白酶、1%亚甲基蓝购于Sigma公司;其它试剂包括苏木素染液(北京中杉金桥生物技术有限公司)、PLK1兔抗体(abcon公司)、RNA提取试剂盒(北京天根生化科技有限公司)、cDNA反转录试剂盒、2×SGFast qPCRMix(上海生工生物技术有限公司)。犬胆汁从新疆医科大学生理实验解剖犬得到,1∶10稀释后,0.22 μmol/L滤膜过滤,-20 ℃保存,保存期为1个月。
1.4 方 法
1.4.1 原头蚴的采集 将从新疆维吾尔自治区乌鲁木齐市华凌屠宰场获得被感染的带有包囊的绵羊肝脏,用清水反复冲洗表面。再用75%酒精进行表面消毒,置于生物安全柜中切开包囊,用无菌注射器抽取清亮的囊液,从中分离出细粒棘球绦虫原头蚴,加入适量生理盐水自然沉降3 min,弃去生理盐水,如此重复漂洗5遍,将漂洗干净的原头蚴与1%的胃蛋白酶按1∶10比例(pH 2.0)在37 ℃水浴状态下消化30 min。为使得充分消化,期间每隔5 min颠倒摇晃1次。观察到原头蚴成细沙状且在显微镜下均为单独的个体,即为消化完全,否则可适当增加消化时间或重新配置消化液。
1.4.2 原头蚴的活力检测 消化后的原头蚴用含双抗的 PBS清洗3遍,1 μL原头蚴加入1%亚甲基蓝9 μL染色3 min后检测活力。活性好的原头蚴无着色,活性差和死的原头蚴呈蓝色,重复3次取平均值,活力达到98%以上的原头蚴可用于体外培养试验。
1.4.3 包囊生发层GL(Germinal Layer)细胞采集 绵羊包囊抽取原头蚴和囊液后,置于含有生理盐水的培养皿里。剪开内囊壁,使内囊皮外翻,然后将内囊皮剪碎,加入适量生理盐水后,快速搅拌15 min,自然沉降2 min,将上层细胞悬液移到离心管内,3 000 r/min离心15min,沉淀用生理盐水洗涤3次,即得到细粒棘球绦虫棘球蚴生发层细胞。
1.4.4 体外培养模型的建立 将50 μL沉淀原头蚴(1万枚)用纯水刺激两次,每次浸泡20 s,再用10倍体积的生理盐水平衡。加入含0.02%的犬胆汁,0.2%胰蛋白酶的75 mL细胞培养瓶中,加入含20%胎牛血清的完全培养基50 mL,全培养基配置如表1所示。原头蚴在37 ℃、5% CO2培养箱中培养。第3 d换液观察有无污染情况,弃掉原培养基,加入含0.02%的犬胆汁(无胰蛋白酶)的完全培养基于事先制备好的带有犬血清垫子(75 mL培养瓶加入15 mL犬血清,水浴30~45 min,使血清凝集,放入室温备用)的培养瓶中,继续培养至56 d。每隔3 d换1次培养基,并在镜下观察虫体发育状态。

表1 成虫培养全培养基配置Tab.1 Composition of adult worm cultu medium
1.4.5 不同发育时期虫体收集 培养第0 d、第14 d、第35 d、第56 d的虫体在显微镜下观察拍照并收集样本,部分4%多聚甲醛固定,4 ℃保存,石蜡切片备用。部分放入冻存管中,-80 ℃保存,用于RNA提取。
1.4.6 虫体石蜡切片制作及免疫组化染色 将保存于4%多聚甲醛中的细粒棘球绦虫的原头蚴和成虫虫体分别经蒸馏水冲洗数次后,加热2%琼脂糖至65 ℃,将原头蚴和成虫放入融化的琼脂糖溶液中,冷却后再固定在4%多聚甲醛过夜,制备石蜡切片,70 ℃烘烤过夜。无水乙醇和95%、85%、75%的乙醇各浸泡2 min逐级脱蜡。柠檬酸缓冲液微波炉加热15 min进行抗原修复。3%双氧水避光浸泡10 min封闭内源性过氧化酶,10%山羊血清室温封闭1 h。加入兔抗PLK1抗体(1∶500稀释)4 ℃过夜,室温放置30 min后PBS洗3次,加入羊抗兔IgG二抗(1∶5 000稀释),37 ℃抚育1 h,苏木素染色1 min,盐酸酒精分化10 s,透明30 min,中性树胶封片。
1.4.7 引物设计和合成 参照GenBank上已公布的管家基因β-actin(登录号AB643460.1)、E.gPLK1(登录号XM_024490293.1)mRNA基因序列使用Primer5.0分别设计引物,送北京鼎国昌盛生物科技有限公司合成β-actin的引物序列为:上游引物F:5′-GGTTACATCCCTCCGACCTTG-3′,下游引物R:5′-AAGCAGCCTCCTCTTGAGTG-3′,Tm=58 ℃,片段大小为 183 bp;
E.gPLK1序列前1 800 bp序列的引物序列为:上游引物F:5′-AGAGGGAGGTTTCTTGGA-3′,下游引物R:5′-TCTTCTTTCATTGGAGCA-3′,Tm=62 ℃,片段大小为 1 800 bp。
E.gPLK1序列后1 800 bp序列的的引物序列为:上游引物F:5′-AGAGGGAGGTTTCTTGGA-3′,下游引物R:5′-TCTTCTTTCATTGGAGCA-3′,Tm=60 ℃,片段大小为 1 800 bp。
1.4.8 RNA提取、cDNA合成 取各个发育阶段的虫体 10 μL原头蚴沉淀(约2 000条)或相应体积的沉淀细胞或成虫,按RNA提取试剂盒操作步骤提取虫体RNA,合成cDNA前用DNA酶消化DNA去除基因组DNA。用Mighty Script 第一链cDNA合成试剂盒(Master Mix试剂盒)逆转录合成cDNA。按照下述荧光定量PCR反应体系进行荧光定量PCR。
1.4.9 荧光定量PCR反应 荧光定量PCR反应体系20 μL:2×SG Fast qPCR Mix 10 μL,上下游引物各0.5 μL(10 μmol/L),cDNA 1 μL,用 dd H2O补至25 μL。反应程序:95 ℃预变性5 min;95 ℃变性5 s,65 ℃退火/延伸30 s,共38个循环。每个样本3个重复,程序结束后自动得出Ct值。
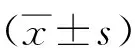
2 结 果
2.1 PLK1基因序列测定和氨基酸序列一致性比较 细粒棘球绦虫PLK1基因(EgPLK1)鉴定:利用DNA提取试剂盒,检测DNA浓度,浓度大于50 ng/μL,DNA浓度合格后,扩增原头蚴EgPLK1基因,所获得PCR产物经1%琼脂糖凝胶电泳分析,细粒棘球绦虫原头蚴cDNA样品经PCR扩增出的目的片段与预期大小相符。结果显示EgPLK1片段相应位置出现阳性扩增带,如图1。PCR扩增产物测序结果显示,EgPLK1开放阅读框为3 441 bp,编码1 146个氨基酸;理论等电点为7.33;不稳定指数为36.34,为不稳定蛋白;脂肪系数为106.46;亲水性疏水性平均值为0.958,为疏水性可溶性蛋白。
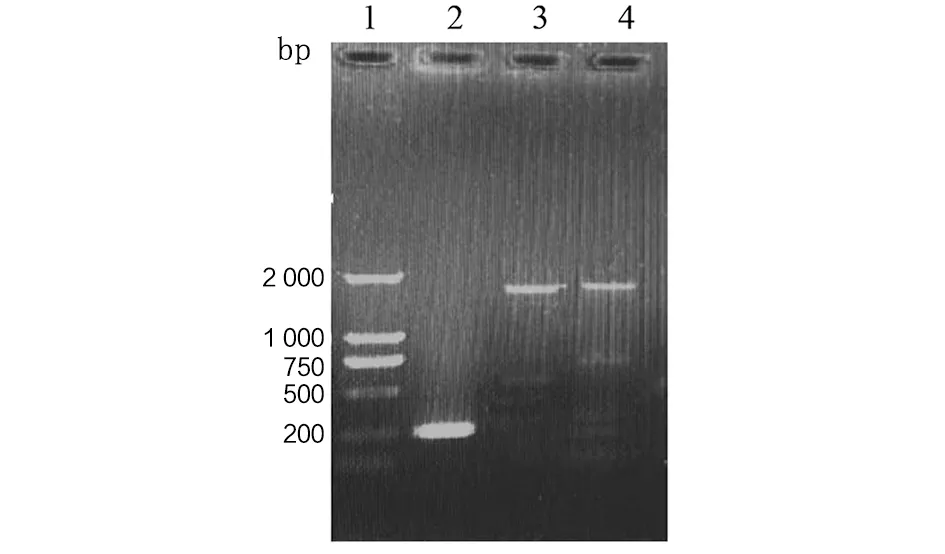
1.DL2000分子标准质量; 2.管家基因扩增产物; 3. 细粒棘球绦虫PLK1序列前1 800 bp片段; 4. 细粒棘球绦虫PLK1序列后1 800 bp序列。图1 PCR扩增产物Fig.1 PCR amplification products
序列比对发现EgPLK1基因的测序结果与GenBank的EgPLK1(登录号XM_024490293.1)序列一致。EgPLK1(登录号XM_024490293.1)与多房棘球绦虫PLK1基因(EmPLK1)(登录号:HG931729.1)核苷酸序列一致性为96.88%。系统进化树结果表明,EgPLK1与埃及血吸虫(XM_051208928.1),秀丽线虫(AF080581.1),旋毛虫(ES568453.1)亲缘关系较近,与人类(NP_005021.2),小鼠(NP_035251.3),家猫(XP_003998811.1)的亲缘关系较远;EgPLK1与EmPLK1同源性达100%。如图2。
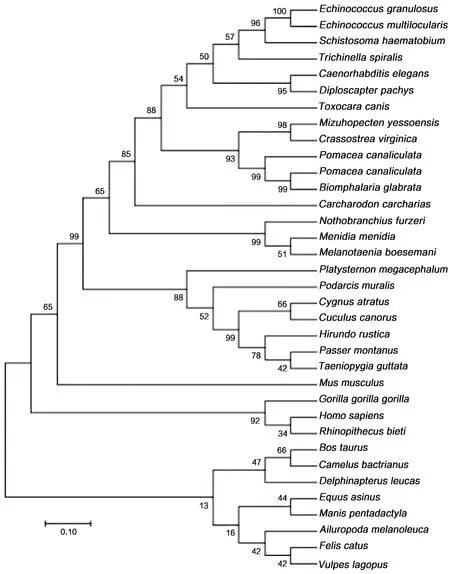
图2 PLK1基因在不同物种之间系统进化树分析Fig.2 Phylogenetic analysis of PLK1 in different species
2.2 棘球绦虫原头蚴向成虫体外发育模型的建立 细粒棘球绦虫原头蚴向成虫方向体外发育见图3。胃蛋白酶消化处理后获得原头蚴活力近98%,此时原头蚴呈现两种形态:一种为顶突凹陷未外翻状态,另一种为顶突外翻状态。未经适当浓度的胆汁酸盐和胰蛋白酶刺激外翻的原头蚴长期培养会发育成微囊或者萎缩崩解死亡。经刺激后82.7%的原头蚴保持外翻状态往成虫方向发育。原头蚴顶突和4个吸盘完全外翻后表现明显的活动性,伸缩蠕动。细粒棘球绦虫在此培养系统中培养17~21 d后产生第2个节片,在25~30 d产生第2和第3个片段,35~45 d大部分成虫产生第3个节片,培养后50~55 d产生第4个片段。观察发现具有3个节片的细粒棘球绦虫的虫长平均为(2.39±0.12)mm。当成虫有4节片时细粒棘球绦虫平均为(3.12±0.17)mm。培养14 d后,74.4%原头蚴保持外翻状态并且体节有明显增长趋势,7.4%成囊方向发育,死亡率为10.57%。发育至 21 d后,有56.2%成虫发育至两个节片,死亡率为6.59%。其头颈节以下第2节片狭窄区域清晰看到生殖器官雏形;培养第35 d时,31.16%成虫形成3节;成虫发育到45 d时有26.5%发育到4个节片,此时第3和第4节片成虫比例总和已达到45.7%;培养第56 d部分成虫出现孕节,观察到明显的雌性器官子宫的产生,却未观察到雄性器官睾丸的产生。此阶段成熟虫体由头颈节、幼节、成节、孕节组成,4~5节占比高达40.32%,死亡率为9.84%(图3B)。
2.3 PLK1基因在细粒棘球绦虫体外发育不同时期的表达分析 以细粒棘球绦虫β-actin基因作为管家基因,对原头蚴、成虫、包囊生发层cDNA利用荧光定量PCR法进行基因表达相对定量测定,获得Ct值通过2-Δ ΔCt法计算,结果见图4A-B。在原头蚴外翻后的0 d阶段和培养至14 d 样本mRNA相对表达量进行比较发现,激活后0 d原头蚴PLK1基因表达量为14 d成虫的2.7倍;随着体外培养天数的增加其表达量升高,第35 d(发育至2~3节成虫)时PLK1表达量为14 d时的8.2倍,mRNA表达量差异有统计学意义(F35 d= 276.85,P<0.05);培养第50 d(培养至4~5节成虫)时,与35 d表达量差异无统计学意义(P>0.05)。50 d与0 d、14 d相比PLK1表达量差异有统计学意义,如图4A(F14 d= 276.85,P<0.05)。表明成虫分节片旺盛期随着干细胞分化加快,PLK1表达量随着增高。

A.培养0 d、14 d、35 d、50 d的成虫PLK1的mRNA相对表达量; B.原头蚴,成虫,生发层PLK1的mRNA相对表达量(PSC:原头蚴; AW:成虫; GL:生发层)。ns:P>0.05;*:P<0.05;**:P<0.01图4 PLK1基因在细粒棘球绦虫不同阶段mRNA表达水平Fig.4 PLK1 gene mRNA relative tanscription in different development stage of E.granulosis
细粒棘球绦虫原头蚴(0 d), 成虫(50 d), 包囊三大发育关键阶段PLK1基因 mRNA相对表达量进行比较发现包囊生发层PLK1表达量最高,为激活原头蚴表达量的16.2倍,成虫阶段表达量的5.9倍。mRNA表达量差异有统计学意义(FGL=210.25,P<0.05)。表明该基因可能在细粒棘球绦虫胚胎发育阶段表达量明显高于其他阶段。各时期的表达量差异有统计学意义(P<0.05),如图4B。
2.4 EgPLK1基因在细粒棘球绦虫体外发育成虫不同部位的表达分析 绦虫的生长是以链体的延长为基本生物学特点。而其生长面为头节的末端,其中含有干细胞群。为了确定PLK1基因是否在这个区域高表达,我们将培养56 d的成虫在光学显微镜下切割分为两部分,一部分包括头节和颈部生长区域,另外一部分为颈节之后的部分。定量PCR结果显示EgPLK1在细粒棘球绦虫成虫阶段头颈节与体节这部分高于颈节下的部分。图5A为培养56 d细粒棘球绦虫成虫头节和颈节切割后的显微结果;图5B为培养56 d细粒棘球绦虫成虫切割后成熟体节的显微结果;图5C为A和B中采样的虫体和头颈节中EgPLK1基因的表达量,可以看出,EgPLK1基因在细粒棘球绦虫成虫头颈节mRNA表达量是成熟体节的1.9倍数,mRNA表达量差异有统计学意义(F=14.87,P<0.05)。

A.培养56 d成虫进行切割对头颈节进行采样;B.培养56 d成虫进行切割对虫体进行采样;C.两种的样本进行RT-qPCR 实验PLK-1基因mRNA表达量 (a:头节;b:成节;c:生殖孔);标尺:100 μm;**P<0.05。图5 PLK1基因在Eg成虫不同部位mRNA表达水平(4×10)Fig.5 PLK1 mRNA relative transcription in different part of adult worm(4×10)
2.5 虫体免疫组化染色结果 为了进一步对EgPLK1在幼虫,成虫表达定位,我们将PSC, AW琼脂糖固定的虫体石蜡切片进行免疫组化实验,结果如图6所示,图6-A为细粒棘球绦虫原头蚴;其中CU原头蚴被膜; SU原头蚴吸盘;图6-B为细粒棘球绦虫成虫;可以看出,在幼虫阶段,PLK1在原头蚴虫体被膜低表达,吸盘底部高表达;在成虫阶段,PLK1在成虫的头颈节与幼节连接处出现带状阳性区域,说明成虫节片发育分化原发部位在头颈节幼节连处。

A:a和c为对照组用正常小鼠血清探测;b和d为用抗EgPLK1抗血清探测原头蚴。B:a和e为用正常小鼠血清探测成虫;b、c、d、f、g和h为用抗EgPLK1血清探测成虫。图6 PLK1基因在细粒棘球绦虫原头蚴,成虫不同部位表达定位(A.a-b, B.a-d:10×10;A.c-d, B.e-h:40×10)Fig.6 Probing PLK1 in protoscoleces (A) and adult worms (B) of E. granulosus with anti-EgPLK1 antibodies(A.a-b, B.a-d:10×10, A.c-d, B.e-h:40×10)
3 讨 论
棘球绦虫成虫在犬肠道中发育的几个关键步骤包括胃肠道溶液激活原头蚴、原头蚴外翻、头节附着到肠壁、虫体分节、性器官发育和产卵[5]。这是在45 d内细粒棘球绦虫成虫发育的一个复杂过程[5]。由于涉及伦理问题和感染风险,很难用犬作为动物模型来研究棘球绦虫的发育。国外很多学者在长达30多年的探索过程中也未能体外完全模拟整个体内发育过程。Smyth等率先研究并探索出了适用于幼虫和成虫阶段的体外培养模型[19-22]。但我们用Smyth的方法,只有7%~10%的原头蚴在培养的前两周向成虫方向发展,以后大部分的虫体或向包囊方向发育,或死亡。本研究,通过对培养前原头蚴的刺激处理和培养方式的优化,使50%~90%的原头蚴向成虫方向发育。成功地在56 d培养了含有4个体节的细粒棘球绦虫,与犬自然感染的发育时间相仿。比Smyth的67 d缩短了10 d,说明培养体系优于Smyth,接近自然感染的生长速度。本研究中我们发现在培养后14~21 d,虫体开始分裂生成第一体节即幼节,其中颈节与幼节分界是由虫体被膜折叠形成,颈节底部区域延伸,虫体被膜内折形成一个新的节片。此后虫体发育和生长速度较快。成虫发育过程包括性器官的形成发生在此阶段。这过程胚胎发育相关基因PLK1的研究对更好了解胚胎干细胞功能具有重大意义。在我们的研究中培养第21 d成虫活力较高,节律性伸缩明显。培养第35 d表现为幼节持续增长,部分发育出第3节片即成节;培养第45~50 d孕节出现,但在培养至65 d虫体不能进一步发育,未观察到生殖器官明显发育成熟或虫卵产生。
由于胚胎干细胞对棘球绦虫的无性繁殖具有决定性作用,在绦虫的整个生命周期中作为一个独立的未分化细胞群,生殖细胞可视为棘球绦虫体细胞增殖的唯一来源[15]。棘球绦虫幼虫期发育独特,通过具有干细胞特性的生发层细胞的增殖而生长,也是通过生发层细胞的分化而生成原头蚴,这是无性出芽繁殖的过程。在成虫的生长过程中,链体的增殖是通过头节下端的胚性细胞群的增生来实现的。这种独特的增殖潜能表明干细胞是全能的,并具有广泛的自我更新能力[15]。在本研究通过精确定位PLK1在虫体内表达,验证了胚性细胞群在虫体的具体分布。由于胚性细胞群本身在虫体内起发育分化的主要功能,分布位置特殊,通过靶向药物干预的方式达到更彻底的杀虫效果。因此它们对开发化疗药物以防止寄生虫增殖具有最重要意义。
胚胎干细胞通常为绦虫的体细胞增殖提供全能干细胞[10],很早就有学者提出形成棘球蚴生发层(GL)的未分化细胞群负责宿主器官内寄生虫幼虫的肿瘤样浸润性生长。即使从生发层的正常组织环境中转移,生发细胞也能够产生新的组织[13],因此胚胎干细胞可成为在研究防止寄生虫增殖和转移形成的抗棘球蚴药物的关键靶点。
Schubert等人[14]筛选出棘球绦虫胚胎发育特异性表达基因PLKs基因家族,研究显示EmPLK1可以特异性的调节胚胎干细胞的增殖。Kothe等人[23]先前鉴定了PLKs抑制剂BI 2536与人PLK1的特异性结合。这种最初设计用于抑制人类同源PLK1的化合物BI 2536在体外干扰棘球蚴幼虫的生发层胚胎干细胞并阻止了寄生虫的生长和发育。10 nmol/L剂量BI 2536处理的原头节实验中胚胎干细胞的数量减少了50%[14],说明EgPLK1可以作为药物研发的靶蛋白。
有研究报道BI 2536在体外诱导曼氏血吸虫性腺的显著变化并影响了卵子产生和精子发生[13]。本研究结果显示,随着体外培养天数的增加PLK1表达量升高,第35 d表达量为14 d时的8.2倍。细粒棘球绦虫体外培养35 d,PLK1表达量远远高于幼虫阶段。35 d 时PLK1表达量明显增高预示PLK1的表达与胚性细胞群的增殖与发育分化正相关,虫体性器官发育趋势可能与PLK1表达相关,可能影响生殖器的发育成熟和精子的产生。结果显示培养至56 d未能观察到生殖器官明显成熟特征。第35 d与56 d PLK1表达量变化不明显,由于体外培养虫体性器官发育的滞后,PLK1表达量没有进一步升高。
对细粒棘球绦虫原头蚴,成虫,包囊mRNA表达量进行比较发现包囊生发层PLK1表达量最高,为激活原头蚴表达量的16.2倍。提示PLK1存在针对AE、CE病人特异性药物研发的靶蛋白潜力。
有研究报道,多房棘球绦虫发育过程中的细胞增殖情况,证明了具有有丝分裂活性的寄生虫干细胞分布在整个胚层,并在幼虫囊和原头节芽中大量积累。在晚期原头节中,干细胞明显位于发育中的吸盘底部,但也存在于头颈后的体节[15]。本研究结果表明干细胞明显位于发育中的原头节的底部(吸盘的后面)。在成虫发育阶段PLK1基因在虫体头颈节片区域高表达,这个区域是成虫节片增殖的唯一区域,成虫节片增殖是从颈节处胚胎干细胞层往远端生长。即说明干细胞发育相关基因PLK1可以作为两型包虫病疫苗研发和治疗新药物靶点,从而为两型包虫病的治疗提供新途径。
总之,PLK1在包囊生发层细胞高表达,提示PLK1为原始胚胎干细胞基因;体外培养的虫体分节片表达量迅速增加,可能由于虫体干细胞进行有丝分裂来对发育新节片提供机体所需功能细胞。生发细胞对棘球绦虫的无性繁殖起着决定性作用,因此胚胎干细胞可以成为开发防止寄生虫增殖的化疗药物的最重要的细胞类型之一。通过体外培养,可以获得不同发育时期的细粒棘球绦虫,为研究干细胞基因表达以及基因干预提供材料,同时可为明确PLK1基因在成虫发育及虫卵产生中的功能,为犬用疫苗靶抗原奠定理论基础。
利益冲突:无
引用本文格式:帕力塔吉·麦麦提祖农,吴川川,田梦潇,等.胚胎干细胞发育相关基因PLK1在细粒棘球绦虫体外不同发育时期差异表达研究[J].中国人兽共患病学报,2023,39(8):719-726. DOI:10.3969/j.issn.1002-2694.2023.00.077

