《新生儿遗传代谢病筛查质量指标共识》应用评价与优化建议
国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查实验室室间质量评价专家委员会
新生儿筛查是出生缺陷三级防控的最后一道防线,也是全球公共卫生防控成功的典范之一,对有效防控先天性与遗传性疾病起到了积极的作用[1-2]。目前,全球应用最为广泛的新生儿筛查项目是遗传代谢病筛查和听力筛查[3-5]。自1981年以来,中国开始实施两种遗传代谢病的筛查,即苯丙酮尿症(phenylketonuria,PKU)和先天性甲状腺功能减退症(congenital hypothyroidism,CH)的筛查[6]。当前,我国开展新生儿筛查的遗传代谢病已达40余种,每年约有900多万新生儿接受数百家新生儿遗传代谢病筛查(简称新筛)实验室提供的筛查服务。然而,由于筛查的人群基数庞大,参与筛查的实验室数量较多,故在如何保持各实验室筛查质量的高水平、同质化方面存在挑战巨大。
为规范新筛流程、提高各实验室筛查质量,2014年,新筛实验室室间质量评价(简称质评)专家委员会参照国家卫生健康委员会(简称卫健委)临床检验中心(National Center for Clinical Laboratories,NCCL)质量管理的要求,讨论、制订了包含16项筛查质量指标(quality indicators,QIs)的专家共识[7],并于2017年向全国新筛实验室发布,要求全国范围内从事新筛工作的实验室定期向NCCL新筛实验室室间质评系统(https:∥www.nccl.org.cn/show EqaPt Detail?id=1501)登记与上报新筛质量数据。目前,这些指标的筛查质量回报工作以每年1次的频率常规开展,持续时间已逾8年。为评价该16项QIs对全国新筛实验室质量管理的监测情况,新筛实验室室间质评专家委员会基于2015—2020年全国新筛实验室的QIs数据,分析、评价了各指标的变化趋势,并提出QIs优化方案,形成本建议,为后续制订相关共识提供依据,从而持续推进我国新筛实验室质量管理水平的提升。
1 对象与方法
1.1 评价对象 应用观察性研究方法,以全国新筛实验室为评价对象,基于NCCL新筛实验室室间质评系统,收集2015—2020年全国31个省、市、自治区的新筛实验室上报的QIs数据。
1.2 方法 观察各QIs在不同性质、不同地区实验室的差异,以及其在各实验室不同年份的变化趋势,分析、评价各实验室综合质量管理水平,并进一步精简、优化指标构成。
1.2.1 QIs定义 16项QIs分别涵盖新筛的检验前、中、后3个阶段。①检验前包括:健康教育知晓率(QI1=签署知情同意书数÷同期活产总数×100%)、不合格血片(即新筛样本)百分比(QI2=不合格血片数÷同期接收的血片总数×100%)、重要信息遗漏百分比(QI3=遗漏重要信息血片数÷同期接收的血片总数×100%)、血片周转及时率(QI4=规定时间内完成转运的血片数÷同期血片总数×100%)。②检验中包括:基本QIs,检验报告周转及时率(QI5=规定时间内发出报告数÷同期报告总数×100%)、室内质量控制(简称质控)开展率(QI6=开展室内质控项目数÷同期筛查项目总数×100%)、室内质控变异系数不合格率(QI7=室内质控项目变异系数高于要求的检验项目数÷同期有要求的项目总数×100%);疾病相关QIs,初筛阳性率(QI8=初筛阳性人数÷同期筛查总人数×100%)、初筛阳性召回率(QI9=初筛阳性召回人数÷同期初筛阳性总人数×100%)、召回阳性率(QI10=召回复查阳性人数÷同期实际召回人数×100%)、筛查阳性率(QI11=召回复查阳性人数÷同期筛查总人数×100%)、阳性预测值(QI12=确诊人数÷同期筛查阳性召回总人数×100%)、筛查病种患病率(QI13=确诊人数÷同期筛查总人数×100%)、筛查假阴性率(QI14=假阴性人数÷同期筛查的实际阳性人数×100%)。③检验后包括:筛查率(QI15=出生20 d内接受筛查婴儿数÷同期活产总数×100%)、失访率(QI16=失访人数÷同期筛查总人数×100%)。上述16项QIs的详细定义见参考文献[7-8]。
1.2.2 新筛实验室种类及地区分层 按照实验室所属性质,将新筛实验室分为新筛中心(newborn screening centers,NBSCs)与非新筛中心(non-NBSCs)两种。其中,NBSCs主要为各地区卫健委审批及直接管理的实验室,纳入统一管理;non-NBSCs主要为医院的检验科及第三方检测机构,相关筛查项目由各机构自行开展。按照实验室所属地区,分为东部、中部、西部地区实验室。东部包括北京市、天津市、辽宁省、上海市、江苏省、浙江省、福建省、山东省、广东省;中部包括安徽省、海南省、河北省、河南省、黑龙江省、湖北省、湖南省、吉林省、江西省、山西省;西部地区包括甘肃省、广西壮族自治区、贵州省、内蒙古自治区、宁夏回族自治区、陕西省、四川省、西藏自治区、新疆维吾尔自治区、重庆市、云南省、青海省。
1.3 统计学处理 应用R4.1统计学软件。计数资料(即QIs)以百分率(%)表示。多项QIs的综合评价应用雷达图和TOPSIS分析[9-10]。以P<0.05为差异有统计学意义。
考虑到疾病相关质量指标具有疾病特异性,本评价项目进行多项QIs综合评价时仅纳入了检验前的QI1~QI4、检验中的QI5~QI7和检验后的QI15、QI16共9项QIs。其中QI1、QI4、QI5、QI6、QI7、QI15为高优指标,即指标数值越大代表实验室质量管理越好,QI2、QI3、QI16为低优指标,即指标数值越小代表实验室质量管理越好。由于QIs值均以百分率表示,故在综合评价时为保持所有QIs的同向化,本评价项目对QI2、QI3、QI16进行了转换,分别以1-QI2、1-QI3、1-QI16形式进行评价。
在应用雷达图分析时,采用雷达图面积(Area)进行综合评价,QIs的百分率越大,数值偏离雷达图圆心的程度越高(即雷达图面积越大),代表实验室综合质量管理水平越高。在应用TOPSIS分析时,采用接近程度(Proximity,Pr)进行综合评价,分别计算QIs与最优值和最劣值的欧式距离,然后求出评价指标与最优方案之间的Pr值,Pr值取0~1之间。Pr值越接近1,表明实验室综合质量管理水平越接近最优值,Pr值越接近0,表明实验室综合质量管理水平越接近最劣值。
为优化现行QIs,进一步采用多个指标的不同组合,进行综合雷达图和TOPSIS分析以削减不必要的QIs。通过在检验前、检验中和检验后3个阶段分别选取不同QIs进行新的排列组合(每个阶段至少包含1项QI),比较删除某1项或多项QIs前、后每种排列组合的雷达图面积和TOPSIS分析的Pr值的差异:①计算两者距离的相似性,采用欧式距离进行衡量;②采用Spearman相关性分析衡量雷达图面积与TOPSIS分析的Pr值的一致性。
2 评价结果
2.1 新筛实验室分布情况 2015—2020年,我国新筛实验室数量逐年增加,从2015年的154家增加至2020年267家。按照实验室种类,我国新筛实验室主要以NBSCs为主,截至2020年NBSCs数量为193家,non-NBSCs为74家。值得注意的是,近年来NBSCs的占比有所下降,如从2015年的93.5%(144/154)下降至2020年的72.3%(193/267),而non-NBSCs占比越来越高,从2015年的6.5%(10/154)增至2020年的27.7%(74/267)。按照实验室地区分布,不同地区实验室数量逐渐趋于均衡,东部地区占比从2015年的45.5%(70/154)下降至2020年的37.8%(101/267),西部地区占比略有提高,从2015年的25.3%(39/154)增至2020年的31.8%(85/267),中部地区实验室占比基本平稳在30.0%左右[2020年为30.3%(81/267)]。见图1。
2.2 不同种类、不同地区新筛实验室检验前、中、后QIs变化情况(重点阐述2020年数据) 在检验前的QIs中,NBSCs的QI1值在2015—2020年呈平稳增高趋势,non-NBSCs的QI1值在2015—2019年呈总体下降趋势,在2020年略有上升;2020年的NBSCs的QI1值高于non-NBSCs,分别为99.2%和92.1%。在各年份,non-NBSCs的QI2值均高于NBSCs,2020年non-NBSCs的QI2值为0.8%,高于同年NBSCs的0.4%。NBSCs和non-NBSCs的QI3值在2015—2020年波动均相对较大,2020年的NBSCs的QI3值为2.5%,高于同年non-NBSCs的1.6%。NBSCs的QI4值在2015—2020年相对平稳,non-NBSCs的QI4值在2015—2017年呈明显降低趋势,2018—2020年在波动中上升,但仍低于2015年;2020年的NBSCs的QI4值略高于non-NBSCs,分别为92.3%和89.4%。见图2A。
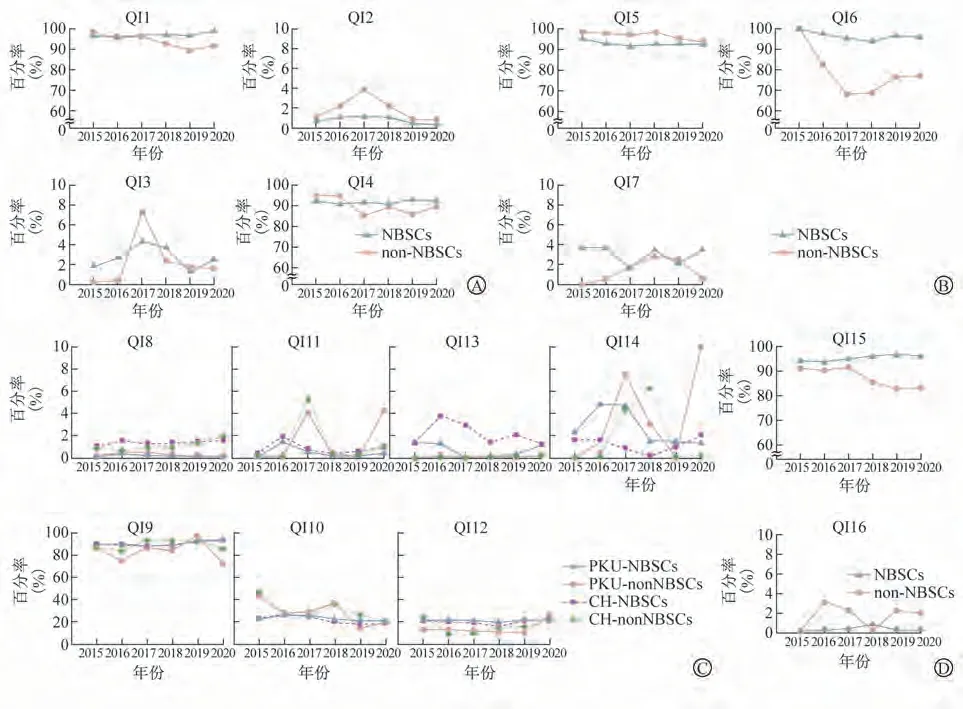
图2 2015—2020年不同种类新筛实验室各QIs的变化趋势
在检验中的基本QIs中,non-NBSCs的QI5值在2015—2019年均高于NBSCs,至2020年non-NBSCs与NBSCs的QI5值趋于接近,分别为93.0%和94.1%。自2015年后,NBSCs的QI6值均明显高于non-NBSCs,至2020年non-NBSCs的QI6值略有上升,为77.1%,但仍明显低于NBSCs的95.4%。除2017和2019年外,NBSCs的QI7值均明显高于non-NBSCs,2020年NBSCs与non-NBSCs的QI7值分别为3.5%和0.5%。见图2B。
在检验中的与疾病相关QIs中,2015—2020年,PKU的QI8值在NBSCs和non-NBSCs中均维持于0.2%~0.6%;CH相关QI8值在NBSCs中均维持于1.1%~1.6%,在non-NBSCs中均维持于0.7%~2.0%,变化趋势较为接近。PKU及CH相关的QI9值在NBSCs中整体变化趋势基本重合,比较平稳,均维持于87.7%~93.8%,而在non-NBSCs中有所波动,2020年non-NBSCs中PKU及CH相关的QI9值分别为72.2%和85.8%。PKU相关的QI10及QI11值在non-NBSCs中波动相对较大,分别维持于15.5%~44.0%和0.1%~4.3%,而在NBSCs中相对平稳,分别维持于18.4%~26.8%和0.1%~1.4%;同样,CH相关的QI10及QI11值在non-NBSCs中波动较大,分别为20.8%~47.5%和0.2%~5.4%,而在NBSCs中比较平稳,分别维持于21.8%~27.3%和0.5%~2.0%。在2015—2019年,PKU相关NBSCs的QI12值高于non-NBSCs,而2020年non-NBSCs则高于NBSCs,分别为26.3%和21.7%;CH相关的QI12值在non-NBSCs中维持于8.7%~25.0%,在NBSCs中维持于15.4%~22.1%。PKU相关的QI13值在NBSCs略有波动,维持于0.1%~1.4%,而在non-NBSCs相对平稳,均维持于0.2%以下;2015—2020年,CH相关的QI13值在NBSCs中均高于non-NBSCs,分别维持于1.3%~3.7%和0.3%以下。PKU及CH相关的QI14值在non-NBSCs中波动均大于NBSCs,如在non-NBSCs中分别维持于0.1%~10.0%和0.1%~6.3%,而NBSCs中分别维持于1.3%~4.9%和0.2%~2.0%。见图2C。
在检验后的QIs中,2015—2017年NBSCs的QI15值略高于non-NBSCs,而在2018—2020年non-NBSCs的QI15值大幅降低,且明显低于NBSCs,两值分别维持于95.7%~96.5%和82.8%~91.6%。NBSCs的QI16值在2015—2020年始终维持于较低水平,其中2018年最高为0.9%,其余年份均<0.5%,non-NBSCs的QI16值除在2015和2018年<0.5%外,其余年份均>2%。见图2D。
2.3 雷达图和TOPSIS分析综合评价各新筛实 验室QIs的综合质量管理水平 NBSCs的QIs综合质量管理水平的雷达图面积(Area=2.87)显著大于non-NBSCs(Area=2.71,P<0.000 1)。从调查年份角度,NBSCs的QIs综合质量管理水平的雷达图面积随着时间推移逐渐增大,而non-NBSCs的雷达图面积自2015年起大幅度减小,至2020年略有增大,其当年的雷达图面积(Area=2.51)显著小于同年的NBSCs(Area=2.83,P<0.000 1)。见图3A、3B。

图3 应用雷达图面积综合评价各新筛实验室QIs的综合质量管理水平
东部地区新筛实验室QIs综合质量管理水平的雷达图面积(Area=2.88)显著大于中、西部地区(Area=2.85、2.86,P值均<0.05)。各地区雷达图面积的波动在不同年份存在一定差异,2015-2016年东部和中部地区的雷达图面积小幅增大,而西部地区略有减小;2016-2017年东部和中部地区呈不同幅度减小,甚至在2017年达各年份最小值(Area=2.80、2.64),而西部地区显著增大,在2017年达各年份最大值(Area=2.81);2017年起,东部和中部地区的雷达图面积开始增大,东部地区逐步达到2016年水平,中部地区在波折中缓慢上升,至2020年仍低于2015年水平,西部地区在小幅减小后逐年增大,至2020年接近2017年水平。2020年,东部地区的雷达图面积(Area=2.83)显著大于中部和西部地区(Area=2.69、2.81,P值均<0.01)。见图3C、3D。
TOPSIS分析结果显示,NBSCs的QIs综合质量管理水平的Pr值总体为0.93,显著大于non-NBSCs的0.86(P<0.001)。2015年,non-NBSCs的Pr值显著大于NBSCs的Pr值,此后non-NBSCs的Pr值大幅度减小,而NBSCs的Pr值在波动中增大,2020年NBSCs的Pr值为0.94,显著大于non-NBSCs的0.84(P<0.001)。见图4A、4B。

图4 采用TOPSIS分析综合评价新筛实验室QIs的综合质量管理水平
东部地区的Pr值总体为0.93,显著大于中、西部地区的Pr值(0.90、0.92,P<0.05)。2015—2018年,东部、中部、西部的Pr值呈总体减小趋势,2019年中部地区的Pr值显著增大,与同年东部和西部地区的Pr值几乎相同;2020年东部地区的Pr值为0.92,显著小于西部地区的0.93,大于中部地区的0.89(P<0.05)。见图4C、4D。
Spearman相关性分析结果显示,TOPSIS分析与雷达图面积就各种类、各地区实验室,以及其在不同年份的QIs综合质量管理水平的评价结果具有较高的一致性(r=0.99)。见图5。

图5 TOPSIS分析和雷达图面积评价新筛实验室QIs综合质量管理水平的一致性
2.4 检验前、中、后QIs的优化分析 为了优化与精简现行新筛质量评价指标,依据以上结果,本评价项目进一步采用多个指标进行不同组合,综合雷达图面积及TOPSIS分析结果进行指标优化,削减不必要的QIs。通过对检验前、中、后3个不同阶段QIs的排列组合(每个阶段至少包含1项QI),比较删除1项或多项QIs前、后综合评价结果的一致性。结果显示,排除QI1、QI2、QI3、QI16及QI2+QI16组合指标后可达到同样的评价效果(P>0.05),见图6A、6B。以QI3为例,雷达图面积和TOPSIS分析结果均显示,删除QI3前、后,QIs综合质量管理水平的差异均无统计学意义(P=0.51、0.91),见图6C、6D。

图6 应用雷达图面积和TOPSIS分析评价质量QIs的优化效果
3 应用评价与建议
本评价项目基于全国新筛实验室于2015—2020年间连续6年的监测数据,首次全面分析了我国新筛实验室的质量管理水平与现状,为进一步优化、制订我国新生儿筛查的公共卫生防控策略奠定了基础。
建议1 建议对数量大幅增长的non-NBSCs进一步加强质量控制与管理。
建议2 建议进一步优化中、西部地区的新生儿筛查相关公共卫生防控策略。
3.1 新筛工作覆盖范围越来越广 过去几十年里,我国政府对新筛工作投入了大量的精力。2020年,全国范围内已建立新筛实验室267家,其中NBSCs 193家,non-NBSCs 74家。值得注意的是,随着医院及第三方实验室迅速增多,non-NBSCs占比越来越高,从2015年的6.5%增至2020年的27.7%。因此,为保证新生儿筛查质量,规范第三方实验室的质量管理尤为重要,建议进一步加强non-NBSCs的质量控制与管理。研究[11]显示,2007年新生儿筛查在地区分布上欠均衡,我国东部、中部和西部地区的覆盖率分别约为84.90%、30.41%和19.82%。为了促进新筛工作在各区域间的均衡发展,特别是在偏远的西部地区,国家卫健委自2012年起启动了贫困地区新生儿疾病筛查项目。2014年该项目覆盖了21个省的364个县[12],对这些地区的新生儿进行了PKU和CH筛查,截至2018年,已有600多万新生儿从该项目中获益。本评价项目的调研结果显示,至2020年,我国不同地区新筛工作覆盖率已逐渐趋于均衡,如该年新筛实验室数量在东部、中部和西部地区占比分别为37.8%(101/267)、30.3%(81/267)及31.8%(85/267)。
3.2 新筛工作质量管理水平应进一步提升 为了保障新筛工作质量,NCCL制订了筛查质量保证计划,包括内部质量和外部质量控制,以确保所有新筛工作检测的准确性[13-14]。然而,值得注意的是,2015—2020年,我国NBSCs的综合质量管理水平稳步提升,而non-NBSCs的综合质量管理水平有所下降。这些差异可能是由于NBSCs主要为各地区卫健委审批及直接管理的实验室,而non-NBSCs主要隶属于医院的检验科、专科实验室及第三方检测机构,对综合质量管理的重视程度不够;因此,有必要进一步规范non-NBSCs的筛查程序,提升其质量管理水平,以更有效地提升我国新筛实验室的总体管理水平。此外,本评价项目的调研数据显示,尽管我国新筛实验室质量管理的整体水平向好,但地区差异依然显著;东部地区综合质量管理水平显著高于西部和中部地区,这可能与不同地区经济发展水平及医疗保障水平的差异息息相关,建议政府应进一步扩大对中、西部地区的扶持,优化这些地区新生儿筛查相关的公共卫生防控策略。
3.3 进一步精简、优化新筛QIs 本评价项目通过综合评价现有新筛质量指标,并结合临床与实际意义,同时参考了美国和国际的新生儿疾病筛查质量指标New STEPs[15],根据检验前、中、后各环节,建议优化现有质量指标如下。
建议3 建议在检验前质量指标中,丰富QI1(即健康教育知晓率)的内涵,取消QI3(即重要信息遗漏百分比)指标。
3.3.1 检验前QIs 随着国家与地方政府继续加大对新生儿疾病筛查的投入,本评价项目的调研数据显示,QI1已逐步接近100%。但筛查技术在进步,可筛查的疾病种类在增加,健康教育的需求会随之不断增加。随着新筛相关的信息管理系统的推广,家长可以通过扫描微信二维码或应用软件主动填报新生儿信息,从而避免或减少重要信息的遗漏。尽管样品的收集、储存和运输条件在改善,不合格血片样品的百分比逐渐下降,但考虑到血片质量是保证检测结果准确性的首要因素,因此建议在后续的质量管理监测中应丰富QI1指标的内涵,明确健康教育的内容、病种和时限等;同时,为提升临床工作效率,进一步精简指标,结合本评价项目结果,建议取消QI3。
建议4 完善NBSCs样本递送系统或流程,提升其QI5(即检验报告周转及时率)监测质量。加强对Non-NBSCs QI6(即室内质控开展率)的监测;制订统一标准,优化QI7(即室内质控变异系数不合格率)指标,以增强实验室间检测结果的可比性和一致性。
3.3.2 检验中QIs non-NBSCs的QI5显著高于NBSCs,分析原因:NBSCs的样本转运一般依赖于第三方物流公司,存在一系列不可控因素,而non-NBSCs多数拥有自己的样本递送系统,故NBSCs需要进一步完善样本递送系统或流程。同时,为了确保样本的检测质量,NCCL要求所有新筛实验室必须按照临床检验相关的卫生健康标准(http:∥www.nhc.gov.cn/wjw/s9492/wsbz_2.shtml,如WS/T 407-2012《医疗机构内定量检验结果的可比性验证指南》,或WS/T 494-2017《临床定性免疫检验重要常规项目分析质量要求》等)进行内部质控,并且本评价项目调研数据显示,NBSCs QI6已接近100%,高于non-NBSCs;此外,由于不同实验室检测指标的变异系数允许范围不尽相同,导致QI7的数值整体波动较大。因此,建议对Non-NBSCs加强QI6的监测,同时制订统一标准,优化QI7指标,以增强实验室间检测结果的可比性和一致性。
建议5 应当明确QI16(即失访率)和QI13(即筛查病种患病率)指标的随访时间及病种;完善QI12(即阳性预测值)指标内涵,可删除QI14(即筛查假阴性率)指标。
3.3.3 检验后及疾病相关QIs 基于本评价项目调研数据,从前期各指标应用情况来看,对于QI16和QI13,应当明确这两类指标的随访时间及病种。QI12、QI14需要对患儿进行长期随访,且疾病确诊后才能开始计算,而从初筛阳性到疾病确诊,需要一定时间,因此,建议后续应明确这两类指标随访时间和记录时间。同时,在实践中发现,一些基层筛查工作人员在区分筛查阳性与诊断阳性方面存在误解,故建议在后续监测中完善QI12指标内涵,可删除QI14指标。
综上所述,QIs的应用使我国新筛实验室的质量管理水平不断提升。从前期QIs的全国运行情况,监测的有效性、便捷性与整体性考虑,结合信息化手段的进步,建议后续可删除QI3(重要信息遗漏百分比)和QI14(筛查假阴性率)指标;对于质量指标QI1(健康教育知晓率)、QI7(室内质控变异系数不合格率)、QI13(筛查病种患病率)、QI16(失访率)和QI12(阳性预测值),建议完善指标的内涵,如在相应指标下明确临界值标准、筛查技术、疾病病种、随访时间、统计时限等,为后续科学规范监测新筛实验室质量管理、进一步提高我国新生儿筛查水平、制订相应的公共卫生防控策略奠定基础。
评价专家及其单位(按姓氏拼音排序) 曹紫阳[上海市儿童医院(上海交通大学医学院附属儿童医院)]、陈意振(宁波市妇女儿童医院)、杜雨轩(北京医院国家老年医学中心、国家卫生健康委员会临床检验中心、中国医学科学院老年医学研究院)、甘信辉(枣庄市妇幼保健院)、顾茂胜(徐州市妇幼保健院)、韩连书(上海交通大学医学院附属新华医院)、何晓燕(重庆医科大学附属儿童医院)、李晓泽(长治市妇幼保健院)、刘世国(青岛大学附属医院)、欧明才(四川省妇幼保健院)、强荣(西北妇女儿童医院)、沈国松(湖州市妇幼保健院)、宋婕萍(湖北省妇幼保健院)、孙雪晶(聊城市东昌府区妇幼保健院)、田国力[上海市儿童医院(上海交通大学医学院附属儿童医院)]、王洁(三亚市妇幼保健院、三亚市妇女儿童医院)、王金玮(廊坊市妇幼保健院)、王金霞[上海市儿童医院(上海交通大学医学院附属儿童医院)]、王薇(北京医院国家老年医学中心、国家卫生健康委员会临床检验中心、中国医学科学院老年医学研究院)、王维鹏(湖北省妇幼保健院)、王晓华(内蒙古自治区妇幼保健院)、王治国(北京医院国家老年医学中心、国家卫生健康委员会临床检验中心、中国医学科学院老年医学研究院)、吴鼎文(浙江大学医学院附属儿童医院)、熊燚(遵义市妇幼保健院)、徐两蒲(福建省妇幼保健院)、薛淑媛(乌鲁木齐市妇幼保健院)、晏紫君[上海市儿童医院(上海交通大学医学院附属儿童医院)]、杨茹莱(浙江大学医学院附属儿童医院)、余朝文(重庆医科大学附属儿童医院)、张虹洋[上海市儿童医院(上海交通大学医学院附属儿童医院)]、赵德华[郑州大学第三附属医院(河南省妇幼保健院)]、赵正言(浙江大学医学院附属儿童医院)、周玉侠(山东省妇幼保健院)、朱文斌(福建省妇幼保健院)、邹琳[上海市儿童医院(上海交通大学医学院附属儿童医院)]
执笔者及其单位王金霞[上海市儿童医院(上海交通大学医学院附属儿童医院)]、杜雨轩(北京医院国家老年医学中心、国家卫生健康委员会临床检验中心、中国医学科学院老年医学研究院)、余朝文(重庆医科大学附属儿童医院)、王洁(三亚市妇幼保健院、三亚市妇女儿童医院)
利益冲突 所有作者均声明不存在利益冲突

