内质网应激在结直肠癌发生发展中作用的研究进展
马传学,陆雅斐,陆柏江,王慧雯,江滨
Autophagy
结直肠癌(colorectal cancer,CRC)是常见的消化系统恶性肿瘤之一,严重危害现代人类的健康。当前CRC治疗主要包括手术、放疗、化疗、靶向药物治疗、免疫治疗以及中医药治疗等多种方式[1-2],但目前治疗效果不理想,CRC仍是全球癌症相关死亡的主要病因之一,发病率居于全球恶性肿瘤第3位,死亡率居第2位[3]。在我国的各类恶性肿瘤中,CRC的发病率、死亡率分别位于第2位和第5位[4]。CRC的发病机制尚未完全明确,但是近年来研究发现内质网应激(endoplasmic reticulum stress,ERS)与CRC的发生发展关系密切。因此,调控ERS,有望成为促进结直肠肿瘤细胞死亡、抑制结直肠肿瘤恶性进展、治疗结直肠癌新的有效途径。
1 ERS-UPR及其对CRC的影响机制
内质网(endoplasmic reticulum,ER)是细胞内一种具有大型动态膜结构的细胞器,跨膜蛋白和分泌蛋白在这个细胞器中合成和折叠。正确折叠的蛋白质从ER中运输出来执行它们的功能。缺氧、低糖、感染和化疗等多种细胞稳态干扰因素可导致ER功能受损,表现为ER腔内错误折叠蛋白和未折叠蛋白的积累以及细胞内钙离子(Ca2+)平衡的紊乱,这一情况称为ERS[5]。在癌症的发生发展过程中,由于肿瘤的快速生长,肿瘤细胞暴露于低糖、低血管化和低氧环境中,细胞内ERS相关蛋白则会过度表达。为了响应ERS,细胞启动UPR等纠正机制,促进蛋白质折叠并降解异常折叠的蛋白质,恢复细胞稳态,促进细胞生存[6]。
UPR主要包括蛋白激酶R样内质网激酶(protein kinase r-like ER kinase,PERK)、肌醇需求酶1(inositol requiring enzyme1,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)介导的3条经典通路。在通常情况下,这3个应激传感器与葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)结合处于非激活状态,但当细胞处于应激状态时,GRP78与PERK、IRE1和ATF6脱离并与异常折叠蛋白结合,继而3条信号通路全部激活以恢复细胞稳态[7]。然而,如果ERS长期存在,未折叠或错误折叠蛋白质未能形成正确的蛋白质构象,ERS就会激活相互联系的两个程序,即凋亡和自噬。一方面,持续加重的ERS诱导细胞凋亡发生,主要通过多条凋亡信号通路实现,包括:C / EBP同源蛋白(C/EBP-homologous protein,CHOP)通路[8]、c-Jun氨基末端激酶(c-Jun n-terminal kinases,JNK)通路[9]和半胱天冬酶-12(cysteinyl aspartate specific proteinase 12,Caspase-12)通路[10]。另一方面,持续发生的ERS诱导细胞自噬发生。ERS诱导的自噬通常作为UPR纠正机制的补充部分,降解ER腔内UPR未处理掉的异常蛋白质,降低应激程度、维持细胞稳态,对细胞起保护作用[34-36]。然而,过度自噬促使细胞死亡。当细胞遭受强烈刺激时,细胞自噬会过度激活,细胞质被大量降解,最终导致细胞自噬性死亡的发生[37-40]。在凋亡和自噬这两个代谢过程的基础上,细胞会进一步发生增殖、转移、耐药等方面的改变,进而影响CRC的疾病进展。总之,ERS在一定程度上决定了细胞生存与凋亡的命运。
2 ERS在结直肠癌中的作用
2.1 ERS促进CRC细胞凋亡 通过施加各种干扰因素使结直肠肿瘤细胞产生持续严重的ERS,打破细胞生存与死亡的平衡,可导致ERS介导的细胞凋亡发生,进而影响肿瘤进展[11-26]。研究发现,部分基因可以通过 ERS 相关途径来调控CRC细胞凋亡,FLI-1基因[11]便是其中之一,当沉默CT26细胞中的FLI-1基因,细胞能够通过RyRs离子通道蛋白释放Ca2+,导致细胞内Ca2+浓度增加,从而使细胞对ERS诱导剂敏感,强化ERS,最终导致肿瘤细胞凋亡。同样,沉默BAP31或过表达miR-451a通过增加ERS相关蛋白GRP78、BAX和PERK/eIF2α/ATF4/CHOP的表达,也能够导致细胞质Ca2+流动和ERS程度增加,促使HCT116和SW620细胞凋亡[12]。此外,相关研究还发现蛋白质也可以参与CRC细胞凋亡的调控,血红素氧合酶 -1(haem oxygenase -1,HO-1)[13]可以通过ERS诱导细胞内Caspase-3激活和PARP裂解导致人CRC细胞凋亡,最终达到治疗结直肠肿瘤的目的。
逃避细胞凋亡是癌细胞生存的主要策略之一,因此诱导癌细胞凋亡是癌症治疗中的关键。除了通过调控基因和蛋白影响ERS来促进结直肠肿瘤细胞凋亡外,大量数据表明部分中药提取物、化合物也能够通过激活ERS相关通路来促使CRC细胞凋亡,效果显著,使药物靶向ERS治疗CRC能够得以实现(见表1)。
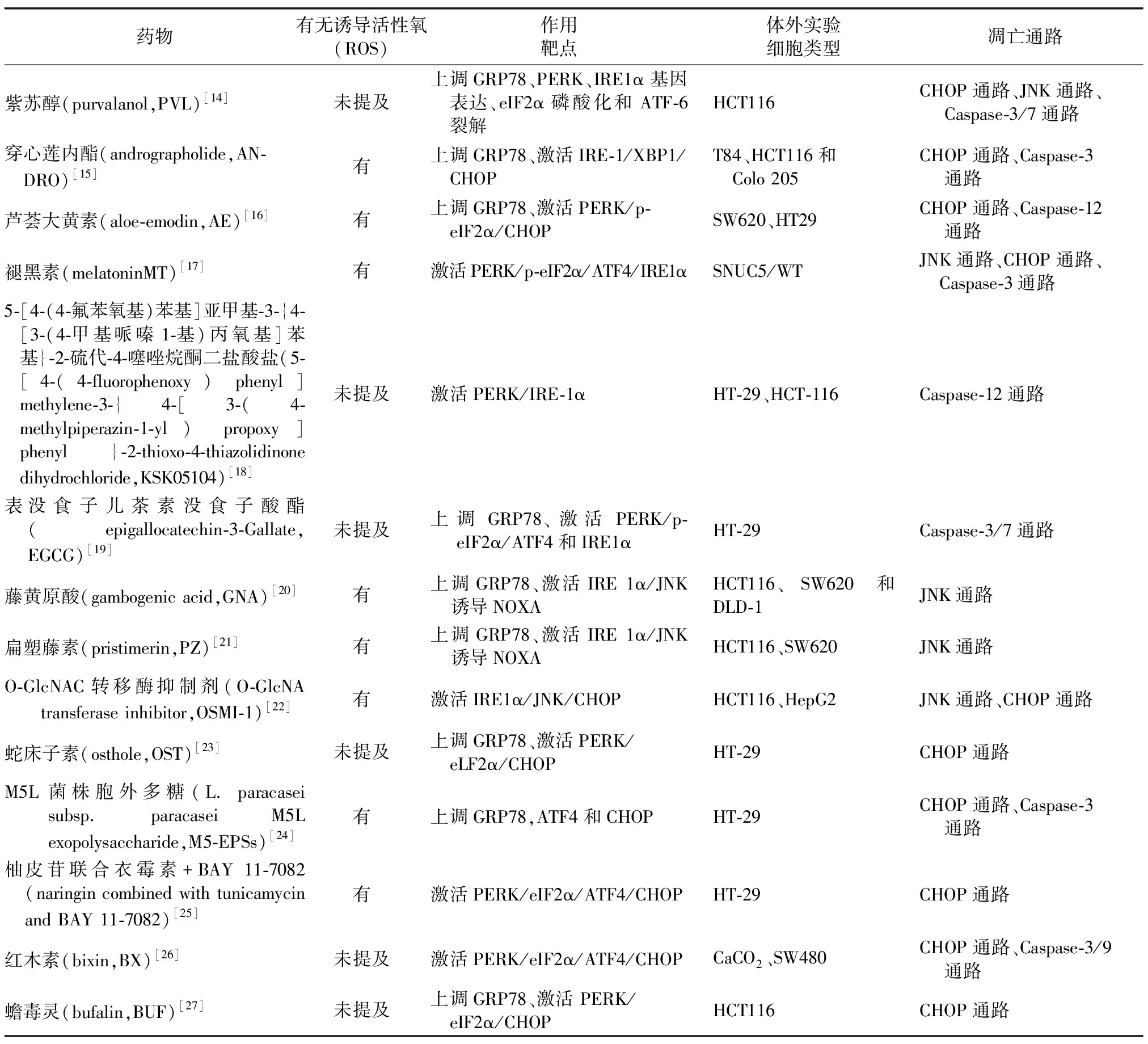
表1 药物诱导的ERS促使CRC细胞凋亡
2.2 ERS参与调控CRC细胞自噬 肿瘤的发生发展受多种信号通路调控,ERS与自噬通路便在其中发挥着重要作用。研究显示部分抗癌药物通过ERS途径可以激活结直肠肿瘤细胞的自噬,对CRC疾病进展产生双向调控的作用[28-34]。木霉酸(trichodermic acid,TDA)是一种植物内生真菌分离出的次生代谢产物,TDA能够使CRC处于持续性ERS状态,同时也诱导了细胞自噬的激活,它诱导的自噬起到了保护CRC细胞、抑制凋亡作用,而应用自噬抑制剂后,TDA通过ERS诱导的CRC细胞凋亡显著增加[29]。新型酪氨酸激酶抑制剂阿帕替尼在诱导ERS和CRC细胞凋亡的同时,也会通过ERS激活IRE1α通路诱导保护性自噬反应[30]。但当诱导的自噬被自噬抑制剂阻断后,阿帕替尼对CRC细胞的凋亡促进作用得到了显著增强。以上研究表明,抑制自噬后,药物诱导CRC细胞的凋亡作用增强,而当自噬存在时,药物诱导的凋亡能力下降,即自噬对CRC细胞具有保护作用。但也有研究发现,自噬能够促使CRC细胞死亡。Tsai等[31]发现抗癌药物牛樟芝诱发CRC细胞ERS,并且通过CHOP激活下游TRB3基因表达,使Akt和mTOR去磷酸化,释放ULK1(unc-51-like kinase 1)诱导细胞自噬产生,但牛樟芝诱导的自噬最终导致了CRC细胞自噬性死亡。此外,褪黑素[32]、香菇多糖[33]、塞来昔布联合硼替佐米[34]也可以通过ERS诱导的自噬性细胞死亡途径来导致CRC细胞死亡。因此,调控自噬,尤其是联合调节自噬与ERS可作为一种新的抗结直肠癌方案。
2.3 ERS参与改善CRC耐药 肿瘤化疗药物众多,但由于对化疗药物的耐药性,临床治疗中CRC多预后较差,常发生肿瘤复发和转移[35]。近年来,大量证据表明ERS及其相关通路是肿瘤耐药的重要机制之一。CRC细胞内某些基因和蛋白质可缓解化疗引起的ERS,抑制凋亡途径,促进肿瘤细胞生存,抑制这些基因和蛋白质对肿瘤耐药有明显改善作用[36-38]。Huang等发现[36]化疗可诱导ERS,而细胞内的一种核编码线粒体蛋白ATAD3A会与升高的GRP78蛋白相互作用,帮助蛋白质折叠以减轻ERS,明显弱化了化疗对肿瘤细胞的杀伤作用。在化疗同时,敲低ATAD3A会诱导ERS加重,促进CRC细胞凋亡。同样,Kim等[37]发现酪蛋白激酶2α(casein kinase 2α,CK2α)在5-FU耐药的CRC细胞中高表达,而抑制CK2α可诱导5-FU治疗时的ERS发生,提高耐药CRC细胞对5-FU的敏感度,进而促进CRC细胞凋亡。并且,CK2α抑制与5-FU联合应用可提高5-FU耐药CRC细胞中ATF4和CHOP的表达,明显促进对5-FU耐药的CRC细胞的凋亡。Yun等[38]还发现在5-FU耐药的CRC细胞中,5-FU介导的ERS由于PERK的激活抑制而被部分抑制,最终阻碍了细胞凋亡的发生。进一步研究发现在5-FU存在的情况下,沉默PPARγ 共激活因子-1α(proliferator-activated receptor gamma coactivator 1-alpha,PGC-1α)可显著诱发耐药CRC细胞中ERS标志物PERK、IRE1α、ATF4和CHOP的激活,从而促进CRC细胞凋亡。因此,特异性抑制某些基因和蛋白的方案对肿瘤化疗耐药的改善具有重要意义。
此外,大量研究证实,在化疗的同时,应用药物调控ERS也可以显著改善结直肠肿瘤化疗耐药,提高化疗药物疗效,其中对5-FU的影响尤为显著。Chern等[39]发现富含半胱氨酸的酸性分泌蛋白(secreted protein,acidic and rich in cysteine,SPARC)可通过与GRP78结合调控ERS,使CRC细胞对PERK/EIF2α和IRE1α/XBP1信号敏感,降低ERS信号激活的阈值,使CRC细胞ERS易激活,最终提高细胞对化疗的敏感。Alnuqaydan等[40]研究发现在5-FU化疗的同时,应用醉茄素-A可上调ERS传感器(GRP78、PERK、CHOP、ATF4和EIF2α)的表达,并参与PERK轴介导的CRC细胞凋亡,提高CRC细胞对化疗药物5-FU的敏感性。此外,抗真菌药物环吡酮(ciclopirox,CPX)[41]、算盘子提取物Glochidpurnoids B/2[42]、神经激肽-1受体拮抗剂SR140333和阿瑞吡坦[43]等均可以通过激活ERS提高5-FU耐药的CRC细胞对化疗敏感,促使肿瘤细胞死亡并克服CRC耐药性。ERS的激活除了能够提升CRC对5-FU化疗敏感性外,对其他化疗药物耐药也有明显改善作用。Jeong等[44]发现,二十二碳六烯酸在体内外实验中均可激活ERS,DHA与奥沙利铂联合应用进一步增强奥沙利铂诱导的CRC细胞活力降低和自噬性细胞死亡,提高奥沙利铂化疗疗效,而且Liu等[45]与Zhang等[46]的研究也进一步证实了强烈ERS对奥沙利铂的增效作用。EGCG[47]除了增强CRC细胞凋亡外,还通过GRP78介导的ERS增强了CRC对伊立替康的化疗敏感度,从而显著提高了化疗对CRC的作用。同样,姜黄素[48]也能够通过ERS增强伊立替康的化疗效果。
综上,CRC细胞通过生存相关通路产生对化疗药物的耐药,激活或增强ERS这一机制有提高CRC化疗药物敏感度、改善化疗耐药的潜力,为CRC化疗增效提供了新思路。
2.4 ERS参与抑制CRC的发生与增殖 通过调控ERS诱导的凋亡和自噬可以预防CRC的发生。在一项动物实验研究中,Wang等[49]发现杨梅素新衍生物M10可减少ERS诱导的自噬,防止了慢性炎症和结直肠肿瘤的发生,M10还可以通过抑制ERS介导的细胞凋亡,保护肠黏膜结构免受炎症损伤,阻止炎症驱动的结直肠肿瘤的发生进展。通过减弱炎症结肠黏膜细胞的强烈ERS及其诱导的自噬和凋亡,M10对肠炎和结直肠癌发生可起到有效预防的作用癌细胞生存的主要策略除了逃避凋亡,还有不受控制的细胞分裂增殖,而研究发现ERS在一定程度上可以抑制CRC细胞的增殖能力。Huang等[50]发现青蒿琥酯通过ROS和ERS的激活,诱导CRC细胞衰老和自噬,从而抑制了肿瘤的生长。紫草素是一种从传统中药紫草根中获得的萘醌类提取物,具有一定抗肿瘤作用,Liang等[51]进行的体内外试验结果表明,紫草素也可以通过激活ROS介导的ERS来抑制结直肠癌HCT-116和HCT-15细胞增殖。此外,PERK激活剂CCT020312(CCT)[52]、大黄素[53]同样可以通过 ERS来抑制CRC细胞的增殖过程,从而达到抑制癌症进展的作用。
2.5 ERS参与调控CRC细胞转移 体内外实验研究表明,ERS抑制CRC细胞的转移侵袭能力。然而,近期研究发现多种基因和蛋白能抵消这一作用。内质网蛋白29(ERP29)是一种分布在粗糙ER腔的蛋白质,参与ERS过程,Yan等[54]研究发现ERP29的过表达抵消了ERS对 CRC细胞生长、转移的抑制作用,在CRC进展中增强了肿瘤持续的侵袭恶化。同样,circ LMNB1的过表达也能够减弱CRC细胞ERS,增强肿瘤细胞迁移和侵袭能力[55]。但当干扰circ LMNB1后,ERS对CRC细胞的转移侵袭抑制得到恢复。
ERS可以参与CRC细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)过程来影响CRC细胞转移。分泌蛋白Gremlin-1的过表达能够通过调节TGF-β/BMP和VEGF/VEGFR2信号通路激活ATF6和抑制ATF4通路来调控ERS和EMT,进而通过EMT提高CRC细胞的侵袭能力[56]。但当应用衣霉素诱导CRC细胞产生ERS 时,ERS中的 PERK/ATF4轴被激活,对CRC细胞的EMT产生明显的抑制作用。
Wang等[57]在大肠癌的转移中发现了一个COPA 基因A-to-I RNA编辑事件,而且发现抑癌蛋白COPAI164V可以通过劫持ERS促进癌细胞的转移。COPAI164V蛋白通过破坏高尔基体-ER反向转运功能,诱导ERS,促使转录因子ATF6、XBP1和ATF4易位到细胞核,激活MALAT1、MET、ZEB1的表达,导致了CRC细胞的侵袭转移。
这些研究结果提示ERS相关基因和蛋白可能是防治大肠癌转移的潜在药理靶点,对CRC预后的改善有重要意义。
3 小结与展望
CRC发生发展机制的研究得到了越来越多的关注,ERS与CRC的关系逐渐成为当前一个热点话题。ERS在各种肿瘤中均被不同程度激活,在CRC中ERS参与了肿瘤细胞增殖、凋亡、自噬、耐药、转移等多方面,对CRC的发生发展有着非常重要的影响,而且ERS不影响正常细胞的活性与活动,这为CRC的治疗提供了一种安全有效的方案。因此,在结直肠肿瘤以及其他肿瘤中将ERS作为肿瘤治疗的良好靶点能够为目前肿瘤治疗提供新方向,使肿瘤的最终治愈成为可能。然而,ERS诱导的保护途径与凋亡途径之间的转换机制尚未明确,两者转换所需的ERS具体程度也有待进一步研究。此外,引起ERS的药物中多数能够诱发ROS,ROS过度积累会诱导氧化应激反应及其介导的凋亡发生,氧化应激介导的凋亡是否也参与了ERS在CRC治疗中的作用过程也有待进一步探索。

