不同微创手术对重症胰腺炎合并感染性胰腺坏死患者免疫功能和术后恢复的影响
叶玲,陈丽群,郑筱姮
重症胰腺炎(SAP)是指全身急性炎症反应及器官功能障碍所引起的肠道及免疫功能失调[1],其发病较为凶险且预后效果多不理想。感染性胰腺炎坏死(IPN)是SAP 最为严重的并发症,严重者可出现感染性休克及多器官功能衰竭甚至死亡[2]。IPN 是引起急性胰腺炎患者死亡的主要原因,其致死率可达25%~30%[3]。IPN 首选治疗方式为手术治疗[4],但是由于常规外科手术创口较大,患者术后恢复较慢,且术后易出现出血、肠缺血、肠坏死等并发症,因此已逐渐被微创外科手术方式所取代[5]。微创手术治疗方式包括经皮穿刺置管引流术、腹腔镜微创治疗、内镜治疗等,在临床上均已取得较为成熟的发展。本研究通过对比肾镜腹膜后坏死组织清除术与腹腔镜经胃坏死组织清除术两种微创手术方式的疗效差异,分析其对SAP 合并IPN 患者的影响。
1 资料与方法
1.1 一般资料 回顾性分析浙江省人民医院2019年6 月至2021 年6 月收治的100 例行微创手术治疗的SAP 合并IPN 患者的临床资料,根据手术方式分为A 组(n=57)和B 组(n=43)。A 组男31 例,女26 例;年龄45 ~65 岁,平均(54.5±6.2)岁;疾病诱因:暴饮暴食15 例、高血脂11 例、饮酒13 例、胆源性胰腺炎18 例。B 组男23 例,女20 例;年龄42 ~63 岁,平均(52.5±6.5)岁;疾病诱因:暴饮暴食10 例、高血脂7 例、饮酒14 例、胆源性胰腺炎12 例。两组一般资料差异无统计学意义(P >0.05)。纳入标准:(1)符合SAP 诊断标准[6];(2)符合IPN 影像学检查诊断标准[7];(3)已获得患者及家属知情同意。排除标准:(1)合并血液系统重大疾病;(2)合并心、肺重大疾病;(3)中途退出研究者。本研究经浙江省人民医院医学伦理委员会审批通过。
1.2 方法 两组患者术前均已行增强CT 检查,并给予抗感染治疗,保障营养支持,加强器官维持功能治疗。A 组接受肾镜腹膜后坏死组织清除术:指导患者仰卧于手术床上,适当抬高左侧背部便于手术操作,抬高角度10°~15°;全身麻醉后于穿刺点周围贴保护膜后经引流管协助下置入导丝,沿导丝向皮肤周围切开1.5 mm,根据导丝走向逐级扩张窦道,扩张鞘管借助置入直径10 mm 套管针一枚,置入型号为26F 硅胶管对胰腺内残留坏死组织进行冲洗;插入肾镜后在直视状态下进行反复冲洗,待脓液清除干净后采用抓钳对松动坏死组织进行进一步清除,清除完毕后置入双腔引流管;术后使用0.9%氯化钠溶液对引流管进行持续冲洗,保证引流管通畅。B 组采用腹腔镜经胃坏死组织清除术:采用A 组患者同样麻醉方式与手术体位,选择患者脐部下缘取一小观察孔,向腹腔内充入CO2,保证腹内压维持在10 ~12 mmHg(1 mmHg≈0.133 kPa);于剑突下及右锁骨中线肋缘下分别取一3 cm切口,置入吸引器、电钩、分离钳等手术器械;分离周围组织后打开胃结肠韧带,对胰腺进行探查,经胰腺小网膜囊进入脓腔,彻底清除脓液及坏死组织,采用0.9%氯化钠溶液对脓腔进行反复冲洗,视患者手术情况酌情置入引流管。
1.3 观察指标(1)临床指标:两组患者住院时间、手术时间、术中出血量、术后排气时间、开放饮食时间;(2)免疫指标:手术前后分别采集两组患者空腹静脉血各3 ml,借助BeamCyte-1013M 流式细胞仪(常州必达科生物科技有限公司,苏械注准:20222221435)检测CD4+、CD8+水平,计算CD4+/CD8+比值;(3)心理状态:采用焦虑自评量表(SAS)、抑郁自评量表(SDS)[8]经精神专科医师指导下对患者心理状态进行评价;(4)疾病严重程度:参照急性生理与慢性健康评分(APACHE Ⅱ)[9]评价患者疾病严重程度,APACHE Ⅱ包括急性生理学评分(APS)、年龄以及慢性健康评分(CPS)3 个方面,总分0 ~71分,分值越高提示患者病情严重程度越高;(5)术后并发症:对比术后1 个月两组消化道瘘、腹腔出血、切口感染等并发症发生率。
1.4 随访 术后1 年内固定每个月对患者进行一次电话随访,及时掌握患者康复情况并进行指导。
1.5 统计方法 采用SPSS24.0 统计学软件进行数据处理,计量资料以均数±标准差表示,采用t检验;计数资料采用检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 临床指标比较 两组住院时间、手术时间、术中出血量、术后排气时间及开放饮食时间差异均有统计学意义(均P <0.05),见表1。
2.2 免疫指标比较 两组术前患者CD4+、CD8+水平以及CD4+/CD8+比值差异均无统计学意义(均P>0.05)。术后两组CD4+、CD4+/CD8+比值均较术前明显升高(P <0.05),且A 组均明显高于B 组(均P<0.05)。两组患者CD8+水平均较术前明显降低(P<0.05),且A 组低于B 组(P <0.05),见表2。
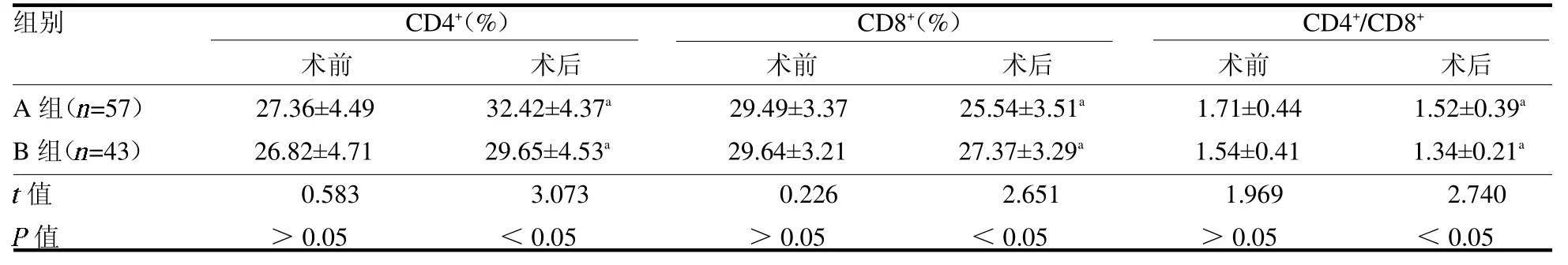
表2 两组手术前后免疫指标比较
2.3 疾病严重程度比较 两组术前患者APACHEⅡ各项评分差异均无统计学意义(均P >0.05)。术后两组患者APACHE Ⅱ各项评分均较术前明显降低(均P <0.05),且A 组均低于B 组(均P <0.05),见表3。
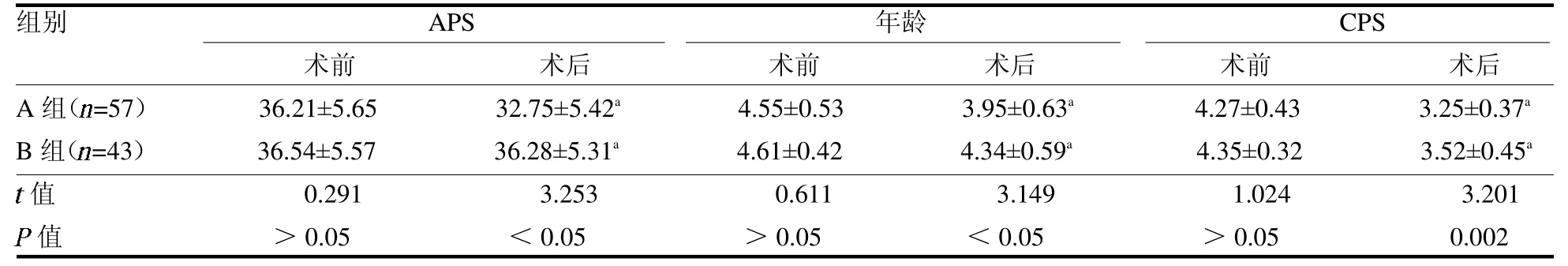
表3 两组手术前后APACHE Ⅱ各项评分比较分
2.4 心理状态比较 两组术前SAS、SDS 评分差异均无统计学意义(P >0.05)。两组术后SAS、SDS评分均较术前降低(P <0.05),且A 组均低于B 组(均P <0.05),见表4。
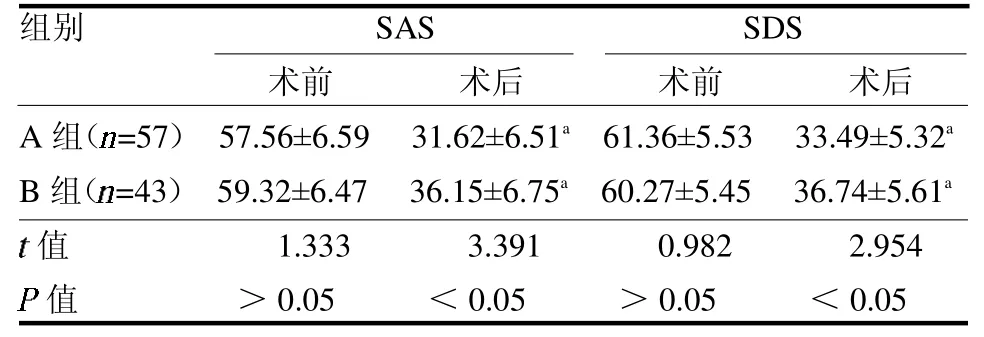
表4 两组手术前后SAS、SDS 评分比较分
2.5 术后并发症比较 两组术后1 个月并发症发生率差异无统计学意义(P >0.05),见表5。
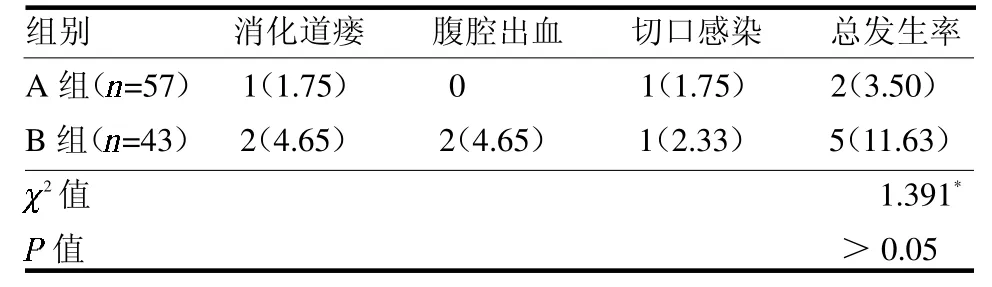
表5 两组术后并发症发生率比较例(%)
3 讨论
IPN的形成多与SAP后胰腺周围组织发生坏死与聚集、继而引起感染有关,临床上以清除坏死组织、引流脓性分泌物以及联合应用抗生素为其基础治疗原则[10]。微创手术可有效清除胰腺周围坏死组织,降低感染性坏死发生风险,保障患者生存质量,降低疾病致死率[11]。
本研究结果显示A组患者各项临床指标均明显优于B 组。有研究发现,与腹腔镜手术治疗相比,采用肾镜微创手术治疗的患者术后住院时间、术中出血量以及术后排气时间等各项指标均明显更低[12]。肾镜手术可直接对感染部位进行清除,便于控制感染扩散程度,同时其对腹腔刺激较小,可有效降低患者术后应激反应[13]。肾镜手术通过多点穿刺实现多通道同时建立的目标,便于促进手术顺利进行,缩短患者手术时间,从而促进患者快速康复,减少住院时间。本研究结果表明,术后A 组患者CD4+、CD4+/CD8+比值均明显高于B 组,同时A 组CD8+水平明显低于B 组,提示A 组患者术后免疫功能改善情况较B 组明显更好。余方方等[14]提出,腹部剧烈疼痛是导致患者焦虑、抑郁等负性情绪产生的主要原因。本研究结果亦显示,术后两组患者SAS、SDS评分均出现明显降低,表明采用两种不同微创手术方式对于改善患者心理状态,促进疾病预后康复均具有积极作用。而本研究中A 组患者术后SAS、SDS 及APACHE Ⅱ评分均明显低于B 组,原因可能在于相较于腹腔镜经胃坏死组织清除术而言,肾镜腹膜后坏死组织清除术手术难度相对较小且预后康复效果较为明显,因而患者术后情绪状态以及疾病康复程度改善效果更为理想。刘世洲等[15]研究认为,采用腹腔镜手术方式能够通过镜头直视及时调整引流管位置,避免引流不充分的情况发生,提高引流效果,同时降低术后出血风险。尽管本研究结果提示,两组患者术后消化道瘘、腹腔出血、切口感染等并发症发生情况比较并无明显差异,但A 组患者术后并发症发生率较B 组更低。而本研究结果与其研究结论不符可能与本研究纳入样本量不足以及随访时间过短有关,因此仍需扩大样本量以及延长随访时间以获取更准确的研究数据。
综上所述,肾镜腹膜后坏死组织清除术与腹腔镜经胃坏死组织清除术两种微创手术在SAP 合并IPN 均具有较好疗效,对于改善患者免疫功能,降低术后并发症发生风险具有积极意义。
利益冲突 所有作者声明无利益冲突

