木瓜蛋白酶纳米簇荧光探针的汞离子检测及其在环境监测中的应用
曹 毅,许心愿,张进浩,桂心平,王宝娟,2
(1.安徽师范大学 生命科学学院,安徽 芜湖 241000;2.安徽省重要生物资源保护与利用研究重点实验室,安徽 芜湖 241000)
引言
在早期工业化的发展中,我国多数河流和湖泊都曾受到汞的影响,且由于早期含汞农药的滥用,致使我国土壤中有相当大一部分受到汞的污染。然而汞作为一种常见的、毒性强的重金属在土壤中常以Hg2+形式存在,并在土壤微生物的共同作用下发生富集[1],当被生物摄入体内后,会被转化为毒性更高的甲基汞[2],借助食物链进一步加重毒性,具有高度的生物富集性且进入人体后会破坏蛋白质的空间结构,对人体健康产生严重影响[3-4]。根据世界卫生组织规定,饮用水中的Hg2+含量不得超过29.9 μM,而中国国家饮用水标准规定Hg2+含量不得超过5.0 μM,因此对Hg2+的灵敏检测是极其必要的。现阶段常用的Hg2+检测方法有原子吸收光谱[5]、高效液相色谱法[6]、电化学检测[7]等,然而这些方法通常需要复杂昂贵的设备、严格的样品预处理、繁琐耗时的检测程序,难以实现Hg2+的快速检测。
金属纳米簇(nanoclusters,NCs)是由几个到几十个原子与模板分子构成的一种新型荧光纳米传感器,粒径通常在2~3 nm左右[8],由于其制备简单、成本较低、操作方便、灵敏度较高等优势,在离子检测领域具有巨大的应用潜力,逐渐引起研究者们的重视。目前,已经成功报道的金属纳米簇包括金、银、铜、铂、铁纳米簇等[9-12],除离子的种类在选择上有所不同外,其模板也多种多样,如氨基酸、多肽、蛋白质、DNA等。其中,以具有不同氨基酸序列和空间构象的蛋白质为模板制备的铂纳米簇因其良好的生物相容性、更高的光稳定性以及潜在的催化能力而备受研究者们青睐。例如,Xia[13]等人利用牛血清蛋白(BSA)为模板成功合成了BSA-Pt NCs,并将其用于次氯酸的检测中,线性检测范围为12~240 μM;Mei[14]等人利用牛血清蛋白(BSA)作为模板成功合成了BSA-Au NCs,利用Hg2+对BSA-Au NCs的淬灭作用达到检测目的,检测限为1 nM,回收率在97.00%~101.89%,具有良好的检测效果。但是,到目前为止尚未有将铂纳米簇应用于重金属离子检测的报道。
本文以木瓜蛋白酶(Papain)为稳定剂和还原剂,采用“生物矿化法”制备以木瓜蛋白酶为模板的铂纳米簇(Papain-Pt NCs),利用暗箱四用紫外分析仪观察其光学性质以及紫外-可见分光光度计检测该探针的吸收光谱。随后探究Papain-Pt NCs作为荧光探针对不同金属离子检测的特异性,选取具灵敏性的金属离子并在环境样品中检验Papain-Pt NCs对该离子的实际检测能力。
1 实验部分
1.1 实验试剂
木瓜蛋白酶和氢氧化钠(NaOH)购自生工生物工程有限公司(上海)。六氯铂酸(H2PtCl6·6H2O)购自国药集团化学试剂有限公司(上海)。金属离子(Mn2+、Mg2+、Na+、La2+、K+、Co2+、Cr3+、Li+、Zn2+、Hg2+、Ca2+、Bi3+、Pb2+、Ba2+、In3+、Al3+)购自国药集团化学试剂有限公司(上海)且均为氯化物。整个实验过程用水均为Milli-Q过滤系统(Millipore,美国)处理的超纯水(18.25 MΩ·cm)。如未特殊说明,所用试剂均为分析纯,且未经过进一步纯化处理。
1.2 Papain-Pt NCs的制备及鉴定
Papain-Pt NCs的配制参照本课题组已有研究[15]:将Papain与H2PtCl6水溶液按摩尔比为3.5:1充分混合,加入1M NaOH 调节pH=12,充分震荡避光反应36 h 使Pt4+与Papain 相互作用,反应结束后8,000 rpm 离心5 min,取上清在截留分子量1,000 Da透析袋中透析24 h后得到Papain-Pt NCs,置于4℃冰箱中保存备用。
随后取200 μL Papain-Pt NCs溶液于微量石英比色皿中,在暗箱四用紫外分析仪中观察Papain-Pt NCs的光学性质;取体积均为200 μL Papain-Pt NCs、Papain、H2PtCl6三种等浓度溶液于微量石英比色皿中,设置扫描波长范围为200~500 nm,检测其紫外吸收光谱。
将上述Papain-Pt NCs稀释后,用10 μL移液枪将溶液滴于铜网中央,80 ℃烘干5 min,彻底去除铜网表面水分,利用透射电子显微镜(TEM)观察Papain-Pt NCs的形貌特征。
1.3 金属离子的选择性与灵敏性检测
为了评价Papain-Pt NCs对金属离子的选择性,使用超纯水制备了16种浓度均为1 mM的金属离子溶液。将金属离子溶液(20 μL)、Papain-Pt NCs溶液(10 μL)和超纯水(170 μL)作为标准反应体系在25 ℃下混合反应5 min,并通过荧光分光光度计RF-5301PC检测Papain-Pt NCs在490 nm处的发射强度,分别固定激发与发射的狭缝波长在5 nm和5 nm。对于灵敏性测定,将20 μL不同浓度的特异性金属离子溶液(0~140 μM)加入到标准反应体系中,在25 ℃下反应5 min后在相同条件下检测Papain-Pt NCs的荧光强度。所有实验均独立重复3次及以上。
1.4 对实际样品中金属离子浓度的检测
水样分别来自长江(芜湖市滨江公园段)、芜湖市镜湖、安徽师范大学(中校区)自来水,土样来自芜湖市赭山、葡萄园。长江水、镜湖水、自来水、赭山土、葡萄园土取样后过滤得上清液,将上清液经8,000 rpm离心5 min,再通过0.45 mm 膜滤器处理后供实验使用。长江水、自来水及镜湖水样品滤液样品稀释50 倍后用于金属离子浓度的检测,赭山土和葡萄园土滤液样品稀释200倍后用于金属离子浓度的检测。随后在标准反应体系中,将Papain-Pt NCs 溶液、经过预处理后的水样(或土样)与特异性金属离子溶液(浓度分别为20、40 和100 μM)混合,在25℃下孵育5 min 后使用荧光分光光度计记录490 nm 处混合溶液的荧光强度并计算加标回收率。
2 结果和讨论
2.1 Papain-Pt NCs的鉴定
利用紫外-可见分光光度计研究Papain-Pt NCs、Papain 以及H2PtCl6的光谱性质。Papain-Pt NCs 在300~350 nm 范围内具有较宽的吸收光谱,而Papain 和H2PtCl6在这个范围内没有明显的吸收带(图1 A);合成的Papain-Pt NCs溶液在可见光下呈现淡黄色,在365 nm紫外灯下呈现显著的绿色荧光(图1 B)。该实验结果证实,我们成功合成了具有绿色荧光发射的Papain-Pt NCs新型纳米荧光探针。进一步利用透射电子显微镜对Papain-Pt NCs的表面形貌进行分析,结果显示,Papain-Pt NCs粒子呈球形,且分布均匀。
2.2 金属离子的选择性检测
Hg2+在环境中的残留严重影响了人类的身体健康,因此对环境中Hg2+含量的测定至关重要。为了评价Papain-Pt NCs对Hg2+的检测性能,测定了Papain-Pt NCs与16种浓度均为1 mM金属离子混合后的荧光强度(图2)。值得注意的是,Papain-Pt NCs的荧光强度仅在Hg2+存在的情况被明显淬灭,淬灭程度为84%,而其余金属离子仅淬灭2%~11%。
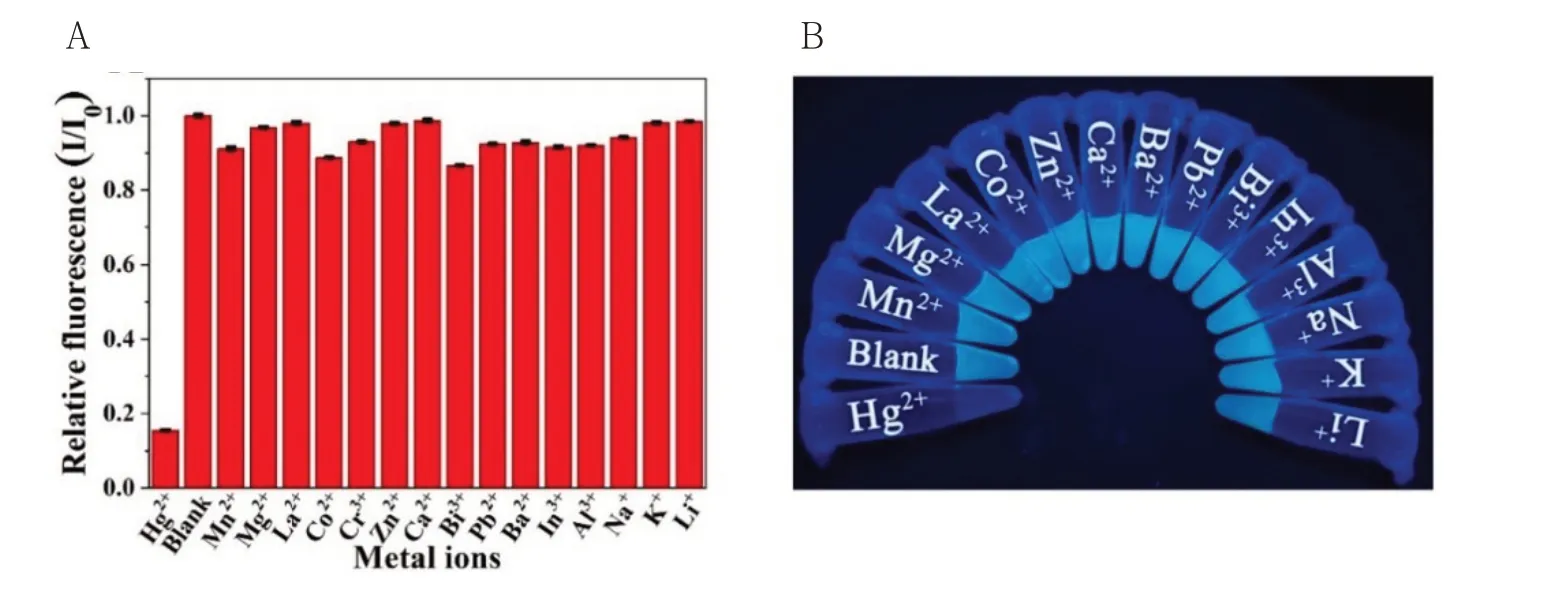
图2 (A)不同金属离子与Papain-Pt NCs混合时的相对荧光强度(I/I0,其中I与I0分别为金属离子存在和不存在下的荧光强度);(B)365 nm紫外光照射下的不同金属离子与Papain-Pt NCs混合溶液Fig.2 (A)Relative fluorescence intensity(I/I0)of Papain-Pt NCs when excited at 380 nm with various metal ions(I/I0,where I and I0 are the fluorescence intensity of Papain-Pt NCs in the presence and absence of various metal ions,respectively);(B)Photographic image of Papain-Pt NCs solution upon the addition of various metal ions under UV light illumination at 365 nm
金属纳米簇的稳定发光结构依赖于金属核与蛋白模板之间的共价键或是分子间作用力,基于彼此间的相互作用形成较稳定的发光结构,蛋白模板在这个过程的作用类似于自然界中的生物矿化作用[16]。因此,Hg2+对本金属纳米簇的淬灭效应,有以下两个可能的推测:一是Hg2+与金属镍之间的亲金属相互作用,竞争Papain-Pt NCs中的金属核,导致荧光淬灭;二是Hg2+与木瓜蛋白酶巯基等负电基团之间的相互作用,破坏了模板与金属核之间稳定的发光结构,这种强烈的刻蚀作用致使荧光淬灭[14-15]。
2.3 Hg2+的灵敏性检测
当一系列浓度的Hg2+与Papain-Pt NCs混合,其荧光强度呈浓度依赖性减弱(图3 A,图3 B),在5~100 μM的浓度范围内加入Hg2+,线性回归方程为y=4.52×10-3x+1.00482(R2=0.9919)(图3 C)。根据3σ/S原则,计算得其检测限为2.7 μM,其中σ表示空白信号的标准偏差,S是线性拟合曲线的斜率。
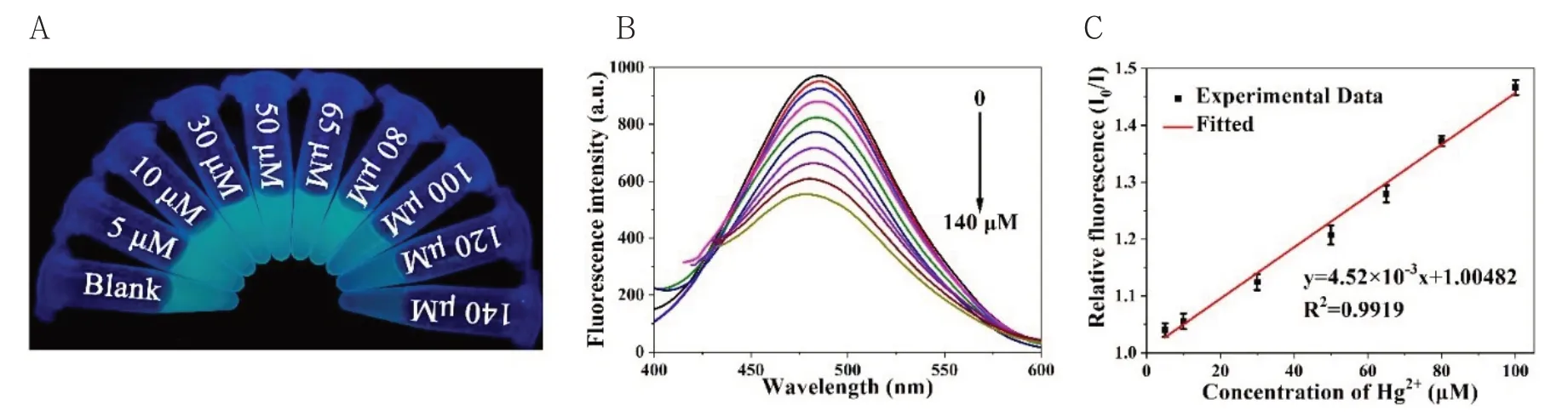
图3 (A)365 nm紫外光下不同浓度的Hg2+(0~140 μM)与Papain-Pt NCs的混合溶液;(B)Papain-Pt NCs与不同浓度的Hg2+(0~140 μM)混合后荧光强度;(C)不同浓度的Hg2+(5~100 μM)与混合后相对荧光强度(I0/I)之间的线性关系(其中I0为不加Hg2+的荧光强度,I为加不同浓度Hg2+的荧光强度)Fig.3 (A)Photographic image of Papain-Pt NCs solution upon the addition of Hg2+with a certain concentration gradient(from top to bottom:0~140 μM)under UV light illumination at 365 nm.(B)Fluorescence spectra of Papain-Pt NCs with various concentrations of Hg2+(from 0 to 140 μM);(C)The linear relationship between I0/I and different concentrations of Hg2+(from 5 to 100 μM)
国家规定饮用水中的Hg2+含量不得超过5.0 μM,因此在复杂背景中实现Hg2+的灵敏性检测至关重要。比较不同荧光法对Hg2+浓度的检测(表1),相较于SBA-Pr-IS、RMTE,本研究的检测限与之接近甚至更低,因此可实现对Hg2+的灵敏性检测。相较于NSCD、N and S co-doped C-dots、TA-GNPs、Coumarin-boronic,尽管上述方法所提供的检测限更低,但是本研究提供的荧光纳米探针线性检测范围更宽,其应用前景更广阔。在实物检测方面,七种方法的回收率并无明显区别,在实际检测中都具备较高的可信度。因此,本方案提供了一种检测限低且检测范围更宽的生物传感器,具有较高的实际应用价值。
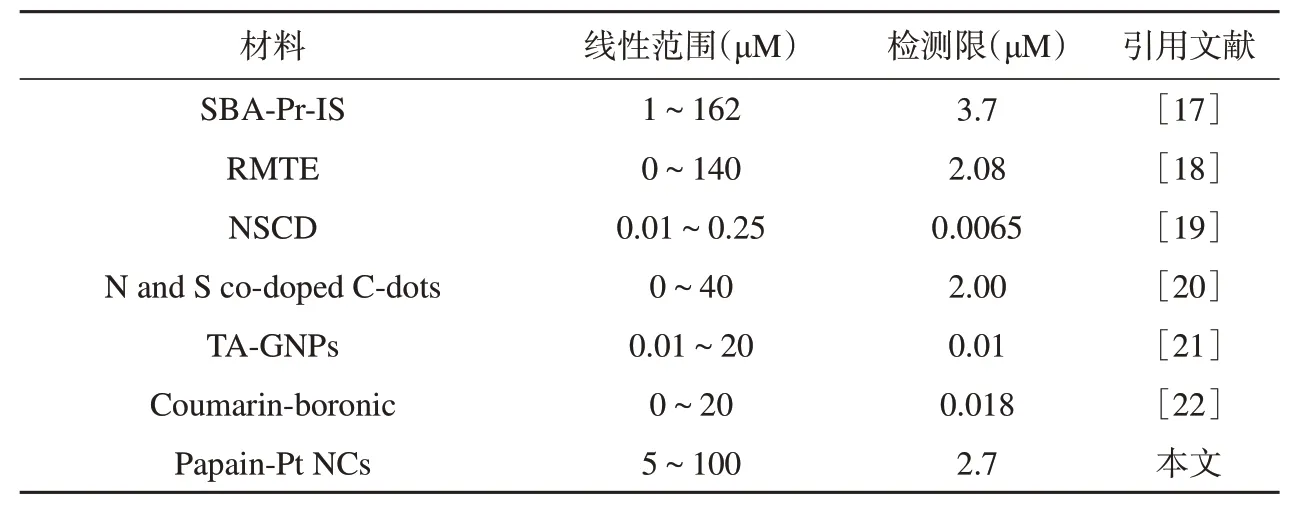
表1 不同荧光方法对Hg2+浓度的线性检测范围及其检测限比较Table 1 Comparison of linear detection ranges and detection limits of Hg2+concentrations by different fluorescence methods
2.4 环境样品中Hg2+浓度的检测
在实际环境样品(例如水体、土样)中对Hg2+浓度的灵敏性检测十分必要,为了验证Papain-Pt NCs 作为荧光探针对实际环境样品中Hg2+浓度检测方法的可行性,通过加标回收法测定水样和土样中的Hg2+浓度。3 种浓度的Hg2+溶液(20、40 和100 μM)分别加入到经预处理后的土样、水样中,检测并记录对应的荧光强度,根据相对荧光强度与Hg2+浓度的线性回归方程计算加标回收率。结果如表2所示,在水样和土样中检测的加标回收率变化在可接受的良好范围内,为95.82%~109.20%。本研究为在复杂环境中检测Hg2+提供了一种简单的分析替代方案,具有较好的准确性和精确度。
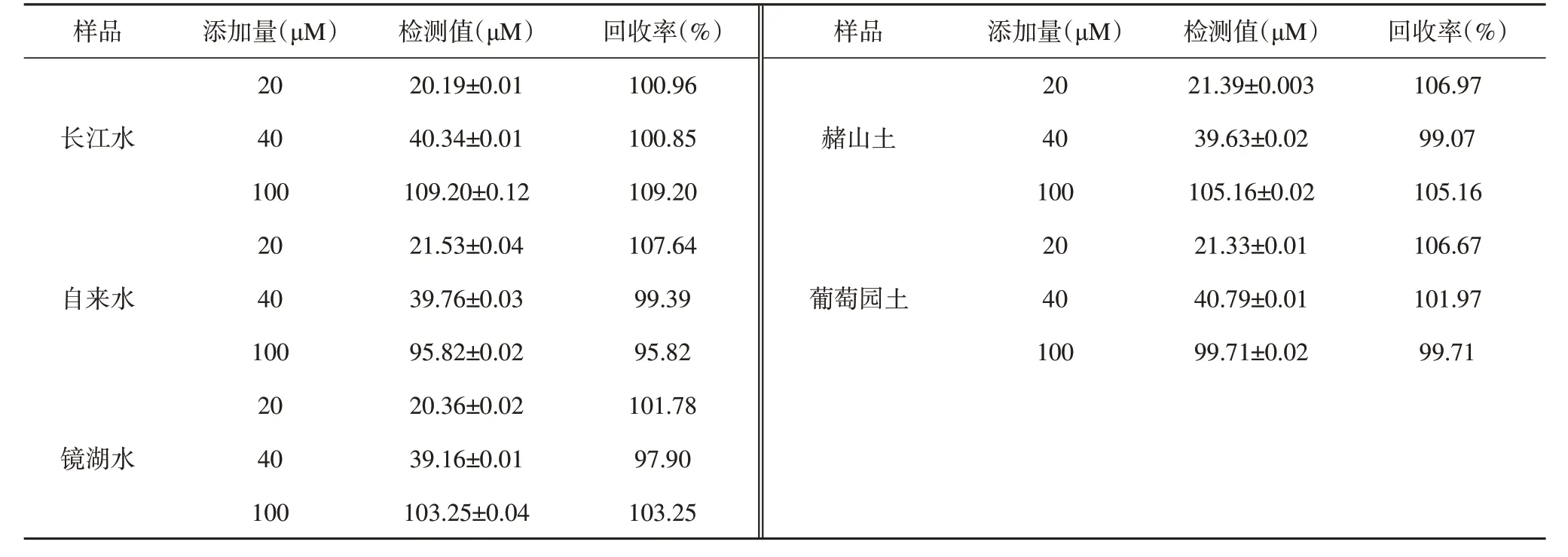
表2 实际样品中Hg2+浓度的检测Table 2 Detection of Hg2+concentration in actual samples
3 结论
综上所述,我们开发了一种以Papain-Pt NCs为基础的Hg2+荧光检测方法,利用其荧光特性实现了对Hg2+的特异性及灵敏性检测。Papain-Pt NCs在365 nm紫外灯下可发出绿色荧光,在300~350 nm范围内具有较宽的吸收光谱。基于Hg2+对Papain-Pt NCs荧光的淬灭响应,本研究发现该荧光传感器具有优异的灵敏性,检测范围在5~100 μM,检测限为2.7 μM。此外,该生物传感器验证了在长江水、镜湖水、自来水、赭山土、葡萄园土中检测Hg2+的可行性,回收率为95.82%~109.20%,实现了铂纳米簇在实际环境中对重金属离子浓度的检测,拓宽了铂纳米簇的应用领域,为复杂环境样品中的Hg2+浓度检测提供了一种新方案。

