盐酸丙卡特罗片溶出度测定方法的建立及与原研片一致性评价
刘珊珊,何承华,王 松,吴琼珠
1江苏经贸职业技术学院 健康学院,南京 211168;2南京艾德加生物制药科技有限公司,南京 210033;3中国药科大学 药学院,南京 211198
盐酸丙卡特罗是第3 代高度选择性β2受体激动剂类支气管扩张药,由日本大冢制药株式会社于1980 年研制成功并上市,规格为25 μg,临床主要用于治疗支气管哮喘、喘息性支气管炎、肺气肿等[1]。因盐酸丙卡特罗分子结构上有两个手性碳原子及酚羟基、仲胺基两个活泼基团,极易异构化成苏式异构体(杂质A)和氧化成5-甲酰基-8-羟基喹诺酮(杂质C),还可能含有合成起始原料8-羟基喹诺酮(杂质B)[2,3](图1)。此外,对于痕量药物的固体制剂来说,其溶出度测定方法的建立与测定是质量研究工作的难点之一,日本橙皮书[4]和中国药典(ChP)[5]虽有收载,但两者差异较大。仿制药与原研药的质量差异主要通过体外模拟口服固体制剂在胃肠道的溶出以评价其内在质量,而多种溶出介质中测定的溶出曲线可有效反映药物在体内的释放过程[6,7]。本研究比较了盐酸丙卡特罗仿制片与原研片在5 种不同溶出介质中的溶出曲线,为国内盐酸丙卡特罗片仿制药一致性评价及处方工艺筛选提供一定的参考。
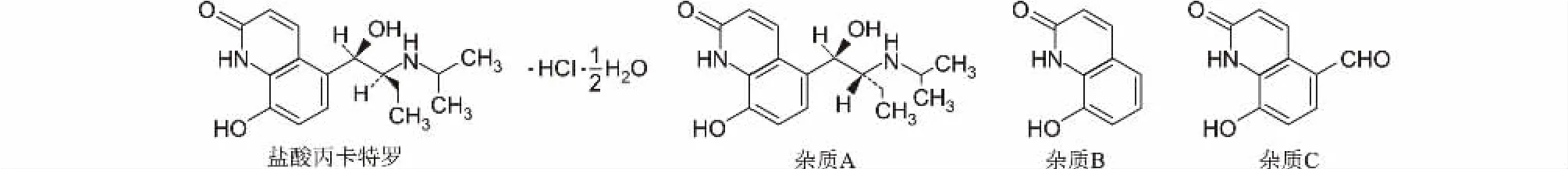
图1 盐酸丙卡特罗及其杂质的化学结构
1 仪器与药品、试剂
1.1 仪器
RC12AD 溶出试验仪及ZKT-18F 真空脱气仪购自天津市天大天发科技有限公司,Thermo U3000高效液相色谱仪购自美国赛默飞公司,MSE6.6S-0CE-DM 微量天平和BT125D 电子天平购自德国赛多利斯公司,FE-28 pH 计购自瑞士梅特勒公司。
1.2 药品与试剂
原研盐酸丙卡特罗片(日本大冢制药株式会社,批号8G92M1,9C95M1,0C95M1),仿制盐酸丙卡特罗片(安徽环球药业股份有限公司,批号20201101、20201102、20201103),盐酸丙卡特罗对照品(中国食品药品检定研究院,批号100275-201903,纯度96.7%),杂质A 对照品(南京天海医药科技有限公司,批号190302,纯度97.69%),杂质B 对照品[阿拉丁试剂(上海)有限公司,批号E1705027,纯度99.96%],杂质C 对照品(Cato Research Chemicals,批号C4X-150013-1612,纯度99.4%)。
甲醇(色谱纯,美国天地有限公司),其它试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 色谱条件
色谱柱为Thermo Hypersil GOLD(4.6 mm ×150 mm,5 μm),流动相为磷酸盐缓冲液(取NaH2PO411.04 g,加水适量溶解,磷酸调节pH 值至3.10 后加水至1000 mL)-甲醇(83∶17),检测波长为259 nm,柱温为35℃,流速为1.0 mL·min-1,进样量为100 μL。
2.2 溶液的制备
2.2.1 空白辅料溶液 按处方比例配制空白辅料,混合均匀,精密称取60 mg 空白辅料置1000 mL 量瓶中,加入溶出介质适量,振摇使分散并稀释至刻度,摇匀,过滤,取续滤液作为空白辅料溶液。
2.2.2 对照品溶液 称取盐酸丙卡特罗对照品约6 mg,精密称定,置100 mL 量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成浓度为60 μg·mL-1的储备液。精密量取该储备液,加溶出介质定量稀释成浓度为0.025 μg·mL-1的溶液,作为对照品溶液。
2.2.3 杂质对照品溶液 分别称取杂质A、B、C 对照品各3 mg,精密称定,置100 mL 量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成浓度为30 μg·mL-1的各杂质储备液。分别量取盐酸丙卡特罗、杂质A、B、C储备液,加溶出介质定量稀释成盐酸丙卡特罗浓度为6 μg·mL-1、杂质A、B、C 浓度分别为0.12 μg·mL-1的溶液,作为各单个成分对照品溶液,再依法配制同浓度的主成分-杂质混合溶液。
2.2.4 供试品溶液 取样品12 片,加溶出介质900 mL,采用浆板法,转速为50 r·min-1,依法操作,15min 时,取溶出液20mL,用0.45μm 微孔滤膜滤过,至少弃去初滤液10 mL,取续滤液作为供试品溶液。
2.3 溶出条件的选择
日本橙皮书收载的盐酸丙卡特罗片(规格25μg)的溶出曲线数据是以900 mL 4 种溶出介质(水、pH 1.2 盐酸溶液、pH 4.0 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液,分别记为A~D),采用桨法(50 r·min-1)进行,而ChP 现行标准则采用100 mL 盐酸溶液(3→50 000,记为E)作为溶出介质,采用小杯法(70 r·min-1)进行(具体条件见表1)。根据《普通口服固体制剂溶出度试验技术指导原则》[8]和相关文献[9,10],盐酸丙卡特罗片的溶出条件设定为:溶出介质为日本橙皮书收载的4 种介质以及ChP 收载的1 种介质,体积900 mL,温度(37±0.5)℃,浆法,转速50 r·min-1,上述5 种介质均采用脱气装置经42℃脱气1 h后立即使用,取样时间为5、10、15 min。
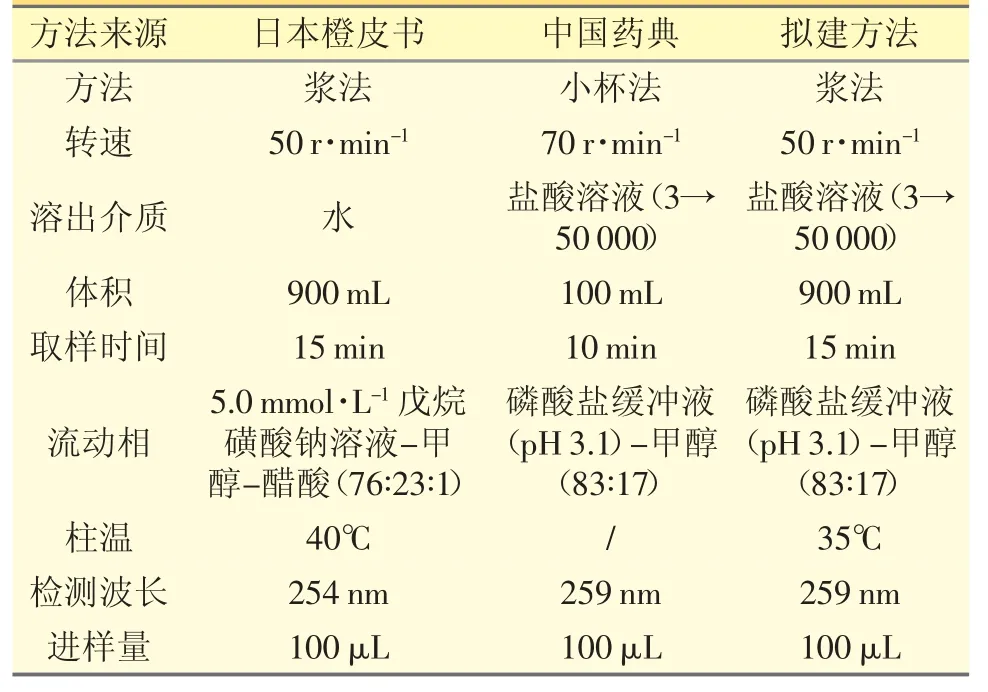
表1 盐酸丙卡特罗片溶出度测定方法比较
2.4 溶出度测定方法的建立与验证
2.4.1 专属性 分别量取“2.2”项下的空白辅料溶液、主成分及杂质A、B、C 单个对照品溶液及主成分-杂质混合溶液各100 μL,注入液相色谱仪,记录色谱图,各成分色谱峰保留时间及分离度见表2。结果说明3 个已知杂质均与主成分达到基线分离,且空白辅料不干扰测定。
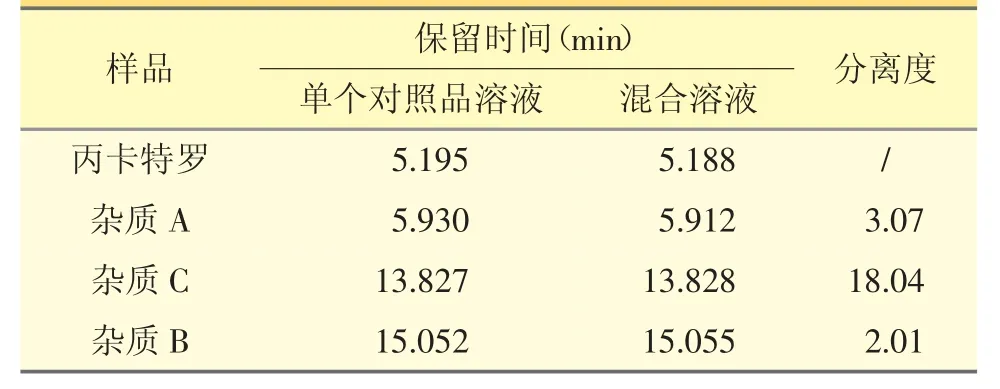
表2 各杂质峰保留时间及分离度
2.4.2 方法耐用性 微调色谱条件,改变因素包括流动相比例±1、pH 变化±0.2、流速变化±0.2、柱温变化±5℃。以主成分-杂质混合溶液作为耐用性试验溶液,考察条件改变对测定结果的影响。结果发现各杂质与主成分之间分离度均良好,测得丙卡特罗、杂质A、B、C 峰面积的RSD 分别为1.63%、2.45%、1.21%和2.09%,表明方法耐用性良好。
2.4.3 线性与范围 分别精密量取“2.2”项下的盐酸丙卡特罗储备液1 mL 置100 mL 量瓶中,用5 种不同溶出介质稀释至刻度,摇匀,制成浓度为0.6 μg·mL-1的各溶出介质标准储备液。分别量取各溶出介质标准储备液0.4、0.6、0.8、1.0、1.2、1.4 mL 置25 mL量瓶中,用各自溶出介质稀释至刻度,摇匀,制成系列标准溶液。依法进样测定,以峰面积(Y)对浓度(X)进行线性回归,得标准曲线和相关系数(表3),说明对照品溶液在0.009 6~0.033 6 μg·mL-1的浓度范围内与峰面积线性关系良好。
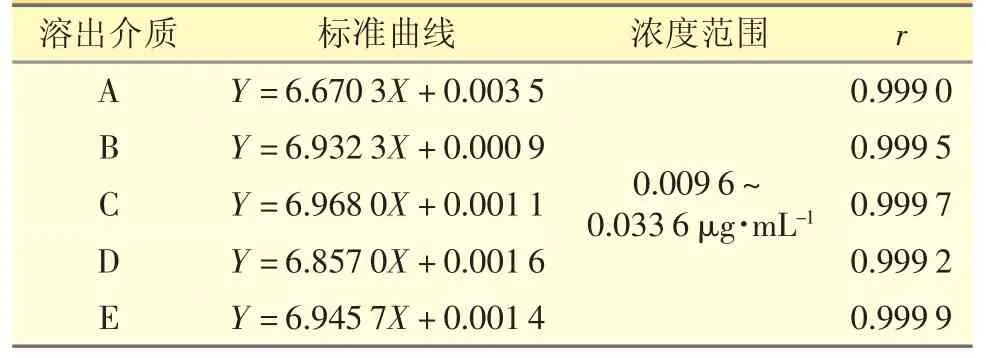
表3 5 种溶出介质标准曲线、范围及相关系数
2.4.4 精密度 取上述各标准曲线中浓度为0.028 8 μg·mL-1溶液,连续进样6 次,记录峰面积并计算RSD,结果其RSD 均小于2.0%,说明精密度良好。另取仿制片(20201101)1 片,置溶出杯中,加不同溶出介质依法操作,经15 min 取样,连续进样6次,计算平均溶出度和RSD,结果其RSD 均小于2%,说明重复性良好。
2.4.5 溶液稳定性 取“2.4.4”项下的供试品溶液,除pH 1.2 供试品溶液在冰箱低温4℃放置,其余4种介质分别在室温放置0、1、3、5、7、9、11、13,15 h,依法进样测定,结果发现丙卡特罗的峰面积几无变化,其RSD 均<2.0%,说明各介质稳定性良好。
2.4.6 准确度 精密量取“2.2”项下对照品储备溶液适量,加空白辅料溶液定量稀释成相当于片中含量的80%、100%、120%三种浓度共9 个样品,依法进样测定,计算加样回收率。结果在5 种介质中的加样回收率均在95.0%~105.0%之间,RSD 均<2.5%。
2.4.7 滤膜吸附性 取仿制片(20201101)10 片,研成细粉,取细粉60 mg,精密称定,置100 mL 量瓶中,分别加入5 种溶出介质适量,振摇10 min,定容后稀释10 倍,作为供试品溶液。取该供试品溶液以13000r·min-1离心5 min,取上清液作为离心溶液。另取供试品溶液用该滤膜过滤,分别弃去5、10、15 mL 后,依法进样测定,以续滤液与离心液峰面积比值计算回收率,结果5 种溶出介质的续滤液回收率均在97.0%~103.0%之间,表明使用该滤膜过滤对丙卡特罗基本无吸附作用。
2.5 样品溶出度测定
仿制与原研盐酸丙卡特罗片分别按表1 方法进行检查,结果均符合规定,且3 种方法测定结果无显著差异(表4)。
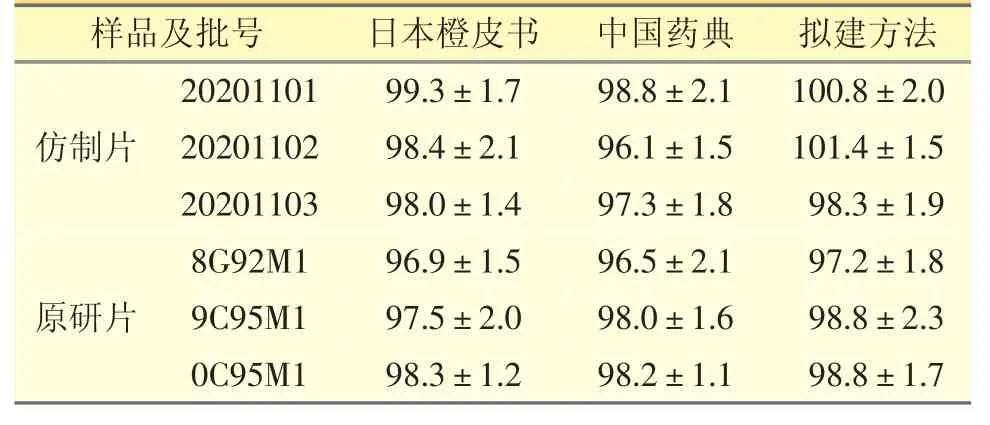
表4 不同溶出度测定方法溶出度测定结果比较(n=12,%)
2.6 溶出曲线相似性评价
取1 批原研片(8G92M1)与3 批仿制片(20201101、20201102、20201103)各12 片,按新建方法在第5、10 和15 min 时间点各取样20 mL,并及时补充溶出介质20 mL,0.45 μm 微孔滤膜滤过,弃去至少10 mL,除水作为溶出介质时取续滤液9 mL置10 mL 量瓶中,加0.228%磷酸溶液稀释至刻度进行酸化外,其余4 种介质均取续滤液作为供试品溶液,依法进样测定(pH 1.2 溶出介质供试品溶液进样盘温度控制在4℃),按外标法以峰面积计算各时间点的累积溶出百分量并绘制溶出曲线(图2)。结果发现,3 批仿制片及1 批原研片在5 种不同介质中15 min 时累积溶出量均大于85%,根据《普通口服固体制剂溶出曲线测定与比较指导原则》可直接判定二者溶出行为相似[11]。
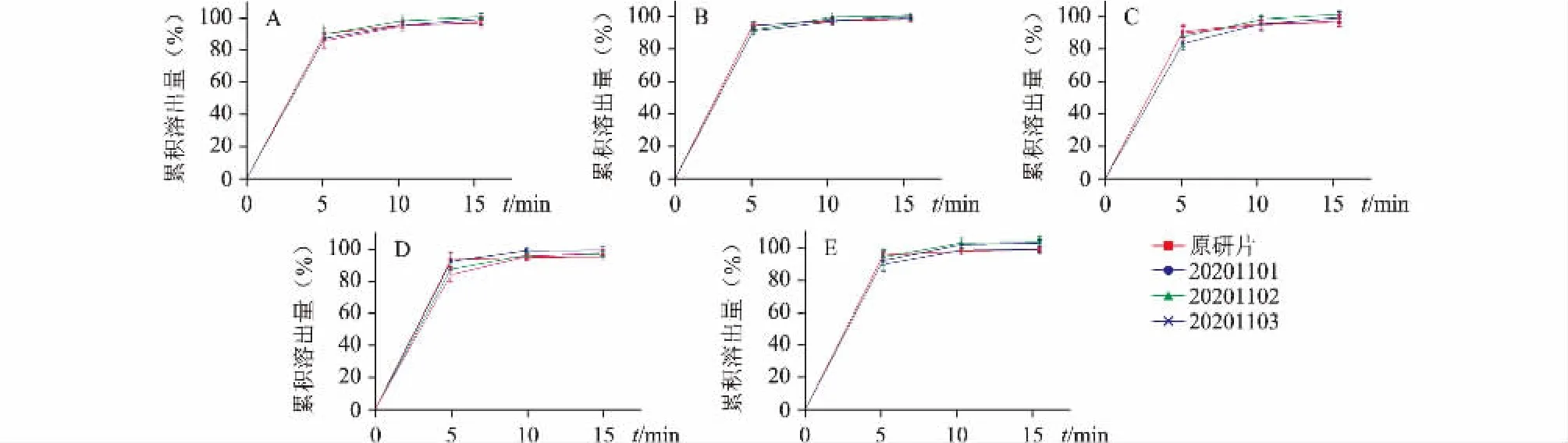
图2 3 批仿制及1 批原研盐酸丙卡特罗片在水(A)、pH 1.2(B)、pH 4.0(C)、pH 6.8(D)、pH 3.0(E)中的溶出曲线(n=12)
3 讨论
3.1 溶出度测定方法
ChP 现行标准采用小杯法,转速较高(70 r·min-1),10 min 时溶出限度为90%。小杯法在国际上一般很少采用,具有一定的局限性,且盐酸丙卡特罗为生物药剂学分类系统Ⅲ类,属于高溶解、低渗透性药物,无pH 依赖性,原研片在5 种不同介质、转速50 r·min-1条件下15 min 时的溶出量均达85%以上,属于快速溶出制剂,因此参照日本橙皮书选择第二法即桨法,转速50 r·min-1。
3.2 溶出介质考察
实验中发现盐酸丙卡特罗在水中极不稳定,不锈钢取样针中微量的铁锈或棕色玻璃进样瓶中的含铁染料均可能导致测定结果异常,且日本橙皮书中供试品溶液需用磷酸溶液酸化使其稳定,操作繁琐,故不建议用水作为溶出介质。而常用的pH 1.2 的盐酸溶液酸性太强,室温放置时间过长也会因盐酸丙卡特罗降解而导致测定结果差异,需要冰箱冷藏或控制进样盘温度(4℃),因此可选择盐酸溶液(3→50 000)、pH 4.0 和pH 6.8 三种介质作为多条溶出曲线评价一致性时的溶出介质,而pH 6.8 介质稳定且区分能力相对较大,可作为筛选处方工艺的溶出介质。考虑到盐酸丙卡特罗片为快速溶出制剂,建议其溶出介质仍为盐酸溶液(3→50 000),限度为85%。
3.3 色谱条件
日本橙皮书收载的色谱条件,其流动相中加入离子对试剂戊烷磺酸钠和醋酸,离子对试剂费用高而醋酸易挥发,可能导致不稳定,因此选用ChP 收载方法中的色谱条件。

