陕西产艾叶中非挥发性成分的初步分析
王 昆,马如龙,王云会,张丽华,王春柳,苏同生*
1.陕西省中医医院,西安 710003;2.西安医学院,西安 710003;3.陕西省中医药研究院,西安 710003
艾叶(ArtemisiaargyiLevl. et Vant.),又名冰台、遏草、香艾、灸草等[1]。艾叶以全草入药,具有祛湿止血、驱寒温经、止咳消炎、防蚊驱虫等作用[2]。现代研究表明,艾叶含有香豆素、糖苷、黄酮、甾醇、萜类化合物、挥发油等[3],具有活血、抗氧化、抗诱变、抗炎、抗癌、抗菌及调节免疫等生物活性[4-5],其中黄酮类、香豆素类等非挥发性成分的药理活性也值得关注。
随着人们保健意识的提高,艾灸作为新兴的保健项目,近年来在健康消费和美容消费市场上日益成为热点,市场潜力巨大[6]。目前我国艾草产业发展处于极不平衡的状态,湖北蕲春和河南南阳区域产的艾草品牌度较高,供不应求,因此全国多地区也在积极开展优秀品种的种植、培育工作,以期能尽快扩大艾叶产区,尽早满足市场需求[7]。虽然艾叶的质量控制方法在逐渐提高,但目前2020年版《中华人民共和国药典》(以下简称《中国药典》)中尚无对艾叶非挥发性成分的质量控制内容[1],因此开展相关内容的研究具有一定的实践意义。
本文拟针对陕西产艾叶中非挥发性成分建立高效液相色谱(high performance liquid chromatography,HPLC)指纹图谱分析方法,以指纹图谱联合多元统计分析、比较蕲春产艾叶与陕西产艾叶中非挥发性成分的主要特征,为陕西产艾叶的质量评价提供一定的实验依据。
1 仪器与试药
1.1 仪器
安捷伦1260型高效液相色谱仪(配G1311B型四元泵、G1329B型自动进样器、G1316A型柱温箱、G1315型二极管陈列检测器,美国安捷伦科技有限公司公司);超声波清洗器(熊猫集团南京电子计量有限公司);SQP型电子分析天平(赛多利斯科学仪器有限公司);水浴锅(泰斯特科技有限公司)。
1.2 试药
对照品:绿原酸(批号 20081301,四川省维克奇生物科技有限公司);异泽兰黄素(批号CHB201217)、异绿原酸C(批号CHB201227)、棕矢车菊素(批号CHB210113)、新绿原酸(批号CHB201129)、异绿原酸A(批号CHB201227),均购自成都克洛玛生物科技有限公司;甲酸(赛默飞世尔科技有限公司);甲醇(色谱纯,美国霍尼韦尔公司);实验用水为超纯水。
艾叶样本为端午前一周采集,避光、晾干后备用[8]。样本经陕西省中医药研究院杨智峰研究员鉴定为Artemisiaargyilevl. et Vant.的干燥叶。产地信息见表1。

表1 样品产地来源
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil 100-5 C18(250 mm×4.6 mm,5 μm)。流动相为2 mL·L-1甲酸水溶液(A)-甲醇(B),梯度洗脱:0~5 min,20%~51% B;5~10 min,51%~60% B;10~15 min,60% B;15~35 min,60%~80% B;35~40 min,80%~95% B;40~50 min,95% B。检测波长为330 nm;流速为0.3 mL·min-1;进样量为10 μL。
2.2 对照品溶液的配制
分别精密称定对照品异泽兰黄素、绿原酸、异绿原酸C、棕矢车菊素、新绿原酸、异绿原酸A适量,加甲醇分别制成含异泽兰黄素、绿原酸、异绿原酸C、棕矢车菊素、新绿原酸、异绿原酸A 27.6、10.2、18.3、13.0、12.5、24.0 μg·mL-1的对照品溶液。
2.3 供试品溶液的配制
取适量干燥艾叶,捣碎30 min,精密称取艾绒与艾粉混合物1 g,加入60 mL体积分数50%甲醇,水浴回流30 min,静置至室温后补足质量,用0.45 μm微孔滤膜滤过,备用。
2.4 方法学考察
2.4.1精密度实验 取混合对照品溶液,按照2.1项下色谱条件连续进样6次,记录色谱图,计算得各共有峰的相对峰面积及相对保留时间的RSD值分别为0.01%~1.81%、0.01%~0.05%[9]。
2.4.2稳定性实验 取2.3 项下供试品溶液,按照2.1项下色谱条件分别在0、2、4、6、8、10、12、24 h进样分析,计算得相对保留时间和相对峰面积的RSD值分别为0.01%~1.96%、0.01%~0.06%[9]。
2.4.3重复性实验 取1号样本平行制样6份,按照2.2项下方法制备供试品溶液,按照2.1项下色谱条件进样测定,计算得相对峰面积和相对保留时间的RSD值分别为0.01%~4.08%、0.01%~0.07%。
2.5 指纹图谱建立及相似度评价
取不同产地艾叶按照2.2项下方法制备供试品,按照2.1项下色谱条件进样分析,按照《中药色谱指纹图谱》要求,将25批艾叶HPLC色谱图谱导入“中药色谱指纹图谱相似度评价系统(2015年版)”中进行数据分析。自动匹配色谱峰,生成25批陕西不同产地艾叶指纹图谱以及对照指纹图谱,标定并指认出6个共有峰成分,分别为新绿原酸、绿原酸、异绿原酸A、异绿原酸C、棕矢车菊素和异泽兰黄素,混合对照品色谱峰见图1、25批不同产地艾叶的指纹图谱叠加图见图2。

注:1.新绿原酸; 2.绿原酸; 3.异绿原酸A; 4.异绿原酸C; 5.矢车菊素; 6.异泽兰黄素。

注:1.新绿原酸; 2.绿原酸; 3.异绿原酸A; 4.异绿原酸C; 5.矢车菊素; 6.异泽兰黄素。
应用“中药色谱指纹图谱相似度评价系统(2015版)”对25批样品的HPLC指纹图谱进行相似度分析,以对照指纹图谱为参照,对25批艾叶色谱图谱进行相似度计算,结果见表2,25批艾叶样本与自动生成的对照图谱相比,相似度均大于0.92,表明相似度良好。
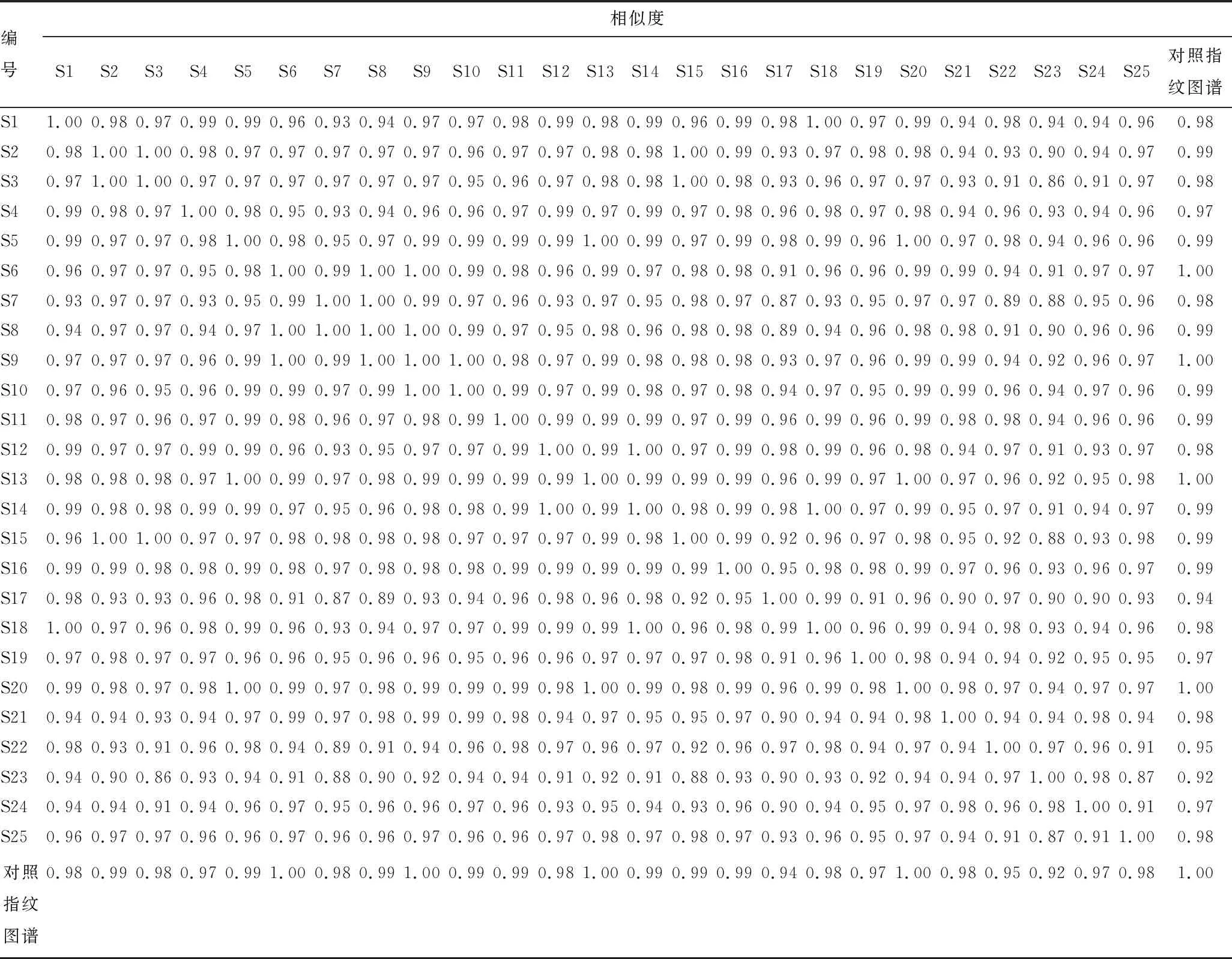
表2 样品的相似度分析
由表2可知,蕲春产样本(S1~S6)与19批陕西产样本相似度均在0.91以上,19批陕西产艾叶相互比较,相似度为0.86~0.99;对陕西不同产区样本进行比较,宝鸡产样本(S7~S12)与商洛产样本(S13~S19)相似度为0.87~0.99,宝鸡产与铜川产样本(S20~S25)的相似度为0.88~0.99,商洛产区与铜川产区之间相似度为0.88~0.99。比较各个产区的不同样本之间相似度发现:蕲春产样本相似度为0.95~0.99,陕西宝鸡产各样本相似度为0.93~0.99,商洛产样本的相似度在0.91~0.99,铜川产各样本的相似度为0.87~0.98。
2.6 聚类分析
用SPSS 19.0软件,以共有峰峰面积信息对25个样本进行聚类分析,选择中位数聚类法、平方Euclidean距离作为聚类参数[10-11],分类结果树状图见图3。

图3 25批艾叶样本的聚类分析图
由图3可知,所分析的25批艾叶以非挥发性共有峰为主要特征,大体聚为2类,蕲春产样本中5号样本与其他4个样本距离较远,全部陕北产样本、部分陕南产样本与多数的蕲春产样本可聚为一类,蕲春的一个样本与少数陕南产样本及多数关中产样本聚为一类。
2.7 多元统计分析
以共有峰峰面积为样本特征,按照产地分组整理数据矩阵,用MetaboAnalyst 5.0对25批艾叶样本分别进行了无监督的主成分分析(principal component analysis, PCA)[12]及有监督的偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)[13],原始数据分别经过平方根及帕累托转换后归一化。PCA得分图见图4。

图4 25批艾叶样本的PCA得分图
由图4可知,各产地样本整体上呈现交叠分布的特征,蕲春产样本与陕北、关中、陕南产大多数样本未显示出分簇的状态,表明在整体特征上蕲春产样本与陕西3个区域产样本未见差异。
PLS-DA得分图及模型交叉验证(cross validation)结果见图5。由图5可知,各个产地的样本依然无明显分簇。对所建立的PLS-DA模型进行内部交叉验证发现,在基于各主成分的验证中,模型的R2值均在0.4以下,Q2值均为负值。

注:A. PLS-DA记分图;B.内部交叉验证结果。
3 讨论
建立中药材指纹图谱时,色谱条件和制样方法的优化是关键。本文为确定指纹图谱关键参数,分别对流动相组成、洗脱梯度、检测波长、柱温、流速和进样量进行了系统考察,在优化流动相梯度及流速时耗费了较长时间,最终确定了最优条件;对于供试品制备方法,分别考察了取样量、溶剂种类、溶剂倍量、提取方式和提取时间,选择出提取效率最高的方式进行了样本制备。
进行相似度分析时发现,蕲春产艾叶与陕西产艾叶非挥发性成分指纹图谱具有很高的相似度,表明在主要的非挥发性成分特征方面,陕西产艾叶整体上与蕲春产艾叶具有很高的相似度。此外,陕西不同地区(陕北、关中、陕南)之间比较,相似度也较高(均在0.87以上);陕西不同产区样本之间的相似度波动比蕲春与陕西产样本之间的相似度波动相近甚至更大。众所周知,陕西分为陕北、关中、陕南3个区域,不同区域之间地理与生态环境相差较大,温度、日照、土壤、水分等因素的不同可能导致艾叶中化学成分不同[14]。此外,比较各产区样本之间相似度波动的范围,蕲春要比陕西各区域均小,这也表明,即使是在陕西省内部的各产区进行艾叶种植、采收和加工,仍需加强其有效成分的质量监控。
PCA是一种无监督的分析方法[15],其分析过程中,默认对所有样本不加以区分,即每个样本对模型有着同样的贡献,当样本的组间差异较大而组内差异较小时,无监督分析方法可以明显区分组间差异;但当样本的组间差异不明显而组内差异较大时,无监督分析方法难以发现和区分组间差异。另外,如果组间的差异较小,各组的样本量相差较大,样本量大的那组将会主导模型。而有监督的PLS-DA分析能很好地解决无监督分析中存在的这些问题[16]。但是,作为一种有监督的分类模型,PLS-DA模型可能会存在过拟合风险,因此需要验证模型的可靠性[17]。交叉验证是常用的检验方法之一,其基本过程为通过逐步增加拟合的主成分来观察模型对变量的解释度(R2)和预测度(Q2)的变化,当Q2停止增长时,主成分不再增加。Q2数值越大表示模型的预测能力越强[18]。一般情况下,模型具备良好的预测性能要求Q2至少大于0.5[19-20]。在本文中,Q2始终是负值,表明PLS-DA模型不具备预测组间差异的可靠性,导致模型表现不佳的主要原因可能是按照产区分类、陕西产样本的组内差异较大,这也从反面证实了蕲春产与陕西产样本之间的差异不显著。
4 结论
本文建立的陕西产艾叶指纹图谱分析方法符合2020年版《中国药典》相关要求,基于指纹图谱共有峰信息进行的聚类分析、PCA及PLS-DA判别分析发现,陕西产艾叶中非挥发性成分的主要特征与蕲春产艾叶无显著差异。
——2018李时珍中医药大健康国际高峰论坛在湖北蕲春举行

