103例患者卡瑞利珠单抗超适应证用药的合理性分析Δ
戴 丽,王凤玲,邢海燕,汪星辉,孟祥云(合肥市第二人民医院药学部,合肥 230011)
近年来,免疫检查点抑制剂包括程序性死亡受体1(programmed death-1,PD-1)抑制剂、程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂作为新型抗肿瘤药物,已成为全球新药研发的热点。卡瑞利珠单抗是我国自主研发的一种新型人源化免疫球蛋白G4型PD-1抗体,通过阻断PD-1与PD-L1/PD-L2结合,解除对T细胞的免疫抑制效应,产生抗肿瘤作用[1-2]。2019年5月,卡瑞利珠单抗获得国家药品监督管理局(NMPA)批准,用于治疗复发或难治性经典型霍奇金淋巴瘤[3]。相较于铂类等传统抗肿瘤药物,PD-1抑制剂上市时间短,上市前的临床研究有限,往往造成药品说明书的更新滞后于临床实践的发展,因此,临床超说明书用药现象普遍存在[4-5]。本研究依据相关肿瘤指南、查阅相关文献建立卡瑞利珠单抗超适应证用药评价标准,对我院卡瑞利珠单抗超适应证用药进行分析、评价,旨在为卡瑞利珠单抗的合理应用提供参考。
1 资料与方法
1.1 资料来源
通过医院PASS系统,选取2019年7月至2022年3月我院使用卡瑞利珠单抗治疗的肿瘤患者相关资料,同一患者多周期使用视作1份资料,排除仅使用1个周期卡瑞利珠单抗的患者。
1.2 方法
采用回顾性研究方法,通过医院CIS信息系统收集患者的性别、年龄、肿瘤类型、用法与用量、临床诊断等资料进行统计分析。以NMPA批准的药品说明书(2021年4月更新)为依据,将患者临床诊断超出药品说明书批准的适应证判定为超适应证用药。
1.3 卡瑞利珠单抗超适应证用药评价标准
超适应证用药需有充分的循证医学证据(evidence-based medicine,EBM)的支持。常见的EBM:国外药品说明书、中国临床肿瘤学会(CSCO)发布的诊疗规范或临床指南、随机对照试验(RCT)的Meta分析;单臂试验;母试验;个案报道等。我院药学部结合《医疗机构超药品说明书用药管理专家共识》[6]、《新型抗肿瘤药物临床应用指导原则(2021年版)》[7]、《超说明书用药专家共识》[8]和《超药品说明书用药情况的循证评价》[9],制定了我院卡瑞利珠单抗超适应证用药评价标准,见表1。

表1 我院卡瑞利珠单抗超适应证用药评价标准Tab 1 Evaluation criteria for off-label indications use of camrelizumab in our hospital
2 结果
2.1 患者的一般情况
共纳入103例使用卡瑞利珠单抗的患者,其中男性82例(占79.61%),女性21例(占20.39%);年龄40~86岁,主要集中于70~79岁(42例,占40.78%)。
2.2 卡瑞利珠单抗超适应证用药情况
103例患者的肿瘤类型包括肺癌、食管癌和肝癌等14种,其中肺癌居多,共31例(占30.10%);符合药品说明书适应证的有56例(占54.37%),超适应证用药47例(占45.63%),见表2。
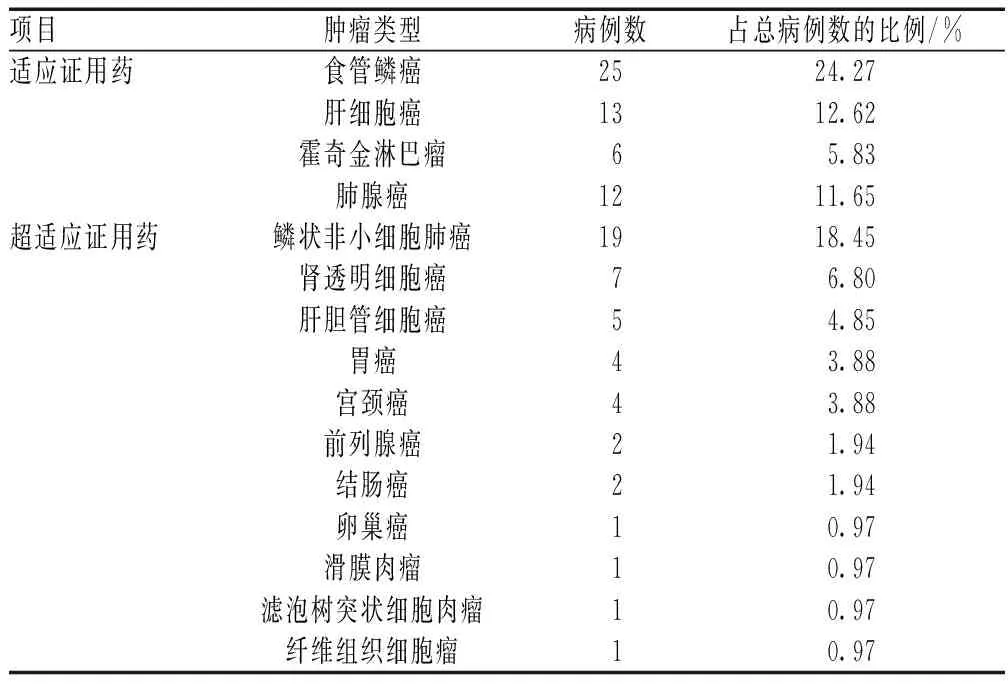
表2 我院卡瑞利珠单抗超适应证用药情况Tab 2 Off-label indications use of carrelizumab in our hospital
2.3 卡瑞利珠单抗超适应证用药合理性评价结果
47例卡瑞利珠单抗超适应证用药中,19例(占40.43%)用于治疗鳞状非小细胞肺癌(squamous non-small cell lung cancer,Sq-NSCLC),评价为限制使用;特殊使用为16例(占34.04%),分别为治疗肾透明细胞癌7例、胃癌4例、宫颈癌4例和卵巢癌1例;不推荐使用为12例(占25.53%),包括治疗肝胆管细胞癌5例、纤维组织细胞瘤1例和前列腺癌2例等,见表3。

表3 我院卡瑞利珠单抗超适应证用药合理性评价结果Tab 3 Rational evaluation results of off-label indications use of camrelizumab in our hospital
3 讨论
目前,国内外对超说明书用药的合理性评价无统一标准,但设计良好、低偏倚的RCT是评价药物疗效和安全性的“金标准”[16]。然而,随着肿瘤患者突变基因测序、免疫组化等精准检测技术的广泛应用,用传统RCT评价新型抗肿瘤药物疗效及安全性的成本高、耗时长,故2017年美国推出针对精准肿瘤医学的“母方案”(master protocols)临床试验设计模式,包括篮式试验、伞式试验和平台试验[17]。其中,篮式试验不仅所需队列样本较小,而且缩短了疗效评价时间,更适于评价1种药物或药物组合用于多种疾病或疾病亚型的疗效,让更多的肿瘤患者获益[18]。例如,篮式试验NCT01524978研究是评估维莫非尼在BRAF V600突变的非黑色素瘤患者中的疗效[19]。但是,篮式试验一般以客观缓解率(ORR)或总生存期(OS)为研究终点,缺乏安全性相关研究,不属于证据级别高的EBM[20]。本研究旨在评价新型抗肿瘤药物卡瑞利珠单抗在我院的临床应用情况,故将“母方案”临床试验(包括篮式试验)纳入为特殊使用的EBM。
我院47例卡瑞利珠单抗超适应证用药中,治疗Sq-NSCLC的有19例(占40.43%)。《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》[21]中指出,无驱动基因Sq-NSCLC患者一线治疗Ⅰ级推荐帕博利珠单抗单药治疗,其中PD-L1高表达(肿瘤细胞阳性比例分数≥50%)的患者免疫治疗获益更加显著。目前,卡瑞利珠单抗治疗Sq-NSCLC已获得一项双盲、随机对照Ⅲ期临床试验结果的支持(NCT03668496研究)[10]。该研究在我国的53个机构中心开展,共纳入了389例未经治疗的ⅢB—Ⅳ期Sq-NSCLC患者,1∶1随机分配至卡瑞利珠单抗联合化疗组、安慰剂联合化疗组(卡铂+紫杉醇)。结果显示,卡瑞利珠单抗联合化疗组患者的中位无进展生存期(mPFS)为8.5个月,中位OS(mOS)>18.4个月;安慰剂联合化疗组患者的mPFS为4.9个月,mOS为14.5个月;安全性方面,卡瑞利珠单抗联合化疗组患者3级以上药品不良事件发生率低于安慰剂联合化疗组(10%vs. 14%)。基于该结果,《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南-2022》[22]将卡瑞利珠单抗联合紫杉醇和铂类药物作为Ⅳ期无驱动基因突变Sq-NSCLC患者一线治疗的Ⅰ级推荐。
本研究中,卡瑞利珠单抗超适应证用药评价为特殊使用的临床诊断包括肾透明细胞癌7例、宫颈癌4例、胃癌4例和卵巢癌1例。一项单臂Ⅱ期临床研究(NCT03816553研究)[12]评估了卡瑞利珠单抗联合阿帕替尼在晚期宫颈癌患者中的有效性和安全性,纳入的患者既往接受过≥2种化疗方案,结果显示,45例患者的中位随访时间为11.3个月(范围为1.0~15.5个月),ORR为55.6%(95%CI为40.0%~70.4%),mPFS为8.8个月(95%CI为5.6个月至未达到),中位缓解持续时间和mOS未达到;最常见的与治疗相关的3—4级药品不良事件为高血压(24.4%)、贫血(20.0%)和疲劳(15.6%)。目前,卡瑞利珠单抗联合法米替尼对比含铂化疗治疗宫颈癌的Ⅲ期临床研究正在开展(NCT04906993研究)[23]。NCT03827837研究[24]是一项多中心Ⅱ期篮式试验,旨在评估卡瑞利珠单抗联合法米替尼在晚期肾细胞癌/尿路上皮癌/卵巢癌/宫颈癌/子宫内膜癌患者中的疗效和安全性。Xia等[13]报道,37例铂耐药的复发性卵巢癌患者接受卡瑞利珠单抗联合法米替尼治疗,ORR为24.3%(95%CI为11.8%~41.2%),mPFS为4.1个月(95%CI为2.1~5.7个月),mOS为18.9个月(95%CI为10.8个月至未达到),中位随访时间为22.0个月(范围为12.0~23.7个月),估计12个月的总生存率为67.2%(95%CI为49.4%~79.9%)。Qu等[14]报道,38例晚期或转移性肾细胞癌患者接受卡瑞利珠单抗联合法米替尼治疗,ORR为60.5%(95%CI为43.4%~76.0%),mPFS为14.6个月(95%CI为6.2个月至未达到)。NCT03631615研究[11]是一项纳入36例局部晚期胃腺癌患者的单臂Ⅱ期临床试验,所有患者接受卡瑞利珠单抗联合放化疗治疗,结果显示,患者的病理完全缓解率为33.3%(95%CI为18.6%~51.0%),PFS≥2年、OS≥2年的患者分别占66.9%、76.1%。上述研究结果表明,卡瑞利珠单抗在相关肿瘤患者中表现出有效的抗肿瘤活性,但仍需开展更大样本的临床研究进一步验证。
检索发现,目前仅有1篇文献报道卡瑞利珠单抗联合靶向药物治疗1例复发性肝内胆管癌患者,患者疾病得到控制,无进展生存期为10个月[15]。检索美国国家癌症研究所及NMPA药品评审中心关于卡瑞利珠单抗的临床试验登记与备案信息,发现至今尚无卡瑞利珠单抗治疗肝胆管细胞癌、纤维组织细胞瘤、前列腺癌、滑膜肉瘤、结肠癌和滤泡树突状细胞肉瘤相关临床试验的开展,亦无相关EBM支持,故尚不支持卡瑞利珠单抗用于治疗以上6个病种。
综上所述,我院卡瑞利珠单抗超适应证用药现象普遍,且卡瑞利珠单抗为国产原研药,尚在新药的5年监测期内,缺乏基于真实世界的药品上市后安全性评价。因此,需要加强管理:(1)临床医师。应限制卡瑞利珠单抗用于治疗肝胆管细胞癌、纤维组织细胞瘤和前列腺癌等无EBM支持的超适应证用药行为,前置处方审核系统弹窗提醒临床医师调整给药方案;超适应证用药前,临床医师应制定超适应证用药可能引发的药品不良反应的应急预案,并预先告知患者及其家属治疗方案的利弊,同时签署患者知情同意书。(2)药学部。成立新型抗肿瘤药物超适应证用药点评小组,对处方/医嘱进行常态化点评;对于已有充分的EBM支持的超适应证用药,应在医务处备案,药学部负责追踪分析评价;对于无EBM支持的超适应证用药,应及时反馈给临床,进行超常预警。(3)医务处。应进一步加大监管和处罚力度,减少不合理用药。三方通力合作,共同保障患者用药安全,降低医疗风险。

