TMEM64在肝癌组织中高表达并促进肝癌细胞的增殖和侵袭
曹丹萍,蔡娟,李艳娜,董润雨,王智雄,左学良
皖南医学院第一附属医院//弋矶山医院1胃肠外科,2肿瘤内科,安徽 芜湖241001
肝癌是全球范围内发病率第6和死亡率第3的恶性肿瘤,我国更是肝癌的高发地区[1,2]。根据2022年我国癌症中心的最新数据,肝癌在恶性肿瘤中的发病率位于第5,死亡率位于第2,5年生存率仅为14.1%[3]。大多数肝癌患者早期无症状,确诊时已处于中晚期,失去最佳手术机会[4,5]。肝癌患者手术后复发率仍然较高,预后极差[6]。挖掘新的诊断标志物和预后预测指标对肝癌患者早期发现,制定个体化治疗方案具有重要临床研究价值。
跨膜蛋白(TMEMs)是一类能够多次跨越细胞膜并参与调控细胞间信号交流和传递的蛋白家族,人类的许多疾病的发生和进展都与跨膜蛋白的功能异常有关[7]。目前,已发现较多的TMEMs在恶性肿瘤中表达失调[8-10],参与调控肿瘤侵袭转移相关通路[11-13]。TMEM64是一个位于8号染色体上的编码基因,属于跨膜蛋白家族的成员。目前对于TMEM64的研究较少,TMEM64在肝癌中的功能未见报道,有待进一步探索。
本研究通过分析癌症基因组图谱(TCGA)和基因型组织表达项目(GTEx)数据库中TMEM64在肝癌中的表达情况和预后预测价值,探究TMEM64对肝癌细胞增殖和侵袭的影响,为肝癌治疗提供新的分子靶标。
1 材料和方法
1.1 数据库分析
从TCGA数据库(n=377)和GTEx数据库中收集了肝癌患者的mRNA 表达谱和临床数据。3 级HTSeq FPKM 格式数据标准化为每百万次读取的转录本(TPM)。使用UCSC Xena3数据库和GTEx数据库中获得TPM格式的RNA测序数据进行分析。
使用Kaplan-Meier曲线和log-rank检验来比较患者生存差异,并将截止值设置为TMEM64的中位表达水平。单变量和多变量Cox回归分析用于评估临床变量对患者结局的影响。单变量Cox回归分析中的预后变量P<0.05被纳入多变量Cox分析。
R软件包DESeq2用于分析和计算差异表达基因(DEGs),并将调整后的P值设置为<0.05,|log2倍变化(FC)|>1作为DEG的阈值。使用Spearman相关分析评估前10位DEGs表达与TMEM64之间的相关性。
使用R包GOplot和R包clusterProfiler 对DEGs进行了功能富集分析,包括GO、KEGG通路富集分析和GSEA基因集富集分析,调整后的P<0.05和错误发现率(FDR)<0.25被视为统计上显著富集的功能或通路。
R软件包rms用于构建nomogram和calibration曲线。通过Cox比例风险回归模型评估肝癌患者总生存时间(OS)的独立危险因素。结合TMEM64 的表达水平与多因素Cox 回归模型中的临床变量,构建nomogram来预测1年、3年和5年的肝癌患者总生存率,使用calibration曲线评估列线图的效能。
1.2 实验材料
1.2.1 组织样本 组织标本来自2021年3月~2022年3月在我院行肝癌切除术的患者的肿瘤组织及邻近正常组织共20例。本研究患者纳入标准:术后病理确诊为肝细胞癌;术前均未接受放疗、化疗、靶向或免疫治疗,所有患者均已签署知情同意书。本研究经皖南医学院第一附属医院(弋矶山医院)伦理委员会批准(2021伦审研12号)。
1.2.2 细胞和试剂 正常肝细胞QSG-7701和肝癌细胞株Hep3B、SMMC-7721、HCCLM3、Huh7 来自中国科学院细胞资源中心。总RNA提取试剂TRIzol和转染试剂LipofectamineTM3000(Invitrogen),RT-qPCR试剂盒来(北京天根生化科技有限公司)。Transwell小室和实验中使用的6 孔板、96 孔板均(Corning),基质胶(BD)。Cell Counting Kit-8(CCK-8)试剂盒(上海贝博生物有限公司),5-Ethynyl-2'-deoxyuridine(EdU)试剂盒则(广州锐博生物科技有限公司)。TMEM64 的siRNA和过表达TMEM64 的质粒委托上海吉玛制药技术有限公司设计构建,其中敲低TMEM64的siRNA序列为:si-TMEM64#1:5'-GCUAUUGUAGCUUGU GAAATT-3',si-TMEM64#2:5'-CCUACCCAGCUUC UGAAUUTT-3'。Western blot实验中主要的试剂如下:BCA 试剂盒(上海碧云天生物技术有限公司)、TMEM64 抗 体(Abcam)、β-tubulin(Cell Signaling Technology)以及超敏ECL发光液(Abbkine)。
1.3 实验方法
1.3.1 细胞培养与转染 细胞使用含有10%胎牛血清的DMEM高糖培养基(含100 U/mL青霉素,100 μg/mL链霉素),置于恒温培养箱(37 ℃,5%CO2)中培育。待细胞密度达到60%~70%,按照LipofectamineTM3000说明书步骤,将siRNAs 分别转染至HCCLM3中,并分组为si-NC(对照组)、si-TMEM64#1(敲低组1)和si-TMEM64#2(敲低组2);将空质粒载体和过表达TMEM64质粒载体分别转染至Huh7细胞中,并分组为vector(对照组)和TMEM64(过表达组)。转染48 h后,分别使用RT-qPCR和Western blot 验证TMEM64敲低和过表达的效率,以及进行后续细胞实验。
1.3.2 RT-qPCR 采用TRIzol试剂从培养的细胞中提取总RNA,接着使用FastKing一步法除基因组cDNA 第一链合成预混试剂合成cDNA,采用SuperReal荧光定量预混试剂将合成的cDNA在ABI QuantStudio3系统(Applied Biosystems)上进行实时PCR扩增,使用2-ΔΔct定量方法计算TMEM64与内参GAPDH的相对表达量。其中TMEM64 的引物序列如下:Forward primer:5'-GGCGTGGCTGAGGTGAGAAA-3';Reverse primer:5'-ATGAAGCCCACGACGAAGAG-3'。GAPDH的引物序列为:Forward primer:5'-AATCCCATCACCATC TTCC-3';Reverse primer:5'-CATCACGCCACAGTT TCC-3'。
1.3.3 CCK-8 消化并离心转染24 h后的细胞及对照组细胞,按照2×103/孔种于96孔板中,并于第24、48、72和96 h使用酶标仪检测其在450 nm波长处的吸光度值。在每次检测前2 h在每孔中加入10 μL的CCK-8试剂,避光置于培育箱中。最后计算不同时间段细胞的增殖水平。
1.3.4 细胞克隆形成实验 将转染48 h后的每组细胞按照2×103/孔均匀种植于新的6孔板中,置于培养箱中培育12 d。收集细胞时使用4%多聚甲醛固定30 min,0.1%结晶紫染色1 h,最后拍照并统计分析细胞增殖的水平。
1.3.5 EdU实验 使用锐博生物的EdU试剂盒来检测细胞的增殖能力。将转染48 h后的实验组和对照组细胞按照6000/孔均匀种于96孔板中,加入试剂A孵育2 h后,将细胞固定在4%多聚甲醛中,用Apollo染色液染色30 min,之后用Hoechst33342对细胞核进行30 min染色。最后在荧光显微镜(200×)下对增殖的阳性细胞进行拍照和计数。
1.3.6 Transwell实验 细胞侵袭实验需提前将Transwell小室的上室中均匀铺入50µL的基质胶,将转染48 h后的细胞及其对照组细胞重悬于无血清培养基中,重新计数,按照5×104/孔细胞移植到小室的上室,下室中则加入600µL含10%胎牛血清的培养基。置于细胞培养箱中继续培育24 h,用含4%多聚甲醛固定,0.1%结晶紫染色1 h。最后在倒置显微镜下拍照、统计分析细胞迁移的百分比。细胞迁移实验则不需铺基质胶,其他步骤同细胞侵袭实验。
1.3.7 细胞划痕实验 将转染24 h后的每组细胞按照一定密度均匀铺入6孔板中(以过夜后贴壁细胞密度达80%左右为宜),第2天使用黄色枪头在六孔板中划出一条直线,PBS清洗后置于电子显微镜下拍照记录0 h划痕的面积。将六孔板中加入2 mL无血清培养基继续培育,48 h后再次在倒置显微镜下拍照记录划痕愈合的面积,分析计算愈合面积的比率并评估两组细胞的迁移能力。
1.3.8 Western blot实验 从分组处理后细胞中裂解并提取总蛋白,采用BCA法检测蛋白浓度,加入适量的上样缓冲液煮沸10 min。每组样本取等量的蛋白进行SDS-PAGE电泳,并湿转到PVDF膜上。用含5%脱脂奶粉的TBST缓冲液室温封闭2 h后,在4 ℃下将PVDF膜与按比例稀释的一抗孵育过夜。TBST冲洗3次,继续将PVDF膜与二抗在室温下孵育2 h,最后使用超敏ECL显色液进行曝光和显色。
1.3.9 免疫荧光实验 采用冰冻切片进行双标法免疫荧光实验。将肝癌组织冰冻切片取出后室温晾干15 min,PBS洗3次,每次5min。使用3%BSA室温封闭1 h,然后加入TMEM64和CD8(Abcam)一抗4 ℃孵育过夜。PBS清洗3次,10 min/次,分别加入相应的荧光标记二抗室温孵育1 h。细胞核利用DAPI染色。滴加抗荧光淬灭剂封片后在激光共聚焦显微镜下拍照。
1.3.10 CD8+T细胞检测分析 将新鲜提取的人外周血单个核淋巴细胞(PBMC)活化后重新计数,并与转染后的肝癌细胞及其对照组细胞按照10∶1的比例共培养。收集细胞后用不同通道荧光标记的CD45、CD3和CD8抗体(BioLegend)对细胞进行染色,并在室温下与细胞一起孵育1 h。通过流式细胞术分析CD8+T淋巴细胞比例。
1.3.11 统计学方法 使用GraphPad Prism 8.0软件对实验结果进行统计学分析,实验组和对照组间计数结果采用独立样本t检验或单因素方差分析进行分析评估,每组实验重复3次。P<0.05为差异具有统计学意义。
2 结果
2.1 TMEM64在肝癌和肝癌细胞系中的表达水平
基于TCGA数据库,分析了TMEM64在泛癌中的表达水平,发现TMEM64在多种恶性肿瘤中均呈现高表达(P<0.001,图1A)。此外,TMEM64在肝癌中的表达水平在非配对样本和配对样本中均显著高于邻近的癌旁组织(P<0.001,图1B、C)。受试者工作特征曲线(ROC)表明TMEM64具有良好的肝癌诊断价值,ROC曲线下的区域(AUC)为0.723(95%CI=0.672-0.773,图1D)。RT-qPCR结果表明,TMEM64在肝癌细胞系中表达水平也显著高于正常肝细胞系(P<0.01,图1E)。
2.2 Kaplan-Meier分析评估肝癌患者TMEM64的表达与预后的价值
根据TMEM64 表达的中位数,肝癌患者被分为TMEM64高表达组(n=187)和低表达组(n=186)。如图2A示,与TMEM64低表达组相比,TMEM64高表达组患者OS 较差(OS:危险比[HR]=1.58,95%CI=1.11-2.25,P=0.011)。多因素Cox比例风险回归分析表明,TMEM64的表达水平是肝癌患者总生存时间的独立危险因素(OS:危险比[HR]=1.693,95%CI=1.087-2.638,P=0.02,图2B,表1)。
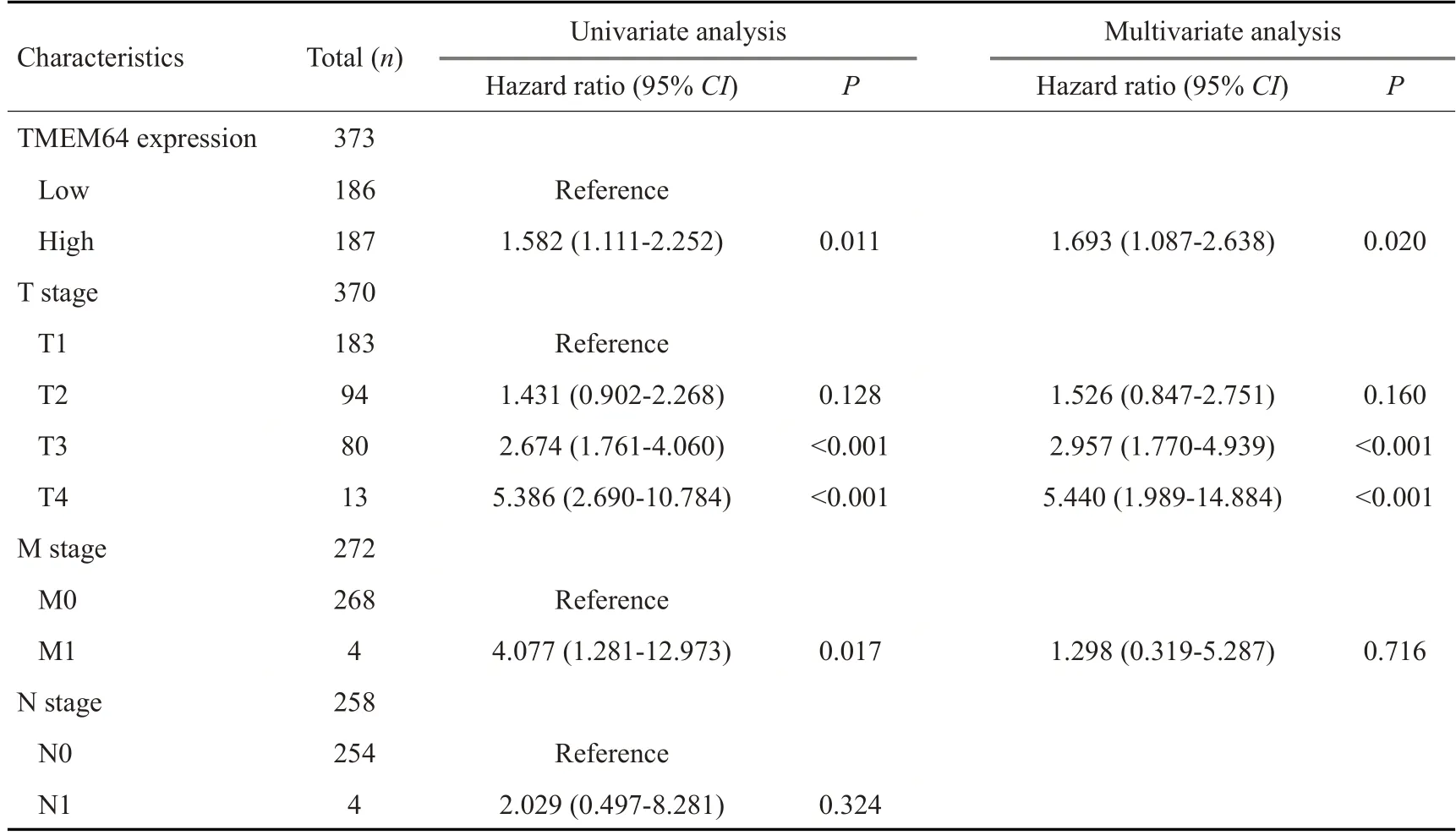
表1 肝癌患者总生存期的单因素和多因素Cox比例风险回归分析Tab.1 Univariate and multivariate analyses of overall survival in patients with Hepatocellular Carcinoma

图2 Kaplan-Meier方法评估肝癌患者TMEM64表达的预后价值Fig. 2 Prognostic value of TMEM64 expression in patients with HCC assessed with the Kaplan-Meier method.A:Overall survival(OS)of patients with high-and low-expression of TMEM64 in HCC.B:Forest map of OS based on multivariate Cox analysis.
2.3 Kaplan-Meier 方法评估不同亚组肝癌患者中TMEM64表达水平的预后预测价值
与TMEM64低表达相比,TMEM64高表达肝癌患者预后在T1~T3、N0、M0、I~III期、G1~G3、BMI>25kg/m2、年龄>60岁、体质量>70 kg以及男性亚组中明显更差(P<0.05,图3)。
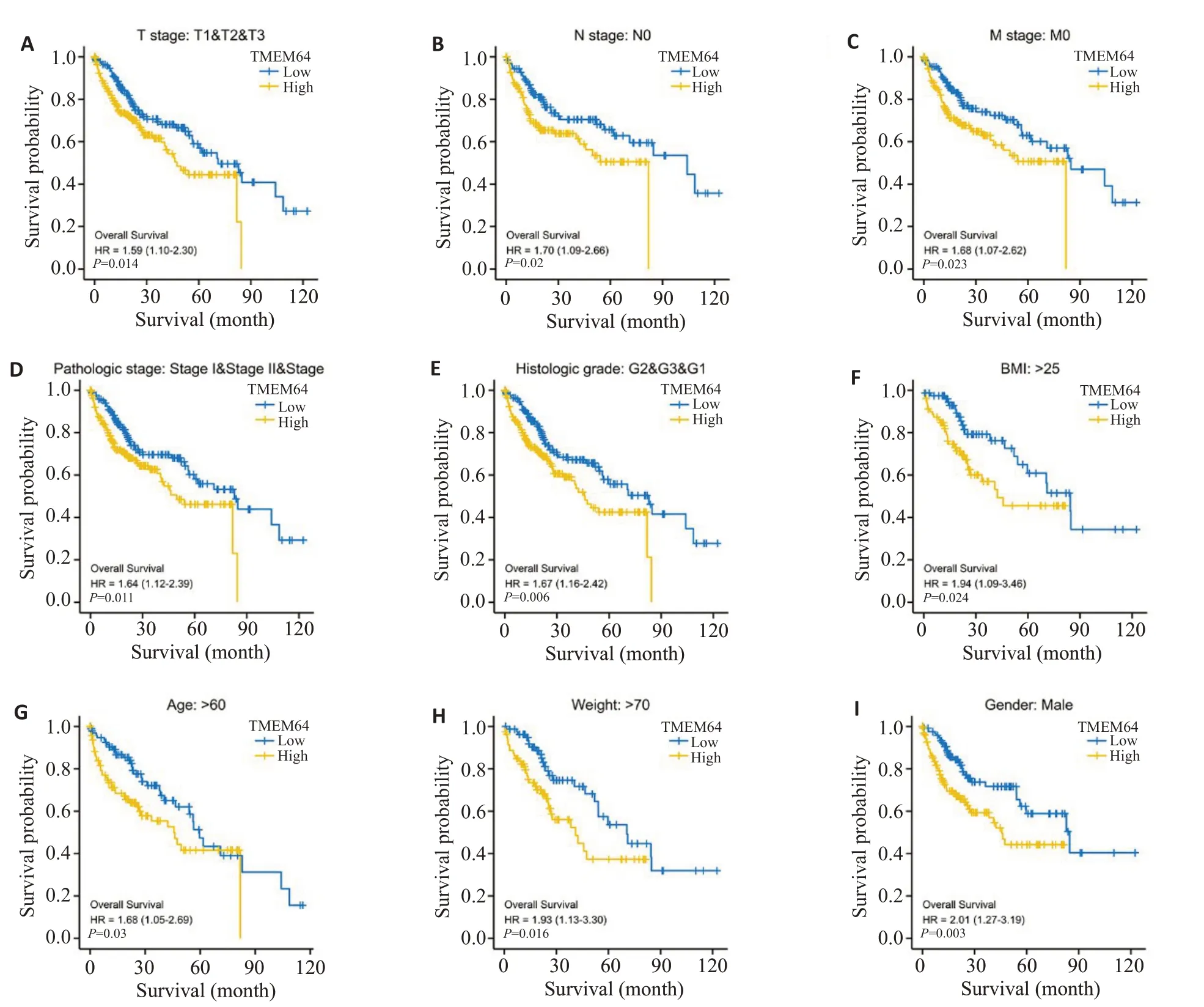
图3 Kaplan-Meier方法评估肝癌患者不同亚组中TMEM64表达的预后预测价值Fig. 3 OS curves of TMEM64 expression levels in different subgroups of liver cancer patients.A-I: OS survival curves of T stage,N stage,M stage,Pathologic stage,Histologic grade,BMI>25 kg/m2,Age>60 years,Weight>70 kg,and Gender subgroups between high-and low-TMEM64 patients with HCC.
2.4 TMEM64表达水平与肝癌组织中免疫细胞浸润水平的相关性
TMEM64 高表达组中肝癌组织中的NK 细胞、CD8+T 细胞和pDCs 的富集分数明显低于TMEM64低表达组(图4A~C)。TMEM64 的表达与NK 细胞(r=-0.138,P=0.007)、CD8+T细胞(r=-0.114,P=0.027)和pDCs(r=-0.321,P<0.001)的免疫细胞浸润水平呈负相关(图4D~F)。免疫荧光实验结果表明,与TMEM64低表达的肝癌组织相比,TMEM64高表达的肝癌组织中CD8+T细胞肿瘤浸润水平显著降低(图4G)。

图4 TMEM64的表达与肝癌组织中免疫细胞浸润水平的相关性Fig. 4 Correlation of TMEM64 expression with immune infiltration level in HCC. A-C: Comparison of immune cell infiltration levels between high-and low-TMEM64 groups.D-F:Correlation between the relative enrichment of immune cells(NK cells,CD8+T cells and pDCs cells)and TMEM64 expression.G:Double-labeled immunofluorescence results indicate that the number of infiltrating CD8+T cells is decreased in HCC tissues with high expression of TMEM64.*P<0.05,**P<0.05,***P<0.001 vs low TMEM64 expression group.
2.5 TMEM64相关的差异表达基因功能富集分析
比较TMEM64高表达组和低表达组的相关差异基因表达情况(图5A),前10 个DEGs 为HS3ST4、MAGEA4、AC016717.2、ANKFN1、CYP11B2、SH3GL3、AC062015.1、PPDPFL、CCR3 和ISM2(图5B)。GO富集分析显示,DEGs显著富集的生物过程包括化学突触传递的调控、信号释放、受体配体活动和经突触信号传递的调节等(图5C)。KEGG通路富集分析表明,DEGs显著富集的途径包括神经活性配体与受体的相互作用、Wnt信号通路和MAPK信号通路(图5D)。GSEA 富集分析发现高TMEM64 表达组中Wnt/βcatenin、JAK/STAT3、KRAS和P53信号通路被显著富集(图5E)。

图5 TMEM64相关的差异表达基因及功能富集分析Fig. 5 TMEM64-related differentially expressed genes (DEGs) and functional enrichment analysis of TMEM64 in HCC. A: Volcano map of the DEGs. B: Heat map of the correlation between TMEM64 expression and the top 10 differential genes.C-D:GO enrichment analysis and KEGG enrichment analysis of the DEGs.E:Gene set enrichment analysis(GSEA)of the DEGs.
2.6 构建和验证基于TMEM64 表达的nomogram 和calibration曲线
根据多因素Cox风险回归分析中有关的临床变量(TMEM64的表达水平和T分期),生成了基于OS独立因素的Nomogram来预测患者1年、3年和5年的预后情况。在Nomogram中,总点数越高,预后越差(图6A)。Nomogram的自举校正C指数为0.644(95%CI=0.618-0.67),该模型对肝癌患者的OS具有中等的预测准确性,其中患者5年OS的模型准确性和一致性预测效能较好(图6B~D)。

图6 预测肝癌患者1年、3年和5年总生存率的nomogram和calibration曲线Fig. 6 Nomogram and calibration curves for predicting OS at 1,3 and 5 years in patients with HCC.A:A nomogram for predicting 1-,3-and 5-year OS of HCC patients.B-D:Calibration curves for 1-,3-and 5-year nomogram predictions.
2.7 敲低TMEM64能抑制HCCLM3细胞的增殖和侵袭
利用siRNA在TMEM64表达相对较高的肝癌细胞HCCLM3 中敲低TMEM64,使用RT-qPCR 和Western blots 验证si-TMEM64#1 和si-TMEM64#2 的敲低效率(图7A、B)。细胞克隆形成、CCK-8和EdU实验结果表明,敲低TMEM64能明显抑制HCCLM3细胞的增殖(图7C-E)。细胞划痕和Transwell实验显示,与对照组相比,si-TMEM64#1 和si-TMEM64#2 组 中HCCLM3细胞的迁移和侵袭能力显著降低(图7F、G)。将转染后的HCCLM3细胞与活化的PBMC共培养,利用流式细胞术检测CD8+T 细胞比例,结果显示敲低TMEM64的肝癌细胞中浸润的CD8+T细胞比例增加(图7H)。

图7 敲低TMEM64能抑制肝癌细胞的增殖和侵袭Fig. 7 TMEM64 knockdown inhibits proliferation and invasion of HCC cells.A,B:RT-qPCR and Western blotting for detecting TMEM64 expression levels in HCCLM3 cells transfected with si-TMEM64#1 and si-TMEM64#2.C,D:Colony formation assay and CCK-8 assay for assessing the effect of TMEM64 knockdown on HCCLM3 cell proliferation.E:EdU assay for assessing the effect of TMEM64 knockdown on proliferation of HCCLM3 cells (×200). F, G: Migration and invasion of HCCLM3 cells with TMEM64 knockdown assessed by Transwell assay and wound healing assay (×200). H: Flow cytometry for detecting the proportion of infiltrated CD8+T cells in PBMC co-cultured with transfected HCCLM3 cells.**P<0.01,***P<0.001.
2.8 过表达TMEM64能促进Huh7细胞的增殖和侵袭
在TMEM64表达相对较低的肝癌细胞Huh7中过表达TMEM64。与对照组相比,转染TMEM64的过表达质粒后,Huh7细胞中TMEM64的表达水平显著增高(图8A、B);CCK-8、细胞克隆形成和EdU实验结果表明,过表达TMEM64能显著促进Huh7细胞的增殖(图8C~E)。细胞划痕和Transwell实验显示,与对照组相比,过表达TMEM64组中Huh7细胞的迁移和侵袭能力显著增强(图8F、G)。流式细胞实验表明,将转染后的Huh7细胞与活化的PBMC共培养,过表达TMEM64组的肝癌细胞中浸润的CD8+T细胞比例减少(图8H)。
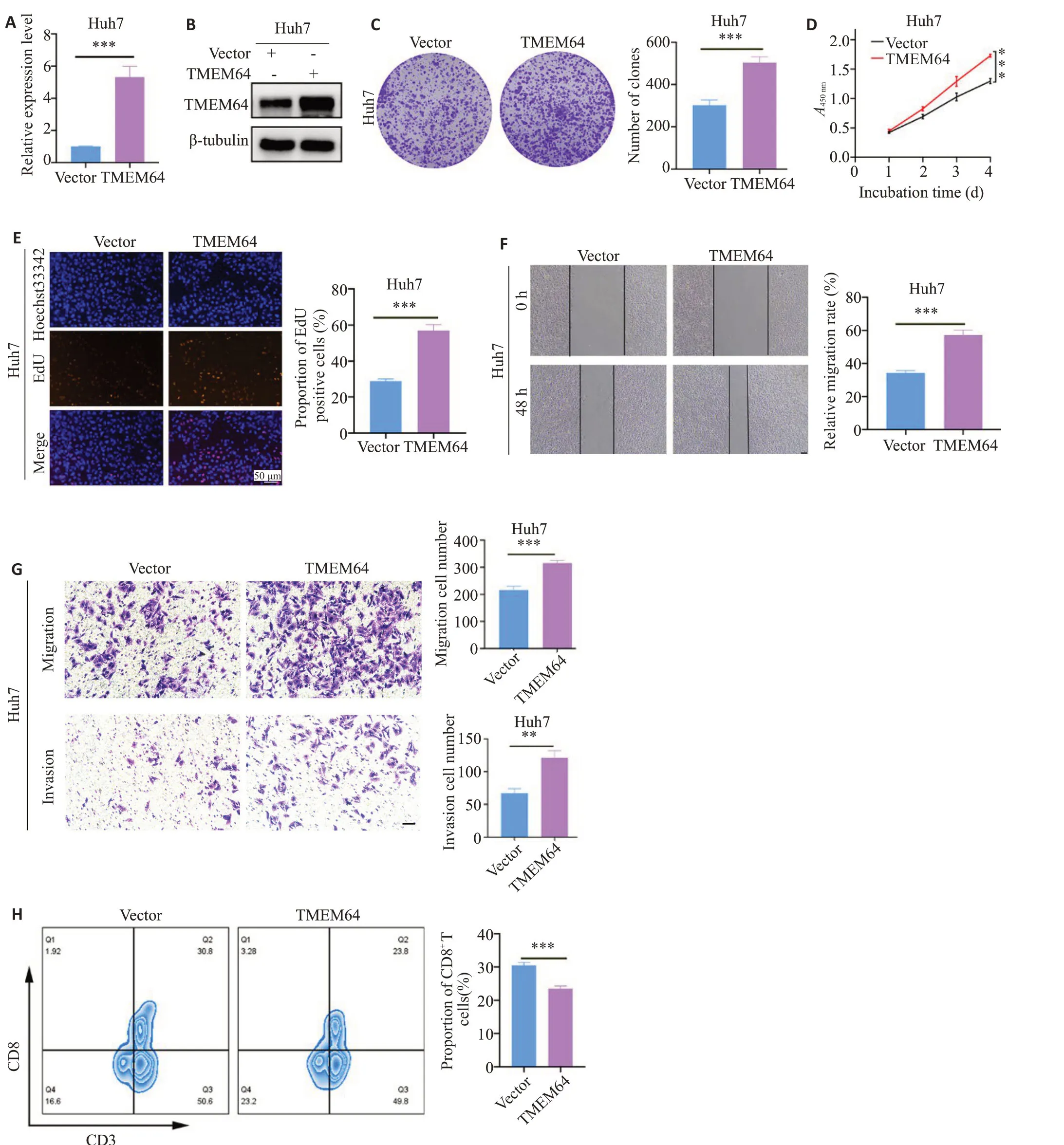
图8 过表达TMEM64能促进肝癌细胞增殖和侵袭Fig. 8 TMEM64 overexpression promotes proliferation and invasion of HCC cells.A, B: RT-qRCR and western blotting for verifying TMEM64 overexpression in Huh7 cells.C,D:Colony formation assay and CCK-8 assay for measuring the effect of TMEM64 overexpression on Huh7 cell proliferation. E: EdU assay for verifying the effect of TMEM64 overexpression on Huh7 cell proliferation (× 200). F, G: Wound healing assay and Transwell assay for evaluating migration and invasion of Huh7 cells with TMEM64 overexpression(×200;scale bar=200 μm). H: Flow cytometry for detecting the proportion of infiltrated CD8+T cells in PBMC cocultured with transfected Huh7 cells.**P<0.01,***P<0.001.
3 讨论
TMEMs的表达失调与肿瘤生长转移[14]及预后[15]密切相关,在肝癌中TMEM106C被发现在肝癌组织中高表达,可作为肝癌预后预测标志物和潜在的治疗靶点[16]。有研究报道TMEM64可以通过调节Wnt3a的分泌调控前列腺癌的进展[17]。TMEM64是一种定位于内质网的七次跨膜蛋白,本研究中首次证实TMEM64是肝癌的潜在预后指标。
本研究通过TCGA数据库分析了TMEM64在肝癌中的表达水平,发现TMEM64在肝癌中的表达水平显著高于癌旁组织,并且高表达的TMEM64与肝癌患者不良总生存时间相关。进一步通过Cox回归分析发现TMEM64的表达水平是肝癌患者总生存率的独立危险因素。我们得出新的结论,TMEM64可能是肝癌不良预后和临床转移的预测的指标。近年来,列线图在恶性肿瘤患者的风险和预后预测中应用较广泛[18,19]。Nomogram图可使用现有的临床信息,将复杂的回归分析结果转变为直观的可视化图形[18,20]。为了更准确、更科学的计算肝癌患者的总体生存概率,本研究构建了基于OS独立因素列线图预后模型来预测患者1年、3年和5年的预后情况,更直观的展示了肝癌患者的预后风险。本研究中的校准曲线也表明:预测模型与实际结果相符,其中患者5年的预测风险最接近实际结果。
肿瘤细胞生长被浸润免疫细胞包围的复杂微环境中[21],肿瘤浸润免疫细胞的预后价值已在实体恶性肿瘤中得到证实[22,23]。浸润免疫细胞也被证明可以预测对新辅助化疗和免疫检查点抑制(ICI)治疗的反应[24,25]。因此,筛查肝癌浸润性免疫细胞可辅助ICI治疗,并对ICI治疗有潜在的预测价值。本研究通过GSEA富集分析评估免疫细胞在肝癌中的相对富集分数,并研究TMEM64的表达与免疫细胞浸润水平之间的相关性,结果显示,TMEM64高表达与NK细胞、CD8+T细胞、和pDCs的浸润呈负相关。有研究报道,TMEM205与CD8+T的浸润呈正相关,并通过降低免疫抑制细胞水平和促进细胞毒性T细胞向肿瘤微环境的浸润来改善肝癌患者的预后[9]。TMEM60的异常高表达影响了巨噬细胞、Tregs等免疫细胞的分布,增加了肿瘤的异质性,促进了肿瘤对治疗的抵抗,导致患者预后不良[26]。CD8+T细胞通常被认为是抗肿瘤免疫的主要介质[21]。CD8+T细胞在活化后通常会分化为细胞毒性T细胞渗透到肿瘤核心或侵袭部位,在杀伤癌细胞中起重要作用。作为天然免疫效应细胞,激活的pDCs和NK细胞都被证明可以阻止肝癌细胞的生长[27]。本研究中采用双标记免疫荧光法验证肝癌组织中TMEM64的表达与CD8+T细胞浸润关系,发现TMEM64高表达的肝癌组织中CD8+T细胞肿瘤浸润水平显著降低。流式细胞实验表明,将转染后的Huh7 细胞与活化的PBMC 共培养,过表达TMEM64组的肝癌细胞中浸润的CD8+T细胞比例减少。这些结果表明,TMEM64的过度表达可能通过调节浸润性T细胞的水平来影响肝癌的进展和预后。
Sébastien等[28]阐述TMEM家族的蛋白是癌细胞传播的潜在贡献者,强调了TMEMs在肿瘤细胞生物学中的影响。Shen等[29]发现,敲低TMEM45B通过JAK2/STAT3途径抑制胃癌细胞的增殖,迁移和侵袭。Zhang等[30]发现,TMEM116可通过PDK1/AKT/FOXO3A信号通路促进肺癌细胞的增殖和肿瘤的转移。Chen等[31]发现,TMEM196通过Wnt/β-catenin信号通路抑制肿瘤的转移和进展。TMEMs已被证实参与多种调控肿瘤转移相关的通路,而TMEM64在肝癌中的潜在机制暂无相关研究,针对TMEM64可能参与调控肝癌转移和复发的信号通路,本研究中进行KEGG和GSEA富集分析发现高TMEM64 表达组中Wnt/β-catenin、JAK/STAT3、KRAS和P53信号通路被显著富集,这些结果我们将在后续研究中进行进一步实验验证。为了进一步探究TMEM64在肝癌细胞中是否具有生物学功能,本研究首次从细胞学水平探究TMEM64对肝癌细胞的生物学特性的影响,发现敲低TMEM64 能明显抑制HCCLM3细胞的增殖和侵袭;而过表达TMEM64可促进Huh7细胞的增殖和侵袭。本研究通过生物信息学分析和体外实验对TMEM64在肝癌的表达水平、预后及生物学功能进行研究,在后续研究中我们将深入探索其调控肝癌进展的分子机制。
综上所述,本研究发现TMEM64在肝癌组织和细胞系中表达升高,且其高表达水平与患者不良预后相关。TMEM64能够促进肝癌细胞的增殖和侵袭,可能参与调控肝癌的恶性进展,有望成为肝癌诊断和预后的分子标志物和潜在的治疗靶点。

