沙门氏菌核酸适配体的筛选、生物传感与抑菌应用
李宸葳,李天顺,王佳,朱龙佼,许文涛*
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业大学 营养与健康系,北京 100190)
沙门氏菌(Salmonella)属于变形菌门肠道杆菌科沙门氏菌属,包括肠道沙门氏菌(Salmonella enterica)和邦戈尔沙门氏菌(Salmonella bongori),其中肠道沙门氏菌下有6 个亚种,包括2 600 多种血清型;邦戈尔沙门氏菌由邦戈尔亚种单独构成。沙门氏菌是1 种杆状的革兰氏阴性菌,好氧或兼性厌氧,周生鞭毛,表现出较强的运动能力。沙门氏菌是最常见的食源性病原体之一[1],常在鸡蛋、奶制品、肉类、海产品等富含蛋白质的食物中检出,对环境具有良好的抵抗能力,在食物、植物表面、水中能存活超过3 个月。沙门氏菌对人体健康具有严重的危害,摄入的病原菌在胃的酸性环境存活后,会进入小肠,跨越小肠的黏液层黏附于肠上皮细胞,诱发一系列肠道炎症,甚至全身系统性感染,表现为腹泻、发烧、胃痉挛、呕吐等症状[2],对于免疫功能低下的人群,沙门氏菌的感染甚至可能威胁生命。目前,为了降低沙门氏菌对人类、家畜、家禽的危害,主要从以下两个方面展开研究:一是开发沙门氏菌的检测方法,及时规避沙门氏菌可能引起的风险,降低摄入病原菌的可能;二是开发防控沙门氏菌感染的新型药物或抗感染策略,对已感染的患者进行有效地治疗,降低病原菌对宿主的危害。
传统的沙门氏菌检测方法是平板计数法:称取一定质量的样品,利用非选择性的培养基进行菌株的复苏和富集,最后通过选择性培养基分离出沙门氏菌,进行计数及血清型鉴定。这类方法操作简单、成本低、结果可靠,但检测时间长,通常需要数天的培养才可得到检测结果,耗时耗力,不适用于多样本检测和现场的快速检测。随着细菌基因组学的不断发展,分子检测技术受到了广泛的关注和应用。对沙门氏菌的特异性靶基因进行扩增,大大提高了检测的灵敏度和特异性,也缩短了检测时间。目前,许多商品化的检测试剂盒已经用于沙门氏菌的筛查和检测中[3]。但这类方法仍需要对样品进行预处理,裂解细菌细胞、提取DNA,在实际应用中仍存在一些局限;另外,引物与非靶标序列的结合、扩增子在检测环境中的气溶胶污染,都可能产生假阳性的结果,需要克服和解决。另外,基于抗体的免疫方法[4]能够特异性分离和检测食源性病原体,通过特异性的捕获,无需扩增,即可实现快速检测。但抗体作为一种蛋白质,存在不稳定、成本高、难储存、生产程序复杂的不足,限制了该类方法的实际应用。
在沙门氏菌感染的治疗方面,同样存在着亟待解决的困难。目前,抗生素仍然是治疗沙门氏菌感染的主流药物,但病原菌对抗生素耐药性不断产生,对疾病的防治提出了挑战。抗生素的研发需要较长的周期,且过程复杂,需要耗费较大的人力物力,因此,近年来很少有新型的抗生素上市。越来越多的研究更倾向于新型药物的开发,寻找新型的治疗、抑菌策略已经成为防治沙门氏菌感染的关键。
适配体具有优异的特异性和靶向性,其在沙门氏菌的检测和防治两个方面,可作为有力的工具,显示出了巨大的发展潜力。适配体是通过配体指数富集的系统进化(systematic evolution of ligands exponential enrichment,SELEX)技术筛选获得的一段单链寡合苷酸序列,能够特异性地与靶标分子形成稳定的复合物。适配体被公认为“化学抗体”,其亲和力和选择性与抗体相当,同时具有稳定性高、易复制、易修饰等独特优势。在检测方面,适配体可作为识别元件,在检测体系中对靶标进行“抓取”,触发各类生物传感器的输出信号,实现快速检测。在治疗方面,适配体可作为药物递送载体的靶向识别模块,搭建协同抗菌体系;另外,特异性结合细菌表面功能结构的适配体可以对活性位点进行封闭,发挥抑菌功能,降低细菌对人体的危害。
本文对沙门氏菌的适配体进行汇总,介绍目前已有适配体的筛选方法,阐述适配体与沙门氏菌的结合机制,整理了目前检测沙门氏菌的各类生物传感器,另外,总结沙门氏菌适配体在抑菌方面的应用,旨在为适配体在检测领域和生物学领域的应用提供参考。
1 沙门氏菌适配体的筛选策略
在SELEX 筛选过程中,最核心的关键点是提高所筛选适配体的特异性和亲和力。目前,已开发多种细菌适配体的筛选策略,包括基于离心的细胞-SELEX(Cell-SELEX);固定靶标的筛选策略,如磁珠-SELEX(magnetic beads-SELEX,MB-SELEX)、琼脂糖珠-SELEX(agarose beads-SELEX,AB-SELEX)、石英晶体微天平-SELEX(quartz crystal microbalance-SELEX,QCMSELEX)等;固定文库筛选策略,如捕获-SELEX(Capture-SELEX)等。另外,根据适配体的应用需求,可对细菌表面的功能成分进行特异性的筛选。目前,已筛选出的沙门氏菌适配体及其筛选策略如表1 所示。
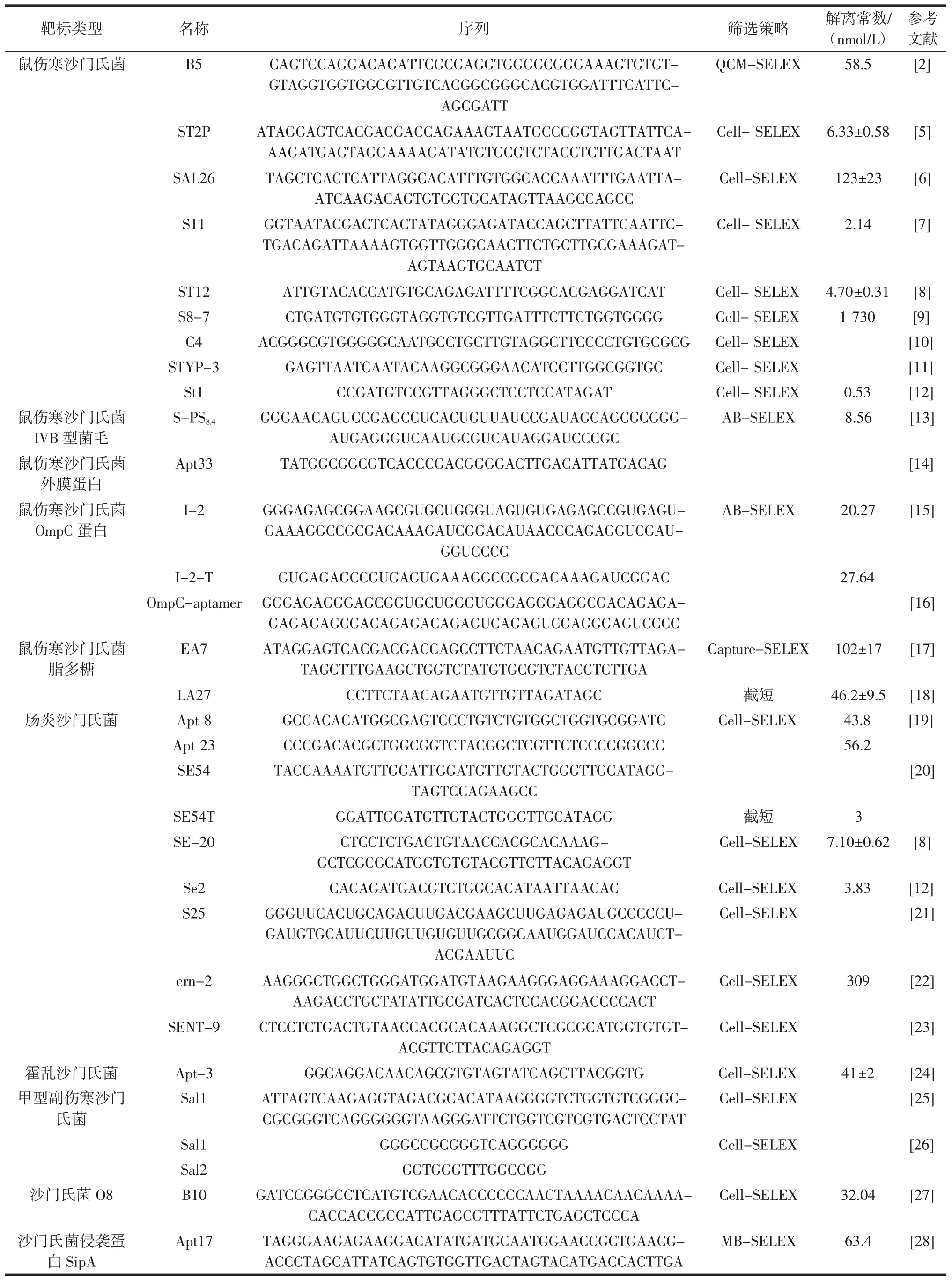
表1 沙门氏菌适配体汇总Table 1 Aptamers against Salmonella
1.1 全细胞-SELEX
全细胞-SELEX(Cell-SELEX)是筛选细菌适配体最常用的方法[5-7]。Cell-SELEX 使用全细胞作为靶标,筛选前不需要对菌表的蛋白质进行提取或纯化,且携带真实的物质分布信息的细胞比单一物质作为靶标更能保证所得核酸适配体在结合中的稳定性,适配体能够与真实的折叠构象结合,具有简单、高效的优点。Cell-SELEX 的通用流程:将单链DNA 文库与靶细胞共孵育,洗脱非结合序列,95 ℃下加热细胞-ssDNA 复合物使其变性,然后离心,从细胞中回收结合序列。通过引入其他细菌作为反筛靶标育,可以确保所选的适配体对目标沙门氏菌保持高特异性。然后利用聚合酶链式反应(polymerase chain reaction,PCR)扩增获得的序列通过不对称PCR、酶消化技术等方法制备单链次级文库[29],再进行下一轮的筛选。Liu 等[27]报道了采用Cell-SELEX 筛选的识别沙门氏菌O8 细胞的适配体,但筛选靶标是灭活的沙门氏菌,所筛选的适配体是否可以识别活的沙门氏菌尚未得到验证。为了能够让适配体在检测、诊断及治疗等方面更好地应用,在后续的研究中,往往更多采用活的沙门氏菌作为靶标[8]。
通过Cell-SELEX 技术所选择的适配体不仅与靶菌具有更稳定的结合,而且,可用于探究细胞上未知表面蛋白和新的生物标志物,这是使用单一物质作为靶标不能实现的[30]。但在互作分析时,因为互作靶标的未知性,Cell-SELEX 所筛选的适配体需要与菌表成分进行逐一互作探究,需要耗费较大的工作量,这也成为了Cell-SELEX 的应用局限。
1.2 固定靶标的筛选策略
固定靶标的筛选策略是指将需要筛选的靶菌或特异性成分固定在可分离的固定载体上,再与DNA 或RNA 文库进行孵育,通过分离载体实现与靶标有亲和力和没有亲和力的核酸序列的区分。早在2009 年,Joshi 等[14]将鼠伤寒沙门氏菌外膜蛋白固定在硝酸纤维素膜上,利用侧流色谱装置筛选出了特异性结合鼠伤寒沙门氏菌的适配体。目前,已经被应用于沙门氏菌适配体筛选的固定载体包括琼脂糖珠[13,15]、磁珠[28]和载玻片[16]等。Wang 等[2]采用了一种较为新颖的方法,利用石英晶体的压电效应,将电极表面的质量变化转换为电信号输出,成功研发了基于QCM 的筛选策略。QCMSELEX 能够有效检测晶体表面的分子相互作用,实时监测适配体池的亲和力变化,具有快速、高效和低劳动成本的显著优势。
固定载体可能存在非特异性吸附,因此,需要选择合适的封闭剂对载体进行化学改性。Shatila 等[28]在利用谷胱甘肽功能化的磁珠进行筛选时,添加0.1 mg/mL牛血清白蛋白和0.025 mg/mL 鲑鱼精子DNA 作为结合缓冲液,避免了非特异性相互作用,成功获得了沙门氏菌侵袭蛋白SipA 的高亲和力适配体。
1.3 固定文库的筛选策略
Capture-SELEX 是最主要的固定核酸文库的筛选方法,使用捕获探针将文库固定到基质上,只有序列与靶标相互作用并发生构象转变时才能够从基质上洗脱。Capture-SELEX 无需修饰或改变靶标的化学结构,保持了靶标的天然结构,并且靶标以游离状态与文库结合,可以暴露所有潜在的结合位点[31],在结构转换型适配体的筛选中发挥了重要作用。Ye 等[17]通过Capture-SELEX 的方法,筛选到针对革兰氏阴性菌的广谱适配体,能够同时识别来自伤寒沙门氏菌、肠炎沙门氏菌、大肠杆菌055:B5、铜绿假单胞菌的脂多糖。脂多糖(lipopolysaccharide,LPS)也称为内毒素,由脂质A、核心多糖和O-特异性多糖组成。其中脂质A 是LPS 的高度保守成分。将ssDNA 文库首先固定在抗生物素蛋白包被的磁性纳米粒子(avidin-coated magnetic nanoparticles,aMNPs)上,加入伤寒沙门氏菌进行了6 轮“预筛选”,对与伤寒沙门氏菌有亲和力的适配体进行了富集,然后利用其他革兰氏阴性菌进行广谱型适配体的选择,得到了可以识别LPS 的脂质A 的广谱型适配体。因此,在多重靶标适配体的筛选中,利用Capture-SELEX 不需要对每一个靶标进行固定,简化了试验流程,提高了筛选效率,当需要筛选广谱型适配体时,Capture-SELEX 更具优势。
1.4 后筛选策略(Post-SELEX)对适配体的优化
通常情况下,适配体序列中并非每一个核苷酸都发挥作用,只有少数核苷酸与靶标结合并诱导构象改变。因此,越来越多的研究者会在筛选完成后对获得的适配体序列进行优化,将其裁剪到最小的紧凑结构,获得亲和力更高、特异性更强、组织穿透率更高的适配体。Kolovskaya 等[8]在去除原始适配体两端的引物结合区域后,截短的适配体表现出更好的结合能力,同时抗菌活性从9%增加至42%。这可能是因为不参与结合识别的引物结合位点的去除降低了序列的负电荷(细胞壁同样带负电)和空间位阻。Chinnappan 等[20]基于适配体的二级结构预测进一步截短适配体SE54。首先研究两个茎环结构,证明其没有与靶标结合后,从两个发夹的中间截断,得到29mer 的截短适配体。与原始SE54 适配体相比,对肠炎沙门氏菌的亲和力高两倍,证实截短的适配体与肠炎沙门氏菌形成更稳定的复合物。
优化后的适配体更加简洁、高效,有助于打破其应用的局限,优化的过程中,需要深入了解适配体和靶标的结合机理,为适配体的裁剪和工程化提供指导。
2 基于沙门氏菌适配体的生物传感策略
2.1 光学生物传感器
利用适配体与菌体之间特异性结合后引起的光吸收、荧光、散射等光学信号的变化,可实现光学生物传感器的构建。光学生物传感器结构简单、灵敏度高、检测快速,吸引了越来越多的关注。目前,用于沙门氏菌检测的光学生物传感器主要分为5 种:基于比色、荧光、化学发光、表面增强拉曼散射和光热效应的生物传感器。
2.1.1 比色生物传感器
比色生物传感器具有直观读出方便、操作简单等优点,在分析传感领域广受欢迎。其中,比色方法中最常见的工具是金纳米颗粒(gold nanoparticles,AuNPs)[32-33]。Xu 等[32]基于AuNPs 共轭双功能寡核苷酸探针和适配体,开发了一种快速、可视化的鼠伤寒沙门氏菌检测方法。AuNPs 与双功能寡核苷酸探针和适配体缀合后,加入靶标细菌一起孵育。适配体与靶标结合并发生构象变化,导致AuNPs 被释放。释放的AuNPs 会在NaCl作用下聚集,使溶液的颜色从红色变为蓝色。该方法的检测限为10 CFU/mL。另外,基于纳米材料的模拟过氧化物酶活性的比色传感器应用也十分广泛[33],适配体能够封闭纳米酶的催化活性,在与分析物结合后会导致纳米酶活性的恢复。Tarokh 等[34]制备了石墨氮化碳纳米片和氧化铜纳米晶体的新型复合材料,具有良好的类过氧化物酶活性,实现了对鼠伤寒沙门氏菌的检测。该方法的纸质设备检测时间仅需6 min,实现了无酶、无标记的快速检测。此外,pH 响应比色传感原理简单、成本更低,也具有良好的应用前景。Yan 等[35]通过加入酚酞指示剂和百里酚酞指示剂构建了pH 响应的纳米粒子,开发了双适配体夹心策略,实现了对大肠杆菌和鼠伤寒沙门氏菌的同时检测,并且还研发了病原菌双重检测自动装置,可以通过机械臂自动完成样品吸收、孵育、洗脱等试验操作,整个检测过程只需要通过NEMO 软件进行编辑,可实现按键检测。该系统有望应用于病原菌监测的早期防控,推动检测行业向自动化、便捷、高通量方向发展。
2.1.2 荧光生物传感器
目前,基于适配体的荧光生物传感器的荧光标记主要分为两类:一类是荧光素5-异硫氰酸酯(fluores cein isothiocyanate isomer I,FITC)和吲哚三碳菁(cyanine 3,CY3)等特定化学修饰[36],一类是合成的荧光多功能纳米颗粒,如量子点[26]、碳点[37]、上转换纳米颗粒[38]、铜纳米颗粒[39]和银纳米簇[40]等。按照传感策略可将其划分为单标记型荧光传感器[35,37]和基于荧光共振能量转移(fluorescence resonance energy transfer,FRET)的双标记型荧光传感器。Du 等[37]开发了一种基于量子点和四面体DNA 的生物传感器,通过在磁珠表面修饰适配体捕获鼠伤寒沙门氏菌,并将其从复杂基质中分离出来,另一条适配体与荧光碳点偶联形成荧光微球。这些微球能够主动识别鼠伤寒沙门氏菌并与靶标结合发出荧光。检出限为9 CFU/mL,检测范围为10~108CFU/mL。Rm等[26]开发了一种基于适配体的FRET测定法,用于测定甲型副伤寒沙门氏菌。氧化石墨烯(graphene oxide,GO)用作荧光猝灭剂,通过π-π 静电相互作用吸附适配体标记的量子点并实现荧光猝灭。在目标菌存在的情况下,观察到荧光恢复。这种方法可在15 min 内响应,检出限为10 CFU/mL。另外,研究者们还开发各类信号放大方法,有助于提高检测灵敏度,如引入核酸等温扩增技术[41]、使用多价适配体探针[37]、磁分离预浓缩目标微生物[42]等。目前,荧光传感器已被广泛用于食品中的沙门氏菌检测,随着便携式荧光检测器的发展,荧光生物传感器在现场检测领域将发挥更大潜力。
2.1.3 化学发光生物传感器
化学发光(chemiluminescence,CL)信号由化学反应产生,无需激发光照射,可避免光散射、光源波动和高背景值的干扰,是食品安全检测中很有前途的策略。Hao 等[43]利用适配体修饰的Fe3O4磁性纳米颗粒作为捕获探针,捕获靶菌后与滚环扩增产物形成三明治复合物,N-(4-氨丁基)-N-乙基异鲁米诺[N-(4-aminobutyl)-N-ethylisoluminol,ABEI] 结合AuNPs 作为信号探针,与滚环扩增产物结合,构建稳态的化学发光体系,产生CL 信号。该传感器能够特异灵敏地检测鼠伤寒沙门氏菌,线性检测范围为32~3.2×106CFU/mL,检出限为10 CFU/mL。稳态CL 系统可以有效避免随机误差,提高了检测的选择性和准确性。Lee 等[44]将化学发光法与比色法进行了对照,建立一种使用发夹DNA适配体传感器检测鼠伤寒沙门氏菌的简单方法,发夹探针包含靶标结合适配体和具有辣根过氧化物模拟酶活性的G-四链体,引入氯化血红素和对香豆酸开发比色和化学发光传感策略,结果证明,化学发光法的灵敏度提高了近50 倍。
2.1.4 表面增强拉曼散射生物传感器
表面增强拉曼散射(surface-enhanced Raman scattering,SERS)是一种超灵敏的振动光谱技术,当目标分析物吸附在贵金属纳米材料表面时,能够通过电磁和化学相互作用放大拉曼信号。基于SERS 的生物传感器灵敏度高、结果准确的定量检测能力,已被广泛用于病原体检测。在各种SERS 活性基质中广泛存在“热点”,如单分散颗粒、核壳结构、二聚体、三聚体和纳米星等。Ma 等[45]制备了由拉曼信号分子标记的适配体序列介导的金/银纳米二聚体颗粒,并用作SERS 信号探针。使用适配体功能化的磁性纳米颗粒实现病原体的捕获和富集,然后在细菌与其适配体之间的识别作用下形成三明治结构复合物。由于二聚体之间产生的“热点”效应放大结合处的拉曼信号,从而实现牛奶样品中鼠伤寒沙门氏菌的灵敏检测。随着手持式拉曼检测平台的发展,SERS 方法得到越来越广泛的关注。但食品中的复杂成分可能会降低所开发方法的灵敏度,目前,在复杂生物环境中提供拉曼信号的特异性和灵敏增强仍然是一个重大挑战。
2.1.5 光热信号生物传感器
光热信号是一些重金属纳米材料独有的特性,当重金属纳米颗粒受到特定激发光的激发,可在近红外区表现出优异的光热性能。光热信号可以避免检测样品基质中有色物质对检测信号的影响,解决了背景干扰的问题。Huang 等[46]利用Au-Pd 纳米颗粒的光热特性构建了一种简单、快速、防污、灵敏的沙门氏菌检测方法。首先,将甲基丙烯酸磺酰钠(sodium sulfonyl methacrylate,SBMA)通过光聚合改性,与沙门氏菌特异性适配体孵育,然后将其附着在棉签表面。SBMA 增加了棉签拭子的防污性,防止在取样时沾染大量的非特异性蛋白,而适配体可对样品中的沙门氏菌进行捕获。将棉签浸入适配体修饰的Au-Pd 纳米颗粒溶液中,适配体识别棉签上的沙门氏菌,使得棉签颜色变为棕色,实现了检测结果肉眼可见。另外,利用“蛇眼”设备实现了定量分析。蛇眼设备由激光发射器、红外测温仪和智能手机组成,能够读取光热信号的温度变化数据,用于定量检测有色食品中的沙门氏菌。在鸡蛋、番茄和牛奶样品中,这一传感器显示了良好的检测效果,线性检测范围为102~107CFU/mL,检出限为13.20 CFU/mL。结果表明,光热信号传感器对复杂的食品基质尤其是有色食品基质表现出了较高的灵敏度,易于现场使用。
2.2 电化学生物传感器
电化学检测方法因其响应快速、高灵敏和造价低廉等优点在生物诊断、环境监测和食品安全领域发挥着重要作用。将沙门氏菌适配体作为特异性捕获探针修饰到电极表面,通过靶标结合诱导的电化学信号的变化实现对沙门氏菌的定量检测。根据信号类型可分为电流型、阻抗型、电导型和压电型生物传感器等。如Wang 等[2]利用石英晶体微天平实现对鼠伤寒沙门氏菌适配体筛选过程的监测,同时能够在1 h 内检测到103CFU/mL 的鼠伤寒沙门氏菌。利用石英晶体电极的压电特性,将晶体表面的质量变化转化为电信号,不需要额外的信号标记即可实现检测,但传感灵敏度仍需进一步提高。研究者们开发了多种多样的信号放大方法:1)在电极材料中引入新型纳米材料(如还原氧化石墨烯[47]、银纳米颗粒[48]、多壁碳纳米管[49]、二氧化钛[50]、金属有机框架[51]等)和复合纳米材料,起到增加表面积、加速电子转移并有效增强电化学信号的作用。2)引入核酸等温扩增技术[52]形成大量重复序列,从而极大地放大检测信号。3)引入辣根过氧化物酶催化系统增加电流响应[53]。作为一种具有吸引力的方法,光电化学适配体生物传感器目前尚未应用于沙门氏菌的检测研究之中。
3 沙门氏菌适配体的抑菌应用
适配体除了作为识别元件,还可用于对靶标菌的检测,也可以作为辅助药物,通过干扰细胞内生化反应、减少生物毒素的释放、控制菌膜的形成等作用在生物学领域发挥重要的作用。针对感染沙门氏菌的患者,通常使用抗生素及时进行治疗,近年来,肠道沙门氏菌中抗菌素耐药性的增加已成为全球严重的临床问题。大多数沙门氏菌属已获得对氨苄西林、氯霉素、链霉素、磺胺类和四环素类药物的多重耐药性,自20世纪70 年代,新型抗生素的研发速度减慢,在实验室条件下通过微生物纯培养的方法已经很难从微生物代谢产物中获取新的、并具有开发价值的抗生素。如今,寻找新型抑菌、杀菌策略已经成为治疗沙门氏菌感染的关键方向。
3.1 适配体单独抑菌
3.1.1 抑制沙门氏菌对肠道细胞的黏附
已有大量的研究证明,对编码细菌表面有生物功能成分的基因进行敲除或突变,可以有效减少细菌对肠道上皮细胞的黏附[54],实现抑制毒性的目的。如果利用适配体与这些关键成分优先进行靶向结合,让其不能发挥活性,也可以达到同样的作用。例如,由三型分泌系统(type three secretory system,T3SS)介导的上皮细胞感染需要结构蛋白、转子蛋白、效应蛋白、伴侣蛋白等发挥协同作用,对某一种蛋白进行活性抑制或突变,可能会对沙门氏菌表面的侵入效果产生很大影响。沙门氏菌表面的蛋白SipA 是一种效应蛋白,侵入过程中导致宿主细胞的肌动蛋白聚合,进而诱发侵入部位的细胞膜褶皱,这一过程有利于细菌细胞的内化。Shatila 等[28]通过MB-SELEX 的方法筛选了SipA 的适配体Apt17,表现出了良好的亲和力,在沙门氏菌感染人上皮结直肠腺癌细胞前加入Apt17,可以降低25%的黏附和18.03%的入侵,证明适配体具有作为抗黏附剂和抗入侵剂的潜力。提高适配体与靶标的亲和力可以进一步提高抑制百分比,优化药物的治疗效果。另外,菌毛是革兰氏阴性菌菌体表面的丝状蛋白,具有抗原性,与致病性相关。Pan 等[13]筛选了识别沙门氏菌IVB 型菌毛结构蛋白的RNA 适配体S-PS8.4,不仅利用S-PS8.4 显著抑制了沙门氏菌进入人类THP-1 细胞,同时为分析细菌菌毛结构与宿主细胞的相互作用、探究发病机制方面提供了新的思路和工具。
3.1.2 抑制生物膜的形成
生物膜也叫作菌膜,是细菌组成的群落,通过细胞外大分子黏附在固体表面。在生物膜中,细菌被包裹在由多糖、细胞外DNA、菌毛、鞭毛组成的细胞外基质中,有助于细菌在不利环境中生存。生物膜的形成使细菌对抗生素产生了高度的耐药性,也不利于宿主免疫防御系统对其的清除。作为细菌细胞重要的运动结构,鞭毛介导的方向性和附着性在生物膜形成的初期起到了十分重要的作用。已有许多研究证明,运动缺陷型菌株很大程度上也会成为生物膜缺陷型菌株[55]。因此,抑制鞭毛的功能对抑制早期生物膜的形成十分重要。Ning 等[24]研究了沙门氏菌适配体的新应用途径,适配体可以限制鞭毛蛋白的旋转频率,覆盖其结合位点,增强细胞和表面的静电排斥,可以抑制生物膜的初始附着。首先筛选了霍乱沙门氏菌的适配体Aptamer3,利用结晶紫法测定生物膜的形成,随着适配体浓度的增加,沙门氏菌的存活率降低至13.8%,用1.1 μmol/L 的适配体预处理后,5 μg/mL 氨苄西林钠产生的活性抑制率可以达到未预处理组100 μg/mL 的抑制效果。这一结果表明,筛选细菌鞭毛的适配体可作为一种新策略,成为抑制生物膜形成的有效手段。
3.1.3 诱导细胞膜去极化
Kolovskaya 等[8]研究了筛选获得的适配体对肠炎沙门氏菌和鼠伤寒沙门氏菌的影响,结果发现适配体和沙门氏菌孵育30 min 后,会引起细菌膜去极化并抑制琼脂平板上菌落的形成。但适配体诱导的细菌膜去极化的分子机制仍有待确定。此外,适配体还有望通过抑制细菌生物毒素的释放来降低致病性。脂多糖,也称为内毒素,在低浓度时对免疫系统有益,但在高浓度时有害,可能引发各种食源性疾病或感染,例如发烧、腹泻、感染性休克、多器官衰竭,甚至死亡。Ye 等[17]筛选获得了针对革兰氏阴性菌的广谱适配体,鉴定的适配体具有作为用于分析和临床应用的毒性抑制剂的潜力。
3.2 适配体辅助型抗菌药物
3.2.1 与纳米材料联用
纳米材料是指至少有一维处于纳米量级的新一代材料,包括无机和有机两大类。在抑菌方面,纳米材料可作为载体,封装抑菌药物并将其递送至患处,实现保护药物活性、增强药效的目的。除此之外,许多纳米材料本身也具有优越的抗菌性能,具有抗菌谱广、稳定性好、抗耐药性强等优势,受到了广泛的关注和研究。如Yang 等[56]设计了一种DNA 模板化银纳米团簇(DNA-AgNCs),将其光学性能和抗菌性能巧妙地结合在一起,成功实现了细菌的可视化监测和有效清除;基于DNA-AgNCs 开发了具有优异的选择性和抗菌活性的荧光纳米膜,在活性包装和生物医学工程方面表现了良好的应用潜力。
大多数纳米材料并不具有靶向性,非靶向的递送机制效率低,难以通过重重屏障。通过表面修饰具有靶向性的配体,可以更好地发挥作用。适配体分子量小、亲和力高,是赋予纳米材料靶向抗菌特性的良好选择。Mao 等[57]利用GO 与适配体结合,开发了一种可以除去已形成生物膜的抗菌药物。石墨烯可以从细胞膜中提取磷脂并破坏其完整性,通过适配体与GO 的协同作用,适配体-GO 复合物表现出了更优的抗菌效果,可实现(93.3±3.4)%的生物膜抑制率和(84.6±5.1)%的生物膜降解率,提升了GO 的抑菌效果。适配体改性的纳米材料作为新型药物,可以避免抗生素的滥用,并有助于遏制耐药细菌数量的上升,在食品行业、生物医学等领域提供了新思路,具有良好的发展前景。
3.2.2 与抗菌药物联用
由于缺乏有效的递送系统,许多抗菌药物穿透能力差,在到达感染部位前易被降解,或被人体的免疫系统识别清除,在临床应用中受到了阻碍。为了达到治疗效果,往往需要服用更高剂量的药物,不仅可能引起严重的副作用,也提高了治疗成本。适配体作为识别元件,不具有细胞毒性、易于修饰,被广泛应用于抗菌药物的递送系统中。Yeom 等[58]设计了一种基于AuNPs-DNA 适配体的共轭递送系统,先前的研究证明了该系统可以有效将重组蛋白递送到哺乳动物体内,且不具有细胞毒性。该研究实现了抗菌肽(antimicrobial peptides,AMPs)的有效递送,抗菌肽是由生物体产生的活性分子,是先天免疫反应的重要组成部分。AMP 可以与脂多糖和脂磷壁酸结合,破坏细胞膜,此外,AMP 带有正电荷的氨基酸残基可以与带负电的细胞膜发生静电相互作用,这一过程可能改变AMP 的二级结构,促进其抗菌效果。利用适配体修饰的AuNPs装载靶向递送AMP,与单独注射AMP 相比,受鼠伤寒沙门氏菌感染的小鼠从只能存活5.1~5.7 d 提高至100%存活10 d 以上,表明靶向递送发挥了更优的治疗效果。Liu 等[59]采用硬模板法合成空心氮化碳纳米球。通过修饰适配体进一步实现了对鼠伤寒沙门氏菌的选择性消毒。在4 h 内,几乎所有鼠伤寒沙门氏菌都被HCNS-Cap-Apt 灭活,而金黄色葡萄球菌和大肠埃希菌仅13.3%和48.2%细胞被分别杀死。因此,HCNS 是一个很有前景的基于适配体的荧光检测和选择性消毒鼠伤寒沙门氏菌的生物平台。通过在基于HCNS 的药物递送系统上装饰适配体作为识别模块,进一步实现了选择性抗菌功能。
4 小结与展望
本文总结沙门氏菌适配体的筛选策略,全面汇总能够特异性识别沙门氏菌的适配体序列,为后续的研究应用提供了有力工具;综述了沙门氏菌适配体生物传感器的研究进展,全面阐述了沙门氏菌适配体在抑菌治疗中的应用。为了更好地发挥沙门氏菌的应用价值,仍需从多方面进行努力和突破。1)开发更高效、经济、自动化的适配体筛选平台,进一步丰富适配体种类。目前沙门氏菌适配体的筛选方法较为单一,以Cell-SELEX 为主,致使多数适配体与沙门氏菌之间的互作关系尚不明确。此外,虽然开发了特异性结合沙门氏菌鞭毛蛋白、外膜蛋白、脂多糖等靶标的适配体,但诸如荚膜等结构性毒力因子尚未筛选获得适配体。未来可以在提高筛选效率的基础上,获得更加全面靶标的适配体,以期能够发挥抑菌减毒等作用。2)更精准地探究适配体与沙门氏菌结合位点与结合方式,为进一步的生物学应用奠定基础。明确沙门氏菌上能够被适配体特异识别的位点对于研究适配体在抑制生物膜形成、降低内毒素毒性等方面具有重要作用。但目前很少有对沙门氏菌的结合位点进行解析的研究。3)适配体是检测和防御致病菌的适用工具,并可以成为临床医生有价值的抗感染治疗工具。目前,沙门氏菌适配体主要是用于诊断检测,在治疗效用领域的研究还较少。未来可以通过纳米颗粒、抗菌药物与适配体联用,为食源性致病菌的诊治提供新的思路。

