皮质远盲蚓体内酶对土壤有机碳形态及碳库管理指数的影响
林晓钦,崔莹莹,张孟豪,张 池,侯舒雨,戴 军,周 波
(1.华南农业大学资源环境学院, 广州 510642;2.广东省农业科学院茶叶研究所/广东省茶树资源创新利用重点实验室,广州 510640)
【研究意义】土壤是陆地生态系统中的最大碳库[1-2],其微小变化就能够改变大气二氧化碳浓度和土壤碳累积速率[3],从而影响全球气候变暖进程。为探究土壤碳库活度及土壤碳定量变化,Blair等[4]引入碳库管理指数(CPMI)指数表征土壤有机碳库质量,它是土壤碳变化的监测方法,能够反映土壤质量下降或更新程度[5-6]。过去40年集中探讨了土壤团聚体特征及其对土壤碳储存的影响,但是较少关注生物扰动在这一进程中的作用[7]。生物扰动是土壤形成过程的重要驱动因素之一,特别是土壤大型动物及其食物网对于土壤碳循环和转化具有关键作用。蚯蚓是土壤中生物量最大的无脊椎动物[8],它在活动过程中不仅促进土壤有机碳在团聚体中的积累,同时也可以影响土壤有机碳矿化,增加CO2的释放[9]。目前蚯蚓对土壤有机碳形态、碳库活度的影响研究鲜少[10],在全球温室效应加剧的背景下,研究蚯蚓对它们的影响具有积极意义。【前人研究进展】Lubbers等[11]研究发现,接种蚯蚓使山毛榉树林土壤碳矿化量提高24.6%;张卫信等[12]基于亚热带森林的田间试验,发现与单纯植物处理相比,蚯蚓与植物的联合作用下,增加了土壤二氧化碳排放,土壤新陈代谢加快。土壤新陈代谢过程会持续受到酶的影响[13],目前对于蚯蚓与酶的相关研究主要分为两个方面,其一是接种蚯蚓后土壤性质的改善以及对土壤酶活性的影响;再者是基于蚯蚓对土壤生态的毒理试验,环境胁迫下蚯蚓体内酶的活性研究[14],主要集中在重金属对抗氧化酶系统的影响方面。【本研究切入点】除此之外,对于蚯蚓体内酶活性与土壤有机碳相关性研究则较少。蚯蚓活跃于有机物质循环的初始阶段,有机物质在被栖息于土壤中的无脊椎动物吞食并受到其肠道内酶的作用后更容易分解[15],故蚯蚓体内酶与土壤有机碳库的联系不可忽略。【拟解决的关键问题】通过探究皮质远盲蚓(Amynthascorticis)在生长周期内对土壤有机碳库的影响,厘清蚯蚓体内酶与土壤有机碳库形态变异规律与蚯蚓对土壤碳库管理指数的关联,以期为研究蚯蚓促进土壤有机碳库良性发展提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤采集自广东省英德市农田(113°38′ E,24°23′ N),采样深度0~20 cm,自然风干后过2 mm筛。该地区土壤主要为发育于第四纪红色黏土的红壤,pH 5.45,有机碳和全氮含量分别为19.85和1.36 g/kg,碳氮比为14.6∶1.0;添加的水稻秸秆粉碎过2 mm筛,pH 9.65,有机碳和全氮含量分别为345.29和5.73 g/kg,碳氮比为60.25∶1.00。供试蚯蚓为华南地区本地表栖型远盲蚓属皮质远盲蚓(A.corticis)[16],采自广东省农科院茶叶研究所英德基地,单体重约1 g/条。
1.2 试验方法
本试验采用室内培养方法,于2021年10月至2022年2月接种蚯蚓于土壤中进行持续100 d的土壤培育。试验设置未接种蚯蚓的对照组(CK)和接种蚯蚓的处理组(E),每个处理15个重复,共30盆土壤培育装置。培养基质碳氮比约25是蚯蚓较适宜的生育环境[17-18],因此本试验称取过2 mm筛的1.5 kg土壤和0.05 kg水稻秸秆装入带孔塑料培养盆(10 cm ×14 cm),并放入恒温培养箱,在22 ℃、80%田间持水量条件下进行24 h稳定培养。然后试验选取10条(10 g)健壮的皮质远盲蚓接种至土壤中,分别于20、40、60、80、100 d随机选择3盆进行破坏性采样和观察。
根据蚓粪的稳定性、形状、大小等特征[19-20],借助2 mm网筛[21]手工分离蚓粪与未吞食土壤,风干保存备用。部分土壤不做筛选,储存在4 ℃冰箱保存。另外,每个周期(20 d)收获的蚯蚓,在每个处理中随机选取3条蚯蚓。用无菌水洗净、擦拭后,将蚯蚓放置在铺有湿润滤纸的玻璃皿中,加少量水,用塑料薄膜封口,并用解剖针扎孔,将烧杯放入20 ℃、湿度80%的恒温培养箱中[22],进行清肠处理,时间持续1周。待清肠结束后,进行蚯蚓体内肠道酶活性测定。
1.3 测试方法
对分离出来的蚓粪和未吞食土壤进行有机碳及其形态相关指标测定,测试指标见表1。
酶活性指标包括蚯蚓体内的胃蛋白酶(PG)、过氧化物酶(POD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、纤维素酶(CL)和脂肪酶(LPS)。将蚯蚓用无菌水洗净、擦拭后,剪取蚯蚓组织,在索莱宝试剂盒说明书指导下先备好或配制所需试剂,然后将蚯蚓组织在冰上进行研磨制取酶液,在高速冷冻离心机下(10 000 r/min,4 ℃)离心,留上清液,根据不同酶类需要加入试剂,最后利用紫外分光光度计ND-1000测定蚯蚓体内酶活性水平。

表1 土壤有机碳及其形态碳的测定方法
碳库管理指数(Carbon pool management index,CPMI)的计算遵循Blair等[4]研究中使用的方案。
碳库指数(CPI)=样品全碳含量/对照土全碳含量
碳库活度(CPA)=易氧化性有机碳含量/稳定态有机碳含量
碳库活度指数(CPAI)=样品碳库活度/对照土壤碳库活度
碳库管理指数(CPMI)= CPI×CPAI×100
1.4 数据处理
用Excel 2010进行数据整理,用SPSS 26.0统计软件对不同处理间的差异进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较,运用软件R 4.04对土壤有机碳库形态变化等进行主成分分析。为了更直观和形象的表现各指标间的相互关系,采用Mantel test分析对各指标间联系进一步说明。
2 结果与分析
2.1 皮质远盲蚓生长情况与体内酶活性的变化
由表2可知,蚯蚓生物量随着时间的推移先增加后缓慢减少。试验初始阶段(0~80 d)蚯蚓存活率维持在较高水平,达90%以上,直到整个培育试验结束采样时才发现蚯蚓存活数与初始值差异显著,此时存活率为76.70%;另外在蚯蚓培育60 d时发现有幼蚓存在。
对土壤碳循环密切相关的蚯蚓不同时期6种体内酶活性进行测定,培育试验结束后,蚯蚓碱性磷酸酶未发生显著变化,酸性磷酸酶显著增加70.17%,胃蛋白酶显著减少27.48%(图1-a);过氧化物酶无显著性变化,脂肪酶显著增加15.14%,纤维素酶则显著减少53.73%(图1-b)。
2.2 土壤有机碳含量及其组分的变化
蚯蚓的存在使得初期土壤有机碳含量及其各组分转化效率均有所加速,但在培育试验结束时,各碳指标含量的变化略有不同。土壤有机碳含量(图2-a)、颗粒有机碳(图2-b)和可溶性有机碳(图2-c)未显著变化,整个培育过程变化较大的是土壤可溶性有机碳(图2-c),40~60 d期间,ES中的可溶性有机碳含量急剧上升,分别达到EG和CK的2.71和5.28倍,试验结束时,ES中的可溶性有机碳含量达到CK和EG的1.40和2.26倍;土壤可矿化碳(图2-d)、腐殖质碳(图2-e)和轻组有机碳(图2-f)含量显著下降;土壤微生物生物量碳和易氧化有机碳(图2-g,2-h)含量显著提高,其中EG比ES和CK的土壤微生物生物量碳分别增加36.24%和86.29%,EG的易氧化有机碳比ES和CK分别增加30.99%和83.25%。
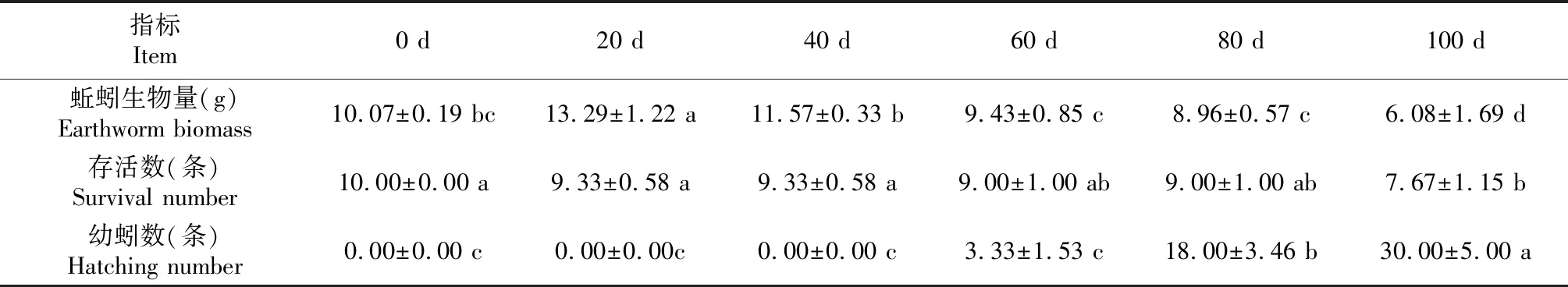
表2 不同时期蚯蚓生物学指标

图中数据为均值±标准差(n = 3),同一个指标中凡是有一个相同的字母表示差异不显著(P<0.05,Duncan’s法)。

将蚯蚓培育全时期的5个阶段CK、ES和EG测定的碳指标进行主成分分析,以观察培育过程中三者整体趋势间的联系(图3),第一主成分(Ax1)和第二主成分(Ax2)累积方差贡献率达到69.1%。其中:第一主成分(Ax1)的方差贡献率为41.9%,与MBC、HC、MOC、LFOC和SOC紧密相关(P=0.001);第二主成分(Ax2)的方差贡献率为27.2%,与DOC、POC和EOC紧密相关(P=0.001)。ES、EG与CK的差异主要在第二主成分上,而EG与ES的差异主要在第一主成分上,因而区别于蚯蚓掘穴等体外活动,蚯蚓体内酶对土壤碳库形态的影响主要体现在第一主成分有较高方差贡献率的指标上,即MBC、HC、MOC、LFOC和SOC。
2.3 皮质远盲蚓体内酶活性与有机碳含量及其组分的相关性
将第一主成分占有率较高的指标筛选出来,与蚯蚓体内酶做Mantel test分析(图4),因第一主成分是EK和EG的差异体现,所以可表征蚯蚓体内酶与土壤有机碳含量及组分相关性。AKP、ACP、POD、CL、PG和LPS 6种酶中,AKP、ACP、CL、LPS和PG 5种酶与土壤中的有机碳组分显著相关(P<0.05),而POD对有机碳形态转化的影响不具备统计学意义。其中,ACP、AKP与POC、HC、LFOC、MBC显著相关;而MOC只与ACP显著相关,CL与POC、LFOC、MBC显著相关;LPS与POC显著相关,PG与HC显著相关(P<0.05),土壤有机碳含量与这6种酶均无显著相关。
2.4 皮质远盲蚓对土壤碳库管理指数的影响
由表3可见,不管是蚓粪还是未吞食土壤,试验结束后,CPI值均没有显著差异,蚯蚓基本不改变原本碳库或碳汇功能;蚓粪和未吞食土壤中CPAI均显著高于对照组,蚓粪分别高出未吞食土壤和空白对照组98.18%和38.85%;而本试验中CPMI均高于对照组,其中未吞食土壤是对照组的1.45倍,蚓粪是对照组的1.95倍。
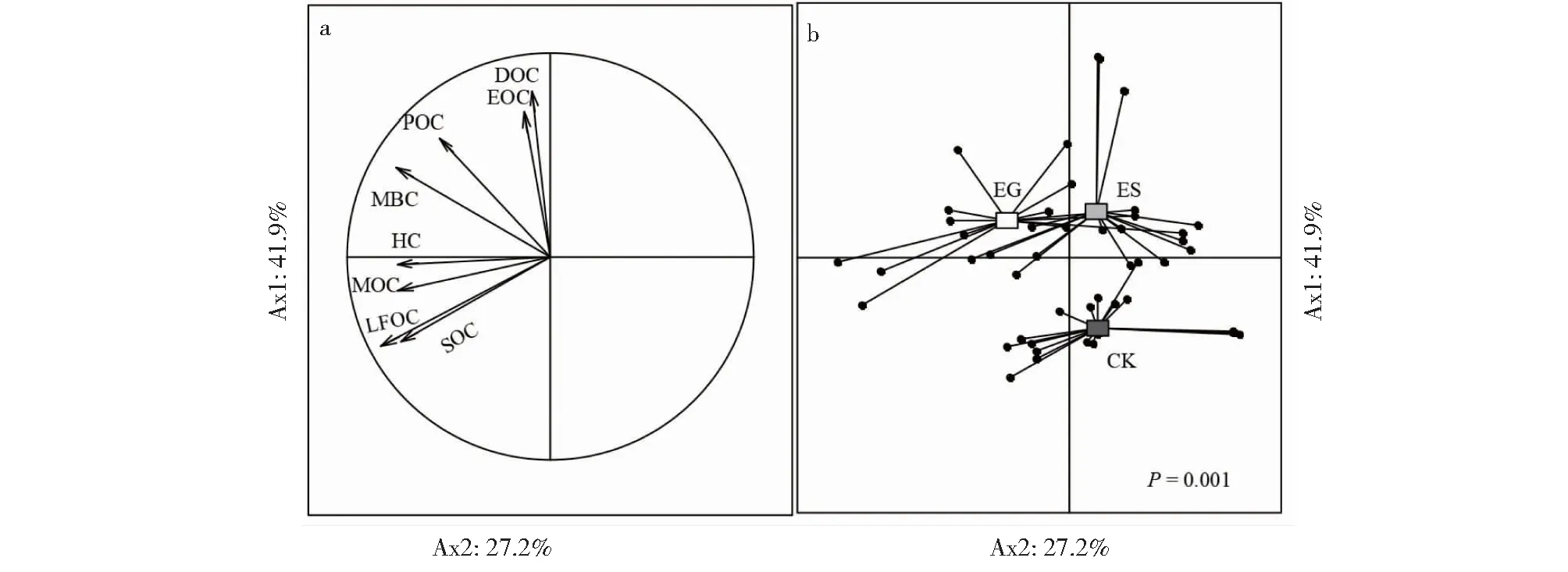
DOC:可溶性有机碳;EOC:易氧化碳;MBC:微生物生物量碳;POC:颗粒有机碳;HC:腐殖质碳;LFOC:轻组有机碳;MOC:可矿化碳;SOC:土壤有机碳。

图4 蚯蚓体内酶活性与土壤有机碳含量及不同形态有机碳Mantel test分析

表3 土壤碳库管理指数(CPMI)
3 讨 论
3.1 添加有机物料对维持蚯蚓活性的影响
有机物料添加对保持蚯蚓在土壤中的活性及功能至关重要。蚯蚓每天能够消化相当于自身体重1倍的有机物,有机物经蚯蚓沙囊粉碎及肠道蠕动后,在消化道分泌的酶类作用下分解成易被自身吸收利用的物质[29],维持蚯蚓生命活动。本试验初期,皮质远盲蚓较活跃、生物量显著增加、存活率高,这一现象与王皓宇等[30]人工繁殖壮伟远盲蚓(A.robustus)和南美岸蚓(Pontoscolexcorethrurus)的结果基本一致。但在60~80 d后,本研究显示蚯蚓生物量有明显降低,土壤中有机物料不足可能影响蚯蚓的生长。因此,及时添加蚯蚓生长所需的有机物料,是蚯蚓活动下土壤有机碳库周转效率持续稳定的重要保证。
3.2 蚯蚓加速土壤有机碳库转化效率
接种蚯蚓后,土壤有机碳库的周转和形态转化效率加快。本研究接种蚯蚓初期,土壤有机物充足,蚯蚓摄取大量有机物,肠道内微生物与它协同分解有机质,又通过排泄将部分有机物归还土壤[31]。试验后期土壤有机碳的总储量不变与蚓粪团聚体的物理保护密切相关[7, 32]。同时,本研究中可溶性有机碳在监测后期也没有显著变化,且在幼蚓出现(40~60 d)时显著增加(P<0.001),可能是由于幼蚓产生阶段粘液分泌量有所增加。粘液是由蚯蚓体表分泌的一种水溶性混合物,富含易被利用的活性有机质,可以明显刺激基质中可溶性有机碳转化[33-34]。另外,腐殖质碳、可矿化碳和轻组有机碳含量在试验初期(0~20或0~40 d)显著提高,但在试验后期显著下降。腐殖质碳是有机物料在动物、微生物和酶等作用下形成的特殊类型高分子有机化合物的混合物[35]。因而前期有机物料充足时腐殖质碳显著增加,后期碳源不足可能是腐殖质碳下降的原因;与本研究结果相同,Zhang等[36]发现蚯蚓接种初期土壤有机碳矿化加快,但随着时间推移,矿化效率减缓,最终与未接种蚯蚓组相比,蚯蚓的碳矿化总量并没有增加;王争妍等[37]研究表明蚯蚓的存在使得二氧化碳排放速率整体上均呈“前高后低”特征;而于建光等[38]在土壤中混施秸秆的研究中发现,有无接种蚯蚓轻组分有机碳之间无显著差异,这可能是时间尺度上造成的差异。土壤微生物生物量碳和易氧化碳含量均在接种蚯蚓后显著提高,接种蚯蚓后土壤微生物生物量增加、优化碳、氮相关功能微生物群落结构多样化发展可能是上述现象发生的重要原因[39-40]。
此外,蚓粪与未吞食土壤中的可溶性有机碳和易氧化碳含量无显著差异,因而二者含量的变化应归功于蚯蚓其他生命活动,如掘穴影响,而与蚯蚓体内酶无关。测试的6种蚯蚓体内酶中,胃蛋白酶(PG)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、纤维素酶(CL)和脂肪酶(LPS)与土壤有机碳库循环效率呈正相关,表明这5种酶在蚯蚓生物体内对部分有机物的转化密切相关,蚯蚓体内酶调控生命活动,进而对土壤碳库产生影响。而过氧化物酶(POD)是一种生物组织老化或污染物出现等情况下常见的抗氧化酶[41],本研究显示各处理土壤POD活性均维持在稳定水平,其对碳库转化影响不敏感。
3.3 蚯蚓提高土壤有机碳库管理水平
在蚯蚓的作用下,土壤有机碳库向良性发展。不论是接种蚯蚓处理中的未吞食土壤还是蚓粪,其碳库活度指数和碳库管理指数都显著提高,说明蚯蚓的加入提高了土壤碳库的利用效率,这与井大炜等[42]的研究一致。其中蚓粪团聚体的指数提高最显著,这与土壤团聚体本身的属性有关,土壤团聚体是土壤易氧化有机碳良好的储存场所[43-44];而未吞食土壤碳库管理指数的提高则可能与蚯蚓粘液有关,秸秆分解过程中,蚯蚓分泌的粘液会促使土壤发生激发效应[45],提高活性有机碳在土壤碳库中的比例。在日后的土壤碳库管理中将其与蚯蚓养殖以及现代有机农业结合在一起,具有一定的可塑性。
4 结 论
短期培育过程中,蚯蚓的生物扰动对土壤有机碳库总量无影响,但加速了土壤有机碳的周转效率,影响土壤有机碳库形态。接种蚯蚓会减少土壤的轻组有机碳、腐殖质碳和可矿化碳含量,增加土壤微生物生物量碳和易氧化碳含量。土壤碳氮相关酶活性与土壤碳组分变化密切相关,蚯蚓活动改变微生物量及活性,土壤团聚体形成是提高土壤碳库利用率和碳库管理指数的关键。本研究为未来土壤碳库管理、现代有机农业生产和蚯蚓主导的生物培肥管理技术提供重要的科学参考。

