深圳市3种不同林分丘陵林地土壤细菌群落特征
董志强,史正军,谢惠春,曾 伟,冯世秀,邓 丽
(1.青海师范大学生命科学学院,西宁 810008;2.深圳市中国科学院仙湖植物园/深圳市南亚热带植物多样性重点实验室,广东 深圳 518004;3.广东深圳城市森林生态系统国家定位观测研究站,广东 深圳 518004)
【研究意义】土壤细菌是土壤生态系统的关键组成部分,在生态系统中占据重要地位。土壤细菌在土壤发育过程中起着物质循环、能量流动和信息传递等关键作用,且土壤细菌群落变化也是反映土壤发育程度和健康状况的重要指标[1]。不同恢复模式不仅可以改变土壤细菌群落和多样性,而且对土壤微环境也有重要影响[2]。本研究通过分析景观林、人工林和次生林3种林分类型对土壤细菌群落的作用,研究不同植物类型与土壤细菌群落之间的关系。【前人研究进展】研究表明,不同植被会引起土壤微生物群落结构的不同[3]。不同植被凋落物的量、土壤酸碱度及不同植被区域土壤C、N和P含量也是影响土壤微生物群落的因素[4-5]。微生物是一种重要的环境因子,在改变土壤微环境中发挥重要作用。其存在会改变土壤中的微生态平衡,并促进植物的健康成长[6-7]。【本研究切入点】1990年以来,深圳市积极推进“灭荒复绿”运动,大力发展马占相思人工林,使其成为当地的重要景观[8],为纪念香港回归种植土沉香景观林以及天然次生林3种林分类型,利用高通量测序技术检测不同林分土壤细菌群落变化特征。【拟解决的关键问题】从微观角度探讨3种林分土壤细菌群落特征,分析不同林分土壤细菌群落组成及多样性的变化趋势,为研究南亚热带不同植被恢复模式林分生态系统特征提供参考。
1 材料与方法
1.1 研究区概况
深圳市属于亚热带海洋性气候,全市平均气温22.4~38.7 ℃,极端情况下低至0.2 ℃,无霜期355 d。雨量充沛,4—9月是雨季,降雨量达1933.3 mm。9块林内含3块沉香人工林(“97回归林”)、3块马占相思人工林和3块天然次生林。在海拔91~110 m的山谷和丘陵地带,植被丰富,大部分都是由花岗岩构成的酸性赤红壤。土沉香林(表示为“A”)林龄约25年,优势树种为土沉香,平均胸径15.6 cm,平均树高8.2 m,郁闭度0.85;下层植被主要为蟛蜞菊(Pengqijudecoction),覆盖度10%。马占相思林(表示为“B”)林龄约35年,优势树种为马占相思,平均胸径27.5 cm,平均树高23.4 m,郁闭度0.85;下木主要为紫金牛(Ardisiajaponica);灌木主要为豺皮樟(Litsearotundifoliavaroblongifolia)与珊瑚树(Viburnumodoratissimum),平均树高2.5 m,盖度为75%;草本主要为芒箕,盖度为80%~90%。次生林(表示为“C”)林龄大概30年,优势树种为黄牛木(Cratoxylumcochinchinense)与栲树(Castanopsisfargesii),平均胸径14.1 cm,平均树高11.5 m,郁闭度0.95;下木主要为紫金牛,平均树高1.5 m;灌木主要为珊瑚树,平均树高3.8 m,盖度15%;草本主要为苔草(Carexleucochlora)、芒箕(Dicranopterisdichoyoma)、铁线蕨(Adiantumcapillus-veneris),盖度5%。
1.2 样地选择和样品采集
各林分固定样地规格为20 m×20 m,内设5 m×5 m共3块小样方。同林分各样地间距约50 m。本研究在每块样地的3块小样方中心区域进行取样,记为该固定样地的3次重复。为减小每种林分样地之间的影响,样地与样地之间设置50 m过渡带。取土之前先从土壤表层剥离出0~10 cm层的凋落物,并从中取出5个,均匀混合,最终获得27个土壤样品。将这些样品带回实验室,其中一部分经过风干处理,筛选出2 mm颗粒,用于土壤理化性质检测,另一部分则保存-80 ℃超低温冰箱中,以备后续测定土壤细菌多样性。
1.3 土壤化学性质分析方法
重铬酸钾氧化-外加热法确定土壤有机质,钼锑抗比色法测定速效磷,凯氏定氮法测出全氮,火焰光度法测出全钾,NaOH碱溶-钼锑抗比色法测出全磷,NH4Ac浸提-火焰光度法测定速效钾,水解性氮通过碱解扩散法测定,酸碱度通过电位法(土地比为1∶2.5)和电导法(土地比为1∶5)确定[9]。
1.4 土壤DNA提取
采用E.Z.N.A.提取试剂盒(D4015,Omega,Inc.,USA),根据其产品标签的指示,从中抽取出微生物的DNA样本,利用NanoDrop ND-1000分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)或者0.8%琼脂糖凝胶电泳,对获得的DNA数量及其质量作出准确检验。为了更深入地研究样本,需将其放置在-80 ℃低温条件下。

表1 3种不同恢复模式林分土壤基本化学性质
1.5 基因扩增与测序
聚合酶链式反应(PCR)引物序列为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)。在测定土壤细菌V3~V4区域时,采用PCR反应体系,其中包括DNA 50 ng、PCR预混物12.5 μL、正反向引物各2.5 μL和dd H2O 25 μL。扩展过程分别为:98 ℃预变性30 s,98 ℃改变10 s,54 ℃退火30 s,72 ℃延长45 s,35个周期,最后延长10 min。高通量测序委托广州普乐倍康生物科技有限公司完成。
1.6 数据处理及作图
采用Microsoft Excel 2013对数据进行整理,采用SPSS 26.0进行方差分析比较不同林分土壤化学性质差异性,通过RDA冗余分析探讨土壤化学指标与土壤细菌群落之间的关系,并利用R语言中ggplot2包进行绘图。
2 结果与分析
2.1 不同恢复模式林分土壤化学性质基本特征
由表1可知,经过25~30年的恢复期后,3种林分土壤化学性质表现出一定差异。其中阔叶次生林有机质平均含量为105.2 g/kg,显著高于土沉香林(73.7 g/kg),而土沉香林和马占香思林之间、阔叶次生林和马占相思林之间土壤有机质平均含量无显著差异(P>0.05,下同),土壤全氮和水解性氮表现为阔叶次生林和马占相思林之间无显著差异,但均显著高于土沉香林(P<0.05,下同);而土壤全磷和有效磷平均含量则相反,表现为土沉香林最高。土壤全钾平均含量表现为阔叶次生林最高,其它2个林分差异不显著,但速效钾含量则表现为土沉香林显著高于其它2个林分。3种恢复模式林分之间土壤pH呈显著差异。其中,土沉香林土壤pH平均值为6.25,而马占相思林和阔叶次生林土壤pH分别为4.0和4.61。土壤电导率表现为阔叶次生林最低,土沉香林和马占相思林土壤电导率未表现出显著差异。
2.2 不同恢复模式林分土壤细菌群落多样性
2.2.1 阿尔法(Alpha)多样性分析 韦恩图可以揭示3种林分细菌群落门水平下共有和特有的菌群。本研究选取丰度>1%的菌群,从门分类水平上进行分析,共鉴定出44个门,其中马占相思林和次生林各有一个独有菌群,土沉香林土壤门水平细菌群落有9个特有的细菌群落(图1)。
由图2可知,在3种不同林分中, 次生林土壤细菌群落 Chao1指数高于土沉香林与马占相思林土壤细菌群落Chao1指数,但三者不存在显著差异。土沉香林土壤细菌群落Shannon指数与马占相思林土壤以及次生林土壤细菌群落Shannon指数均存在显著差异,而马占相思林土壤细菌群落Shannon指数与天然次生林土壤细菌群落Shannon指数无显著差异。说明土沉香林土壤细菌群落数量在门水平上结构更为复杂。
2.2.2 贝塔(Beta)多样性分析 通过坐标中上的点,分析不同样本群落组成,反应样本之间的差异和距离,基于 Bray-Curtis 对其进行 PCoA 分析(主坐标分析),反映样本间的差异和距离因素。由图3可知,在土壤微生物群落中主成分1(PCoA1)的贡献率为26.21%,主成分2(PCoA2)的贡献率为14.1%。土沉香林与马占相思林椭圆没有存在交集,表示两种土壤中细菌组成成分不相似;次生林椭圆几乎与土沉香林和马占相思林重叠,表明该地区土壤细菌群落与其余二者中土壤细菌群落结构组成相似。

图1 门水平上3种林分细菌群落
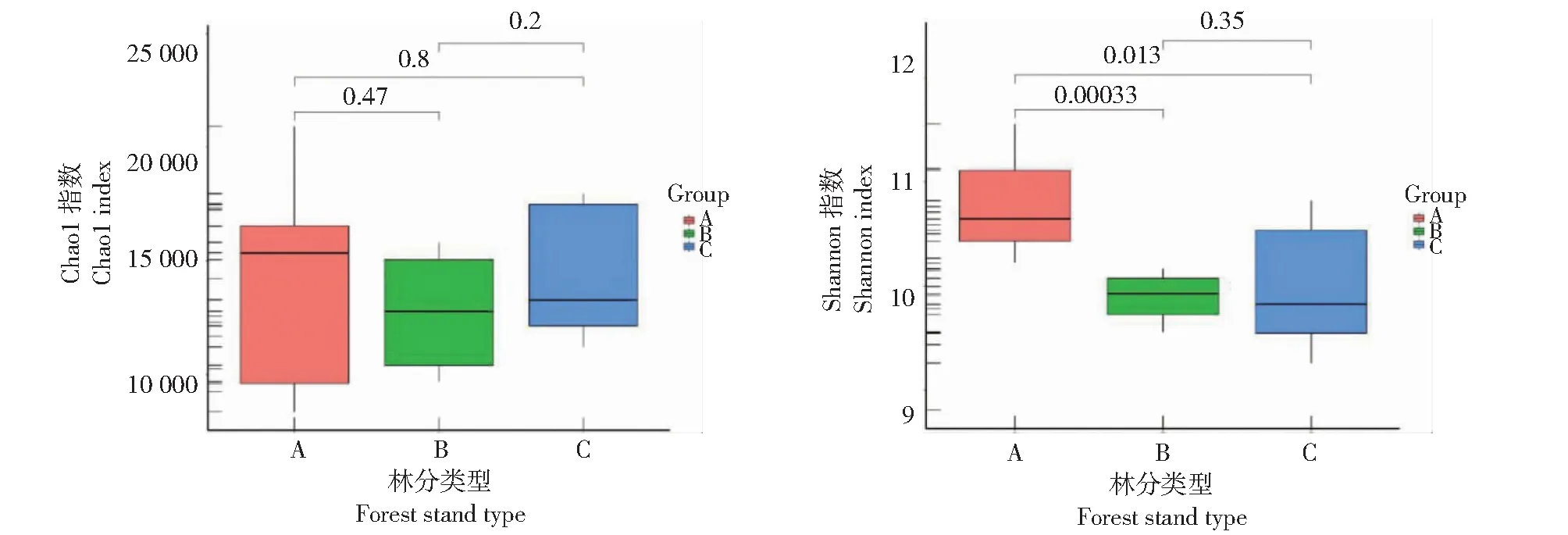
图2 α多样性指数
2.3 不同恢复模式土壤细菌群落组成
在分析土壤细菌群落组成时,过滤掉相对丰度0.001%的群落,保留在各组样品群落出现频率为70%以上的菌群,对检测出对各个水平前10的群落进行分析。由图4可知,土沉香林土壤细菌群落在门水平分别为变形菌门(Proteobacteria,34.64%)、酸杆菌门(Acidobacteria,25.92%)、放线菌门(Actinobacteria,9.03%)、绿弯菌门(Chloroflexi,5.27%)、疣微菌门(Verrucomicrobia,3.97%)、浮霉菌门(Planctomycetes,3.82%)等。马占相思林土壤细菌群落中酸杆菌门(Acidobacteria,37.32%)为优势菌群,其次为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)以及WPS和疣微菌门(Verrucomicrobia)等。次生林土壤细菌群落在门水平优势菌群分别为酸杆菌门(Acidobacteria,41.37%)、变形菌门(Proteobacteria,28.78%)、放线菌门(Actinobacteria,8.9%)、绿弯菌门(Chloroflexi,4.26%)、疣微菌门(Verrucomicrobia,4.04%)等。
2.4 土壤细菌群落与环境因子冗余分析
通过RDA冗余分析发现,3种林分土壤细菌群落组成与土壤环境因子之间存在显著关联,第一排序轴的特征值高达32.63%,第二排序轴的特征值达7.75%,前两轴的累计解释变量占总特征值的40.38%。RDA冗余分析可以很好地反映土壤细菌群落与环境因子直接关系的相关性。研究表明,土沉香林的样本点分布十分稀疏,表明不同林分的土壤细菌群落结构存在显著差异,且这种差异受土壤理化特征的显著影响。马占相思林的样本点密集,说明不同样地土壤细菌群落结构基本相似且受土壤理化性质影响较小。研究发现,形菌群和浮霉菌群与速效钾、有效磷及全磷呈显著正相关。酸杆菌门与土壤pH、有效磷和速效钾呈极显著负相关;绿弯菌门与有机质和全氮之间呈显著负相关。
3 讨 论
3.1 不同恢复模式林分土壤细菌群落组成
不同植被类型会影响土壤细菌群落类型和组成,细菌作为植物与土壤之间的媒介,使其互相适应,共同生长发育[3]。本研究发现,酸杆菌门、变形菌门及放线菌门是本研究区域的主要优势菌群。与杨虎等[9]对宁夏南部生态移民迁出区土壤微生物组成的研究结果类似,不同恢复模式下的细菌相对丰度并不一样,说明不同植被类型对土壤中细菌数量有一定影响。其原因可能是不同恢复模式土壤养分不同,因此会形成不同的微生物群落且微生物量也不同[10]。土沉香林土壤pH 6.25,表明该林地土壤属于弱酸性,酸杆菌门为主要优势菌群。这与郑威等[11]的研究结果一致。高温土壤环境利于放线菌门的生长发育[12],本研究采样时间为夏季,土壤养分丰富,为土壤中放线菌门提供适合生长发育的水热条件。变形菌门在土壤中最活跃且最丰富,在3种林分土壤中,土沉香林土壤变形菌门相对丰度高于其余2种林分,可能是由于土沉香林土壤为其提供一个适合变形菌门的生长环境。马占相思林土壤放线菌群相对丰度比其余2种林分高,可能是由于马占相思林植被生长在较为空旷的山地,树与树之间的距离较远,郁闭度较低,导致阳光直射在土壤表层,形成高温干旱的环境。绿弯菌门属于自养型细菌,可以生活在各种复杂的环境中,这可能是导致土壤中绿弯菌门丰度高的原因之一,也有可能是因为土壤基底性质对土壤细菌群落结构的影响较大,从而导致该地区土壤中绿弯菌门数量远远大于其余2种土壤[13]。
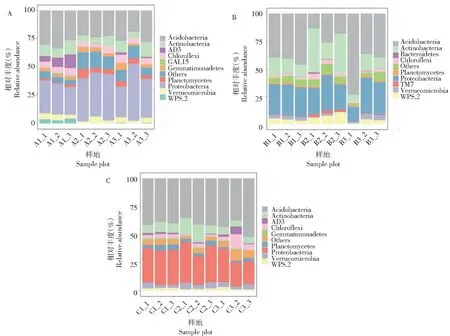
图4 门水平土壤细菌群落分布A(土沉香林)、B(马占相思林)和C(次生林)

A.土沉香林;B.马占相思林;C.次生林;V1.Others; V7.Acidobacteria; V8.Actinobacteria; V15.Chloroflexi; V26.Gemmatimonadetes;V33.Planctomycetes;V34.Proteobacteria; V41.Verrucomicrobia; V42.WPS-2; SOM.有机质;TK.全钾; NN.水解性氮; TN.全氮;TP.全磷;AK.速效钾; AP.有效磷; EC.电导率;pH.酸碱度。
3.2 不同恢复模式土壤理化性质与土壤细菌群落的关系
土壤理化性质影响土壤细菌群落组成结构及多样性。反之,土壤细菌群落又能有效改变土壤的肥力特征,并且能够有效降低土壤中的有害元素[14]。RDA冗余分析发现,酸杆菌门与土壤pH、有效磷和速效钾呈极显著负相关,酸杆菌属于寡营养,在嗜酸环境生长,植被根系交错盘踞在土壤中,分泌出大量有机酸,为酸杆菌群提供适合生长发育的环境[15-16]。变形菌群和浮霉菌群与速效钾、有效磷及全磷呈显著正相关,这与杜昊楠等[17]研究结果相似。
4 结 论
不同林分土壤中,变形菌门、放线菌门和酸杆菌门为土壤细菌的优势菌群但相对丰度不同。不同林分土壤细菌群落多样性有差异,通过α多样性分析,次生林土壤细菌群落 Chao1 指数最高,但3种林分土壤细菌群落Chao1指数无显著差异(P>0.05)。土沉香林土壤细菌群落Shannon 指数均显著高于马占相思林与次生林(P<0.05),说明土沉香林土壤中细菌群落种类多于其余两种林分类型。β多样性分析显示,土沉香林土壤细菌群落与马占相思林土壤细菌群落有差异。变形菌群和浮霉菌群与速效钾、有效磷及全磷呈显著正相关。酸杆菌门与土壤pH、有效磷和速效钾呈极显著负相关。
土壤特性与土壤细菌群落之间互惠共生,相互适应生长,不同恢复模式下的措施不仅在宏观上改变了不同植被类型与土壤之间的关系,而且从微观上也改变了土壤内微环境,从而改变土壤细菌群落结构及其组成成分。不同恢复模式下的土壤细菌群落优势种基本相同,但其余细菌丰度均不相同,土壤细菌各个群落的功能各不相同,参与土壤内环境能量流动与物质运输等活动越多,该土壤细菌群落的相对丰度也越高。本研究不仅可以了解不同恢复模式下土壤细菌群落的组成和差异,也可以了解土壤中细菌群落对土壤环境变化的适应情况。本研究利用不同植被对土壤环境进行改变,从而为后续选取合适的恢复模式提供理论依据。目前,经过人工恢复绿植后的人工林土壤退化严重、生长力低下,且不同恢复方式下的植被具备的环境条件也不一样,生长发育节律也有差异,后续研究中,在不同时间(比如一年四季土壤的理化性质和土壤细菌群落的动态变化特征)进行研究,通过更长的时间恢复,来判断人工恢复的模式是否优于自然条件恢复模式,因此,通过了解不同恢复方式措施下的林分土壤中细菌差异以及功能显得尤为重要。

