基于Biolog FF技术解析辐射对产黑色素短梗霉代谢活性的影响
朱 静,张志东,唐琦勇,顾美英
(新疆农业科学院微生物应用研究所/新疆特殊环境微生物重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】电离辐射(ionizing radiation, IR)可作用于生物大分子,产生辐射化学效应,如电离、产生自由基、核酸损伤等,对生物体产生损害[1]。生物体在进化过程中产生了各种应对辐射的生存策略,可最大程度地减少辐射对生物体基础代谢机制的损害,并对其进行修复。在辐射区微生物研究过程中,真菌被发现是富集放射性物质的重要生物[2-4]。在放射性的胁迫下,真菌表现出极强的辐射耐受性和高度差异的基因组结构[5],以及特殊的外观和营养需求[4],并产生丰富的次级代谢产物,如色素、酶、多糖等。分析辐射对短梗霉代谢活动的影响,对研究真菌辐射机理机制有重要意义。【前人研究进展】短梗霉属(Aureobasidium)是一种具有酵母型和菌丝型形态的多形真菌,其厚垣孢子积累黑色素[6],可抵抗紫外线、高渗胁迫及重金属毒害等多种逆境[7,8],还可作为单细胞蛋白、细胞壁多糖、胞外多糖、果胶酶、色素等的生产菌株[9]。Biolog微生物自动分析系统是一套微生物碳源代谢和鉴定的分析系统,采用不同鉴定分析板,可鉴定和分析包括细菌、酵母、丝状真菌在内的近2 000 种微生物以及环境微生物群落多样性[10,11]。其中,Biolog FF MicroPlate (Biolog, Hayward, CA, USA)可用于丝状真菌鉴定,并也被用于环境中真菌群落的碳源代谢多样性分析。Biolog FF MicroPlate使用95个碳源来测定微生物的底物利用率和表型谱,每个孔中包含的底物随着代谢活性而变化颜色。95种碳源可归纳为六类碳源,以分析样品对不同类型碳源的利用情况。其中,碳水化合物类(Carbohydrates)44种、氨基酸类(Amino acids)13种、羧酸类(Acids)17种、胺类(Amines)6种、聚合物类(Polymers)5种、其他(others)10种[12]。课题组在前期研究中获得多株短梗霉[13],该菌株不但具有高剂量辐射(60Co γ射线 15 kGy)耐受能力,还具有极强的耐UV辐射和耐多种重金属的能力。菌株生长过程中还大量产生可溶性黑色素,可有效的提高微生物在紫外照射下的存活率,证明其具有良好的紫外辐射保护作用[14]。【本研究切入点】目前对这类菌株在辐射胁迫下生长代谢活性变化,及其蕴含的应激机制和耐辐射机理研究国内外鲜见报道。需分析辐射对短梗霉代谢活性的影响,研究真菌耐辐射机理机制。【拟解决的关键问题】从新疆辐射污染土样中, 分离筛选出一株黑色酵母状真菌MF1,观察菌落形态和菌丝特征,分析系统发育并进行鉴定。设置不同的60Co γ辐射剂量辐射试验,采用 Biolog FF技术检测分析辐射后菌株碳源的利用程度,并根据单孔平均颜色变化率(AWCD),分析辐射对菌株代谢活性的影响,为解析耐辐射真菌的辐射适应机理及其开发应用提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 菌 种
该菌株分离自新疆某辐射污染环境地表5~20 cm土壤,取采集的土样1.0 g分装于15 mm×150 mm无菌试管中,置于60Co γ射线下进行10 kGy 剂量辐照处理,向试管中加入5 mL液体查氏培养基,28℃振荡富集3 d。取1 mL上述富集液移入装有9 mL无菌生理水的试管中,依次进行梯度稀释后,取0.2 mL稀释液涂布于查氏培养基平板上,于28℃恒温条件下培养7 d,观察菌落生长情况,挑取单菌落进行纯化。
1.1.2 培养基
MEA培养基:麦芽浸粉 30 g,大豆蛋白胨 3 g,纯净水1 000 mL。
查氏培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,蔗糖 30 g,琼脂糖 16 g,纯净水1 000 mL。
1.1.3 主要仪器与设备
SW-CJ-2F超净工作台,上海博迅实业有限公司;HHW.21.600电热恒温水浴箱,北京永光明医疗仪器厂;fcycler 96孔PCR反应仪,Bio-Rad公司;DYY-6C型电泳仪,北京六一仪器厂;GEL Doc2000凝胶成像分析仪,Bio-Rad公司;Biolog FF接种培养板、FF-IF接种液、Biolog Microsoft 全自动微生物鉴定分析系统(型号 MICROSTATION),美国Biolog公司;PL203电子天平,梅特勒-托利多仪器(上海)有限公司;SPX-150B生化培养箱,宁波东南仪器有限公司;HZQ-F160 全温振荡培养箱,哈尔滨东联电子技术开发有限公司;Eppendorf 5424离心机,德国 Eppendorf股份公司;UV-2550 紫外分光光度计,日本岛津仪器(上海)有限公司。
1.2 方 法
1.2.1 LSU rDNA D1/D2 区的 PCR 扩增
将新鲜菌株接种于液体 MEA 培养基,于28℃恒温条件下培养4 d,离心收集菌体,使用TE洗涤3遍。菌体经液氮研磨后,DNA 提取参照Gerrits等[15]方法,DNA经70%乙醇洗涤后自然干燥,加入50 μL无菌的双蒸水,4℃下溶解2 h,-20℃保存备用。LSU rDNA D1/D2区的PCR扩增采用真菌通用引物NL1:5’-GCATATCGGTAAGCGGAGGAAAAG-3’,NL4:5’-GGTCCGTGTTTCAAGACGG-3’。扩增条件为:95℃ 5 min;94℃ 1 min,52℃ 1 min,72℃ 2 min,共35个循环;72℃10 min[16]。PCR 产物经切胶纯化(上海华舜生物技术公司胶回收试剂盒)回收,加去离子水溶解,送北京鼎国昌盛生物技术有限责任公司测序。
1.2.2 系统进化树的构建
将实验菌株所得的LSU rDNA D1/D2区序列与GenBank数据库中的已知序列进行 BLAST 比较,确定与实验菌株亲缘关系最近的种属。从数据库获得相关种属的序列,并结合真菌生物多样性研究中心数据库(http://www.cbs.knaw.nl/databases/)的标准模式菌序列, 利用MEGA 7.0软件包[17,18]采用邻接法(Neighbor-Joining method)进行聚类分析和系统进化树构建,确定菌种生物学分类地位。
1.2.3 菌株生长及辐射试验
将新鲜培养的试验菌株接种到MEA 液体培养基中,30℃振荡培养3 d后,5 000 r/min 离心收集菌体,用0.05 mol/L磷酸缓冲液(pH 7.2)洗涤菌体3次,并调整至浓度OD600为 1.0左右。取上述菌悬液5 mL装至15 mm×150 mm无菌试管中,送至中国科学院新疆地理生态研究所辐射中心,置于60Co γ射线(剂量率100 Gy/min)进行不同剂量照射。取辐照处理后的菌液1mL进行梯度稀释后,取0.2 mL稀释液涂布于MEA琼脂培养基平板上,置28℃恒温培养,观察记录菌落数,并计算存活率。以D.radioduransR1(DR)和E.coli作为对照菌株,绘制耐辐射曲线。根据耐辐射曲线结果,用上述方法制备菌悬液5 mL,分别在60Co γ射线辐射0 Gy(作为空白对照),2 500 Gy,5 000 Gy,10 000 Gy剂量下进行辐射。辐射完成后,立即用冰盒带回实验室处理。
1.2.4 菌悬液制备及Biolog FF培养
使用移液枪,将辐照后的样品原液逐滴加入到FF-IF接种液中,充分混匀,并将浓度控制在75%±2%。将接种液倒入无菌平皿或V型槽,用移液器在Biolog FF板每个孔中加入100 μL菌悬液,盖上盖子,控制湿度,30℃ 恒温静置培养。
1.3 数据处理
Biolog FF板30℃恒温静置培养,每隔24 h放置到Biolog菌种鉴定仪上,读取不同孔的OD590值。其中,Biolog FF板孔中平均吸光值(Average well color development,AWCD) 用于描述菌株利用碳源的平均活性,计算公式如下:
AWCD= (Ci-R)/n.
式中,Ci为每个有培养基孔的吸光值,R为对照孔的吸光值,n为培养基孔数,Biolog FF板n值为95[19]。
数据统计及分析采用Biolog自动分析系统、Excel及Graph Prism7.0软件[20]。
2 结果与分析
2.1 菌株的鉴定
2.1.1 菌株的形态特征
研究表明,菌株MF1可在4~30℃正常生长,最佳培养温度28℃,可耐受15% NaCl。在查氏培养基28℃培养条件下,菌落初期均为酵母样,灰白色,菌落后期真菌菌丝体嵌入培养基,培养2 d后菌落转暗为黑色或棕黑色,凸起,菌落边缘有或无菌丝体嵌入培养基。培养7 d后,菌落大小为0.2~1.0 cm;其最适生长温度为28℃,最适初始生长pH为6.0。显微观察,营养菌丝透明,光滑,薄壁,有横隔,培养中后期转换为黑色菌丝。分生孢子透明至黑褐色。透明分生孢子单细胞,光滑,椭圆形,(4.5~10) μm×(3.0~10) μm。 图1,图2
图1 菌株MF1菌落形态

注:查氏培养基28℃培养7 d,Olympus BX43 显微镜40倍观测
2.1.2 菌株的分子鉴定
研究表明,实验菌株为Aureobasidium属,MF1(557 bp, 基因序列号OK083625)与A.melanogenumCBS 105.22T和 CBS 621.80T聚在一个分支中,支持率为70%,最大同源性99.5%。图3
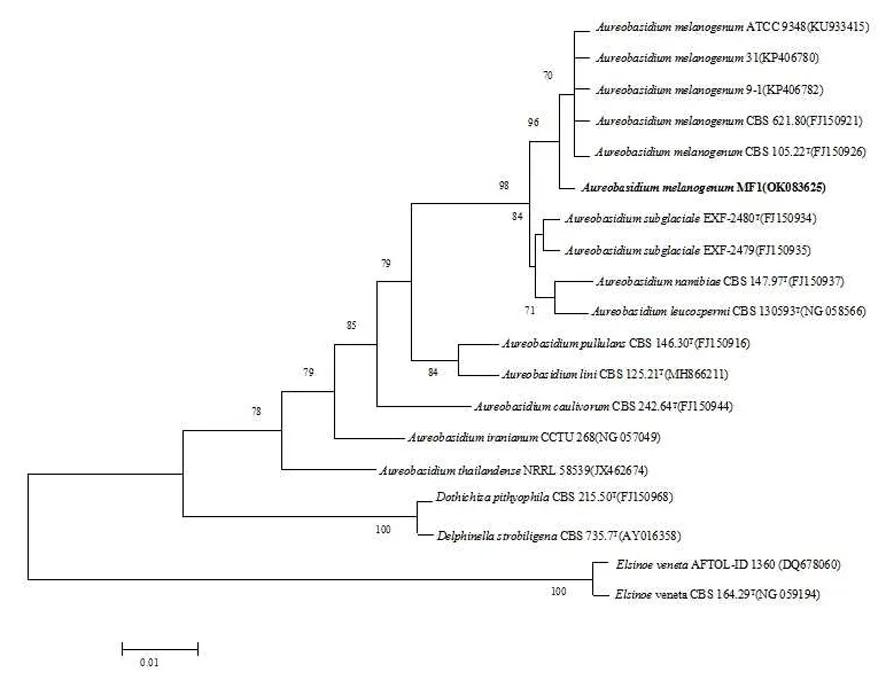
图3 菌株MF1的系统进化树
2.1.3 菌株的耐辐射特性
研究表明,在辐射剂量为5 000 Gy时,MF1和D.radioduransR1的存活率几乎为100%。当辐射剂量达到10 000 Gy时,2株菌的存活率依然有20%。然而,大肠杆菌细胞在接近5 000的辐射剂量时已基本死亡。辐射剂量达到15 kGy时,菌株MF1依然有细胞存活,表现出与D.radioduransR1相似的抗辐射能力。菌株MF1对60Co γ辐射同样具有较强的抗性。图4
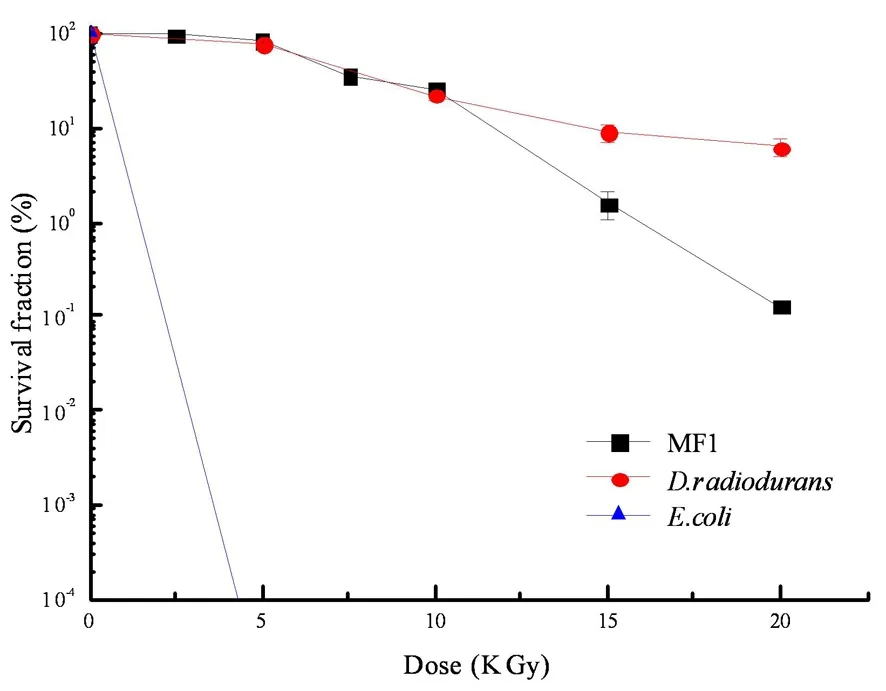
图4 菌株MF1的辐射存活曲线
2.1.4 菌株的碳源利用
研究表明,得到菌株在培养0~144 h代谢95种碳源的丰度指数。菌株在72 h时利用碳源种类最多,共46种,从而确定其可利用D-阿拉伯醇、熊果苷、D-纤维二糖、吐温80、D-阿拉伯糖、L-阿拉伯糖、糊精、赤藻糖醇、D-果糖、D-半乳糖醛酸、龙胆二糖、a-D-葡萄糖、D-葡萄醛酸、丙三醇、肝糖、麦芽糖、麦芽三糖、D-甘露醇、D-甘露糖、D-松三糖、ß-甲基-D-葡萄糖苷、6-O-D-吡喃葡萄糖酰-D-呋喃果糖、D-阿洛酮糖、D-蜜三糖、L-鼠李糖、D-核糖、水杨苷、水苏糖、蔗糖、D-海藻糖、D-木糖、溴代琥珀酸、反丁烯二酸、y-羟基丁酸、a-酮戊二酸、苹果酸、奎尼酸、琥珀酰胺酸、琥珀酸、琥珀酸甲基酯、L-丙胺酸、L-天冬酰胺、L-天冬氨酸、L-谷氨酸、脯氨酸、焦谷氨酸作为唯一碳源。图5

图5 菌株碳源利用丰度指数变化
将菌株利用的碳源按Biolog FF板碳源的归类,又可将其利用的碳源分为碳水化合物类24种、氨基酸类6种、羧酸类8种、胺类1种、聚合物类3种、其他4种。图6

图6 菌株利用的碳源类型
2.2 不同辐射剂量下菌株代谢活性
研究表明,在对照菌株中,随培养时间增加,AWCD值增高,96~168 h趋于平稳,144 h基本达到最大。不同辐射剂量下菌株AWCD值也呈现相同趋势。其中,在2 500 Gy辐照下,细胞代谢活性与对照组比较接近,分别为0.235 7和0.162 8;当辐射大于5 000 Gy时,细胞代谢活性急速下降为0.078 2,低于对照组的50%;当辐射达到10 000 Gy时,细胞代谢活性只有0.016 2,仅为对照组的6%左右。在低剂量辐射作用下,菌株的生长和代谢受到的影响较小,但当辐射剂量大于5 000 Gy,细胞生长速率及代谢活性开始大幅下降,而当辐射剂量达到10 000 Gy时,细胞生长近乎停滞状态,代谢活性极低。图7
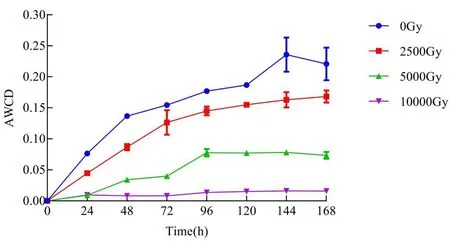
图7 不同辐射剂量下菌株AWCD值变化
2.3 不同辐射剂量下菌株对碳源种类利用
研究表明,菌株对于6大碳源种类的利用存在明显差异。随着辐射剂量的上升,碳水化合物利用率呈上升趋势,而羧酸类和氨基酸的利用呈下降趋势。其他几类碳源的利用率基本持平,但在10 000 Gy的辐射下,除了碳水化合物,其他碳源的利用率均为0。图8

图8 不同辐射剂量下菌株对不同类型碳源利用
4个辐射剂量下利用率最高的10种碳源共涉及22种。其中,对碳水化合物的利用种类最多,共11种,占总数的50%;氨基酸2种,占9%;羧酸类4种,占18%,聚合物只有1种,占5%,以及其他碳源4种,占18% 。表1
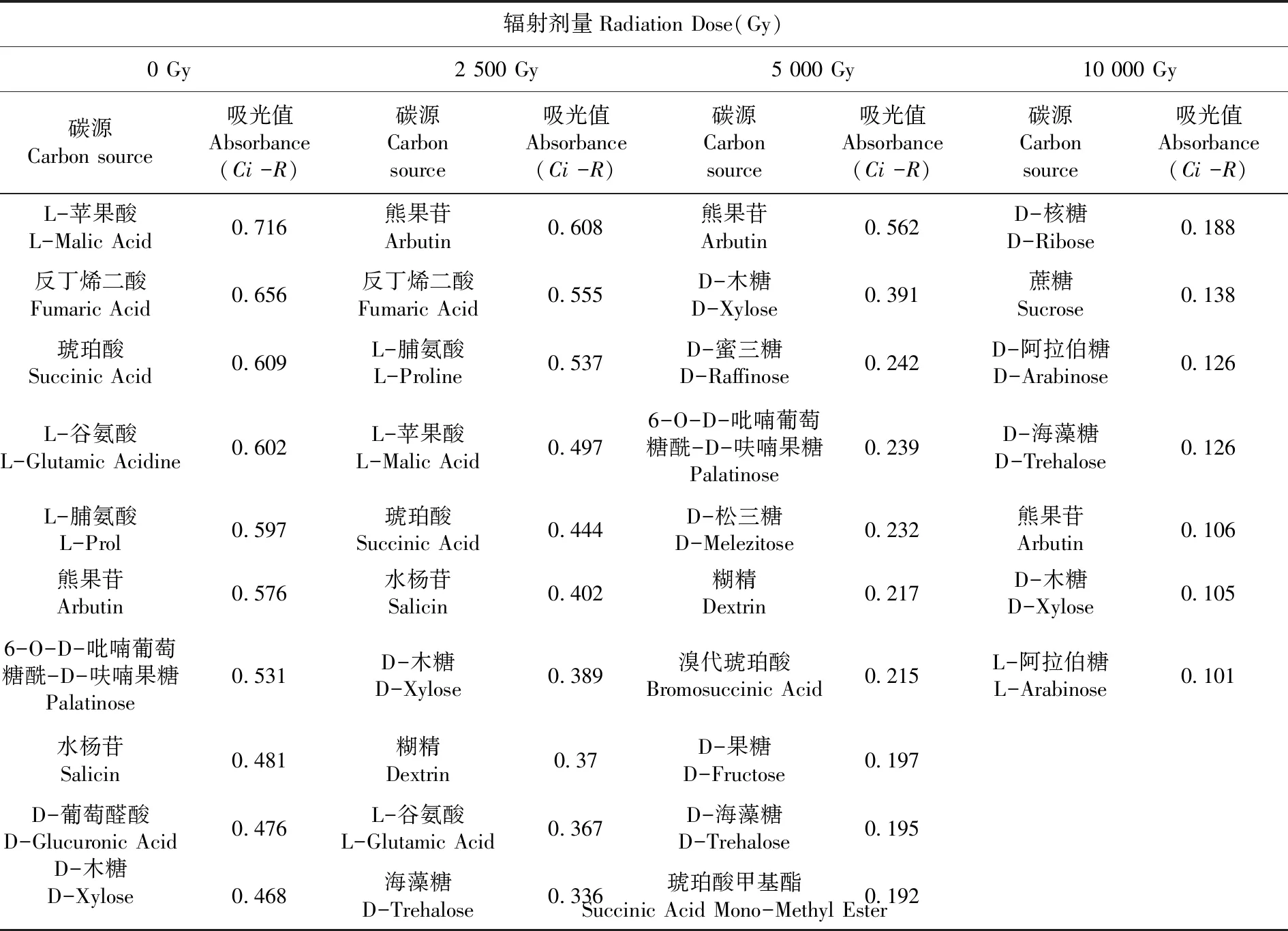
表1 不同辐射剂量下菌株利用最多的10种碳源
2.4 不同辐射剂量下菌株对碳源利用的变化
研究表明,一些碳源在不同辐射强度下均被利用,如熊果苷、D-木糖、D-海藻糖。而一些碳源随着辐射强度的增大,就不再被细胞大量利用,如反丁烯二酸、 L-脯氨酸、水杨苷、L-苹果酸、琥珀酸、L-谷氨酸。该部分碳源在辐射剂量达到5 000 Gy及以上时,利用率显著下降。D-核糖、蔗糖、D-阿拉伯糖、L-阿拉伯糖在低辐射剂量时并未被大量利用,而在10 000 Gy照射下利用率显著提高,这提示在高辐射条件下细胞为适应极端条件,开始大量利用这部分碳源以维持存活。
共有7种碳源随辐射强度升高,利用率显著增加,全部为碳水化合物:D-阿拉伯糖、L-阿拉伯糖、D-核糖、蔗糖、D-海藻糖、D-木糖、熊果苷。
3 讨 论
杨永华等[21]发现10~50 Gy低剂量的X-射线和γ射线有促进真菌孢子萌发和菌丝生长的作用,Tuga等[22]指出真菌在放射性环境下出现了趋放射性(radiotropism)和放射刺激作用(radiostimulation)。项目组先后从新疆辐射污染土样中获得耐辐射菌1000多株,包括细菌、放线菌、真菌等。其中,酵母、丝状真菌100余株,分类鉴定归属于15个属[23,24],其中多个属此前无相关耐辐射特性报道。
在白垩纪早期的沉积层中出现了许多真菌化石黑化现象,而同一时期许多动植物的灭绝也基本归因于遭受宇宙辐射[25,26]。黑色素可增强微生物在各类极端环境中生存,包括高海拔地区,北极和南极地区[27]。在美国内华达试验场、布鲁克海文国家慢性辐射实验室都分离到产黑色素真菌。一些产黑色素真菌物种定殖在切尔诺贝利反应堆损坏的墙壁上,核反应堆冷却池也被产黑色素微生物污染[28,29]。在以色列螺旋谷,紫外辐射强烈的南坡黑曲霉孢子中黑色素含量是阴凉北坡的3倍 (南坡日照是北坡的2~8倍)[30]。一些产黑色素真菌不仅是抗辐射的,慢性亚致死辐射条件还能刺激它的增殖[31]。黑色素具有保护真菌免受辐射损伤的功能,使其能在放射环境中成为优势种群。
短梗霉(Aureobasidium)是一种具有酵母型和菌丝型形态的多形真菌,其厚垣孢子积累黑色素,可抵抗紫外线、高渗胁迫及重金属毒害等多种逆境[8,9,13]。项目组通过对该属菌株的研究发现,该菌可大量产生可溶性黑色素,最高发酵产量可达1.0 g/L以上[14]。黑色素可有效的提高菌株在紫外照射下的存活率,证明其具有良好的紫外辐射保护作用[8]。目前,国内外对短梗霉的研究主要集中在与生产普鲁兰多糖相关的内容[32-34],以及单细胞蛋白、细胞壁多糖、胞外多糖、果胶酶、色素等的生产相关研究[35]。而该菌株较强的耐辐射能力是否与其代谢过程及代谢产物相关,以及其耐辐射机理尚未有研究报道。
Biolog-FF 微孔板除了用于检测多种丝状真菌的碳源利用情况,并对真菌种类进行鉴定外,该技术还可以对环境中真菌群落的特性及代谢情况进行分析[36]。试验中,当辐射剂量小于5 000 Gy时,细胞存活率以及细胞代谢活性与对照组没有显著差异,在该剂量的辐射作用下,菌株的生长和代谢受到的影响较小,但当辐射剂量大于5 000 Gy,细胞生长速率及代谢活性开始大幅下降,以细胞生长的稳定期96 h为例,辐射剂量为5 000 Gy时,AWCD值约为对照组的1/2;当辐射剂量达到10 000 Gy时,细胞存活率约为20%,AWCD值不足对照组的1/10,代谢活性极低。使用Biolog-FF微孔板可以直观简易的反映出细胞对碳源利用的变化。例如,D-核糖、蔗糖、D-阿拉伯糖、L-阿拉伯糖在低辐射剂量时并未被大量利用,但在高剂量照射下利用率显著上升。在95种碳源中,共有17种碳源表现出类似的趋势。在高剂量辐射下碳源利用类型会发生明显的改变,可能是该菌辐射应激和适应的一种有效机制。
目前,以耐辐射奇球菌为代表对微生物抗辐射作用进行的研究表明,在辐射的损伤作用下,细胞会启动应激机制并进行自我修复,包括通过抗氧化酶清除自由基,DNA和蛋白质的修复等[37]。试验中,辐射导致碳水化合物、胺类的利用率上升。胺类存在于所有生物细胞内,并随细胞增殖、分化而作相应的变化,胺类可通过直接与DNA相互作用调节DNA构象和参与RNA及蛋白质的合成[38]。而碳水化合物是生命细胞结构的主要成分及主要供能物质,有调节细胞活动的重要功能。碳源最有用的利用方式是糖,他们可能在生存中起关键作用。三羧酸循环(TCA)是葡萄糖,脂质和氨基酸最终的代谢途径。在汪汉成等[39]利用灰葡萄孢杀菌剂对烟草灰霉病菌代谢活性的研究中,当杀菌剂啶酰菌胺的浓度升高,TCA中的新陈代谢被抑制,包括溴丁二酸、富马酸、α-酮戊二酸、D-苹果酸、L-苹果酸、奎尼酸、琥珀酰胺酸、琥珀酸、L-丙氨酰胺、L-丙氨酸、L-天冬氨酸、L-谷氨酸、L-苯丙氨酸、L-脯氨酸、L-焦谷氨酸、L-丝氨酸、L-苏氨酸和腐胺。但当TCA中这些底物的代谢受到抑制,磷酸戊糖途径(PPP)中的某些碳源仍然可以使用,并且代谢不受抑制,包括D-阿拉伯糖、L-阿拉伯糖、D-核糖和D-木糖。研究中,D-核糖、 蔗糖、D-阿拉伯糖、L-阿拉伯糖,在高剂量照射下利用率显示出明显优势,另有17种碳源表现出相同的趋势,包括D-阿拉伯糖、L-阿拉伯糖、D-木糖等。TCA不是葡萄糖代谢的唯一途径。当TCA被抑制时,磷酸戊糖途径(PPP)可用于代谢碳水化合物。
4 结 论
不同辐射剂量下菌株AWCD值存在显著差异。随着辐射剂量的升高,细胞代谢活性显著下降。同时,随着辐射剂量的上升,在95种碳源中碳水化合物的利用率呈上升趋势,而羧酸类、氨基酸和其他碳源的利用呈下降趋势。随着辐射剂量增加,菌株对碳源的利用也发生着变化。其中,D-核糖、蔗糖、D-阿拉伯糖、L-阿拉伯糖在低辐射剂量时并未被大量利用,但在高剂量照射下利用率显著上升。在95种碳源中,共有17种碳源表现出类似的趋势。

