母体妊娠期精神压力暴露对子代鼠脑白质超微机构及其认知功能的影响
程 艳,郭建伟,朱 斌,伊敏敏
(1.陕西省人民医院麻醉科,陕西 西安710068;2.陕西省人民医院手术一部,陕西 西安710068)
母体妊娠期精神压力暴露不仅可能造成不良妊娠结局,更可能对子代神经发育及认知功能产生严重的负面影响。大量的实验证明,妊娠期压力暴露可导致不同程度的子代海马结构和功能损伤,包括海马区域的神经元数目减少、锥体神经元顶端树突萎缩、线粒体呼吸酶活性降低及线粒体膜电位降低等[1-7]。脑白质(white matter,WM)主要由成束的有髓鞘或无髓鞘轴突和产生髓鞘的神经胶质细胞组成,WM 占人类总脑容量的近50%,WM 对于跨越不同脑区的电信号传输至关重要,因此WM 损伤可导致严重的神经行为和认知障碍[8,9]。近些年来的研究发现,认知功能与脑白质的发育及其完整性的维持有密切联系,白质的发育及占据白质大部分的有髓神经纤维髓鞘化过程发生于生命早期,恰与认知技能和能力的出现相吻合。因此,有髓神经纤维的形成和完善及WM 完整性的保持在生命早期认知能力的发展中起到重要作用。
本研究拟通过压力束缚SD 大鼠母体妊娠期压力暴露模型,通过对子代鼠行为学及脑白质及其超微结构测定,探究母体妊娠期精神压力暴露是否损害子代鼠认知功能及脑白质超微结构,并探究认知功能改变与脑白质超微结构改变之间的关系,以期为进一步临床干预及治疗策略提供理论依据,具有重要的理论研究价值。
1 材料与方法
1.1 动物实验及其分组
亲代鼠(KM SD 大鼠,购自西安交通大学动物实验中心)分为压力束缚暴露组(PE 组)和对照组(C 组)两组,每组15 只雌性和5 只雄性SD 大鼠,将处女雌性SD 大鼠与雄性SD 大鼠(3∶1)放置过夜进行交配,次日晨检查雌性SD 大鼠阴道涂片,确定涂片为阳性的日期即为胚胎第0 天,然后将怀孕的雌性SD 大鼠分开饲养。压力束缚暴露:妊娠第14~20 天每天3 次暴露与束缚压力下,持续45 min~1 h/次。1 月龄子代鼠进行行为学测试(Morris 水迷宫和Y 迷宫测试)。行为学测试完成后,子代鼠进行4%水合氯醛(300~350 mg/kg,实验室配置)腹腔注射麻醉后,行心脏灌注(生理盐水+4%甲醛,西安赫特生物科技有限公司)固定脑标本,待灌注良好后,取脑置入之前配制好的混合固定液(2%多聚甲醛+2.5%戊二醛,实验室配置)中进行标本固定。将固定好的标本进行电镜包埋,制作电镜切片,使用现代体视学方法计算脑白质总体积、有髓神经纤维总长度及总体积和髓鞘总长度及总体积,以及对髓鞘的内外直径及内外周长进行计算和分析。
1.2 母体妊娠期压力束缚动物模型
约束装置(实验室自制)是一个直径约6.8 cm的透明塑料管带有呼吸孔和封闭端,长度可以调节以适应动物的大小。妊娠SD 大鼠在妊娠第14~20天每天3 次暴露于束缚压力下,持续45 min~1 h,每次压力暴露的时间在时间段内(08:00 am~11:00 am,11:00 am~02:00 pm 和04:00 pm~07:00 pm)随机限制时间[10]。
1.3 子代鼠行为学测试
1.3.1 Morris 水迷宫 实验所用水迷宫仪器(Morris 水迷宫分析系统Smart 软件,中国成都泰盟),水池直径约120 cm,平台直径约8 cm、高约15 cm,平台有效区域直径约10 cm,计算机可根据水池正中心上方的摄像头自动追踪并记录小鼠的游泳过程。实验前将圆形水池划分成4 个象限,然后在每个象限确定一个入水点。在随机一个象限正中放入平台,控制水温在(20.0±2.0)℃。在水中加入二氧化钛染成乳白色且使水面没过平台1 cm 左右以免让动物看清水下平台。实验小鼠的头部均用苦味酸染色以便摄像机捕捉、记录。测试共5 d,分为定位航行试验(前4 d)和空间探索试验(最后一天)两部分。记录定位航行试验中小鼠每次试验的潜伏期(即从小鼠进水到其四肢全部站上平台的时间),若小鼠超过90 s 还没有站上平台,其潜伏期则记为90 s。计算小鼠每天4 次试验的平均潜伏期。记录空间探索试验中小鼠穿越平台有效区域的次数以及其在平台原本所处象限的滞留时间百分比。[11]
1.3.2 Y 迷宫测试 实验所用Y 型迷宫(Y 迷宫分析系统Smart 软件,中国成都泰盟)由灰色有机塑料制成,由3 个臂组成,相邻臂之间的角度为120°,每个臂为8 cm×30 cm×15 cm(宽×长×高),计算机可根据迷宫正中心上方的摄像头自动追踪并记录小鼠的探索过程;随机指定3 个相同的臂:(1)起始臂,小鼠开始探索(始终打开);(2)新颖臂,在第一次试验期间被阻塞,但在第二次试验期间打开;(3)其他臂(始终打开);关闭新颖臂,将小鼠背向迷宫中心置入起始臂中,允许其在起始臂和其他臂中定向探索15 min;定向探索结束1 h 后,打开新颖臂,将小鼠背向迷宫中心置入起始臂中,允许小鼠在3 个臂中自由探索10 min;通过使用安装迷宫正中上方的相机,所有试验都记录在录像机上;随后分析视频记录,并分析新颖臂中的探索距离、探索次数和探索时间。[12-14]
1.4 现代体视学方法测定脑白质及其超微结构
(1)计算子代鼠大脑半球白质的总体积:随机选择沿冠状面的子代鼠脑切片数个,将等距点阵图与切片随机叠加,如图1A 所示,在解剖显微镜(立体显微镜,日本尼康)下计数所有与白质重叠的点∑PWM,计算白质的总体积VWM(公式:VWM=t×a(p)×∑PWM,其中t 为连续切片的厚度,a(p)为与每个网格点相关的面积)[13,15-17];(2)获得电镜照片:从选定的脑切片上获得包含脑白质的组织块,进行电镜包埋,使用透射电镜(H-7650 透射电子显微镜,日本Hitachi)观察电镜切片,每张切片上系统抽样抽取5 个8 000×及10 个15 000×的视野[13];(3)计算白质中有髓纤维的长度密度和总长度:如图1B 所示,将无偏计数框与8 000×电镜照片随机叠加,计算白质中有髓纤维的长度密度LV(mf/wm)(公 式:LV(mf/wm)=2×∑Q(mf)/[a(frame)×∑frame],其中∑Q(mf)是通过无偏计数框计数得出的电镜照片中有髓纤维的总个数,a(frame)为单个无偏计数框的面积,∑frame 为计数框的总个数。)和总长度L(mf,wm)(公式:L(mf,wm)=LV(mf/wm)×VWM)[13,15,18];(4)计算白质中有髓纤维的体积密度和总体积及髓鞘的体积密度和总体积:如图1C 所示,将等距点阵图与8 000×电镜照片随机叠加,计数所有落在白质上的点数∑P(wm)、落在有髓纤维的点数∑P(mf)及落在髓鞘的点数∑P(ms),计算有髓纤维的体积密度VV(mf/wm)(公式:Vv(mf/wm)=∑P(mf)/∑P(wm))、髓鞘的体积密度VV(ms/wm)(公式:Vv(ms/wm)=∑P(ms)/∑P(wm))、有髓纤维的总体积V(mf,wm)(公式:V(mf,wm)=Vv(mf/wm)×VWM)及髓鞘的总体积V(ms,wm)(公式:V(ms,wm)=Vv(ms/wm)×VWM)[13];(5)计算有髓纤维内直径与外直径:如图1D 所示,将无偏计数框与15 000×电镜照片随机叠加,确定落在无偏计数框内的神经纤维断面。通过测量垂直于有髓纤维最长轴的最长轮廓直径来估算有髓纤维的外直径,通过测量垂直于轴突最长轴的最长轮廓直径来估算有髓纤维的内直径,测量内、外直径及计算内、外直径的比值和差值[13,17,19];(6)计算有髓纤维内周长及外周长:如图1E 所示,将无偏计数框及等距平行线与15 000×电镜照片随机叠加,确定落在无偏计数框内的神经纤维断面,计算断面内有髓纤维的内周长或外周长b(ms)(公式:b(ms)=π/2×d×∑I,其中d 为等距平行线间的垂直距离,∑I 为等距平行线与落在无偏计数框内的髓鞘内缘界线或外缘界线交叉的总点数。),进而计算内、外周长的比值和差值[13,16,19]。

图1 脑白质及其超微结构的体视学研究Fig 1 White matter and its ultrastructure calculation
1.5 统计学处理
实验数据使用SPSS23.0 进行统计分析。首先对各组数据进行正态性检验,若满足正态性则用参数检验,若不满足正态性则用非参数检验(秩次检验);参数检验使用独立样本T 检验。P<0.05 时认为差异具有统计学意义。
2 结果
2.1 实验期间亲代鼠及子代鼠体重分析
亲代鼠选取妊娠第0 天、14 天、20 天,子代鼠选取出生第0 天、15 天、30 天,进行体重统计分析。如图2A 所示,亲代鼠妊娠第0 天、14 天、20 天体重:C组 分 别 为 (223.67±10.54)g,(245.87±13.72)g,(251.60±8.86)g,PE 组分别为(226.33±13.14)g,(242.93±10.16)g,(254.2±13.88)g,两组间差异无统计学意义。如图2B 所示,子代鼠出生第0 天、15 天、30 天 体 重:C 组 分 别 为(6.04±0.82)g,(34.88±2.84)g,(73.39±4.62)g,PE 组 分 别 为(6.05±0.76)g,(39.78±2.78)g,(75.19±3.59)g,两组间差异无统计学意义。

图2 两组亲代鼠与子代鼠实验期间体重比较Fig 2 Weight comparison between the two groups of parent mice and offspring mice during the experiment
2.2 母体妊娠期精神压力暴露损害子代鼠认知功能
如图3 所示,在Morris 水迷宫定位航行试验中,C 组 小 鼠4 天 潜 伏 期 分 别 为(57.24±12.84)s,(61.09±12.24)s,(34.48±4.78)s,(23.65±5.53)s,PE 组 小 鼠 潜 伏 期 分 别 为(63.60±8.30)s,(53.55±12.56)s,(65.36±6.59)s,(65.79±6.02)s。第3 天(F=9.72,t=-25.32,P<0.05)与第4 天(F=0.86,t=-34.23,P<0.05),与C 组小鼠相比,PE 组小鼠潜伏期显著性延长。如图4 所示,在Morris 水迷宫空间探索试验中,C 组与PE 组小鼠穿越平台有效区域次数分别为3.39±1.26 次,0.90±0.82次,平台所在象限滞留时间百分比分别为(26.48±4.19)%,(20.33±2.98)%。与C 组小鼠相比,PE 组小鼠穿越平台有效区域次数(F=21.95,t=10.88,P<0.05)和平台所在象限滞留时间百分比显著性减少(F=7.60,t=7.87,P<0.05)。如图5 所示,C 组与PE 组小鼠Y 迷宫新颖臂探索距离分别为(43.59±4.52)cm,(111.86±18.92)cm,探索次数分别为24.78±3.85 次,77.69±9.91 次,探索时间分别为(123.89±14.59)s,(198.07±11.75)s。与C 组小鼠相比,PE 组小鼠Y 迷宫新颖臂探索距离(F=86.79,t=-23.76,P<0.05)、探索次数(F=54.80,t= - 33.57,P<0.05)及 探 索 时 间(F=4.09,t=-26.11,P<0.05)明显增加。

图3 两组子代鼠Morris 水迷宫定位航行试验潜伏期比较Fig 3 Comparison of the time latencies of the Morris water maze positioning navigation test of offspring mice between two groups

图4 两组子代鼠Morris 水迷宫空间探索试验平台所在象限滞留时间百分比和穿越平台有效区域次数比较Fig 4 Comparison of the target zone frequency and percentage of time in target zone of the Morris water space exploration test of offspring mice between two groups

图5 两组子代鼠Y 迷宫探索结果Fig 5 Y-maze exploration results between two groups
2.3 母体妊娠期精神压力暴露损害子代鼠脑白质及其超微结构
如图6 所示,C 组与PE 组小鼠脑白质总体积分别 为(283.2±19.83)mm3,(180.69±6.11)mm3;有髓神经纤维总长度分别为(10 466.87±831.92)mm,(6 091.29±181.08)mm;有髓神经纤维总体积分 别 为(32 079.50±1 091.68)mm3,(30 411.31±965.28)mm3,髓 鞘 总 体 积 分 别 为(8 045.91±153.91)mm3,(6 813.07±58.86)mm3。与C 组小鼠相比,PE 组小鼠脑白质总体积(F=51.40,t=32.13,P<0.05)、有髓神经纤维总长度(F=75.19,t=33.36,P<0.05)、有髓神经纤维总体积(F=0.27,t=7.56,P<0.05))、髓 鞘 总 体 积(F=37.07,t=48.74,P<0.05)明显下降。为了进一步探究有髓神经纤维髓鞘具体变化,对髓鞘内外直径及内外周长进行分析,如表1 所示,与C 组小鼠相比,PE 组小鼠髓鞘内直径(F=21.54,t=17.60,P<0.05)、外直径(F=11.20,t=23.22,P<0.05)明显下降,内周长(F=.39,t=5.62,P<0.05)、外 周 长(F=13.02,t=- 8.12,P<0.05)及 内 外 周 长 差(F=2.87,t=-9.15,P<0.05)明显增加。
表1 两组小鼠大脑半球白质内有髓神经纤维髓鞘的体视学分析结果()Tab 1 Results of stereoscopic analysis of myelin nerve fiber myelin sheath in the white matter of the brain hemispheres between two groups()
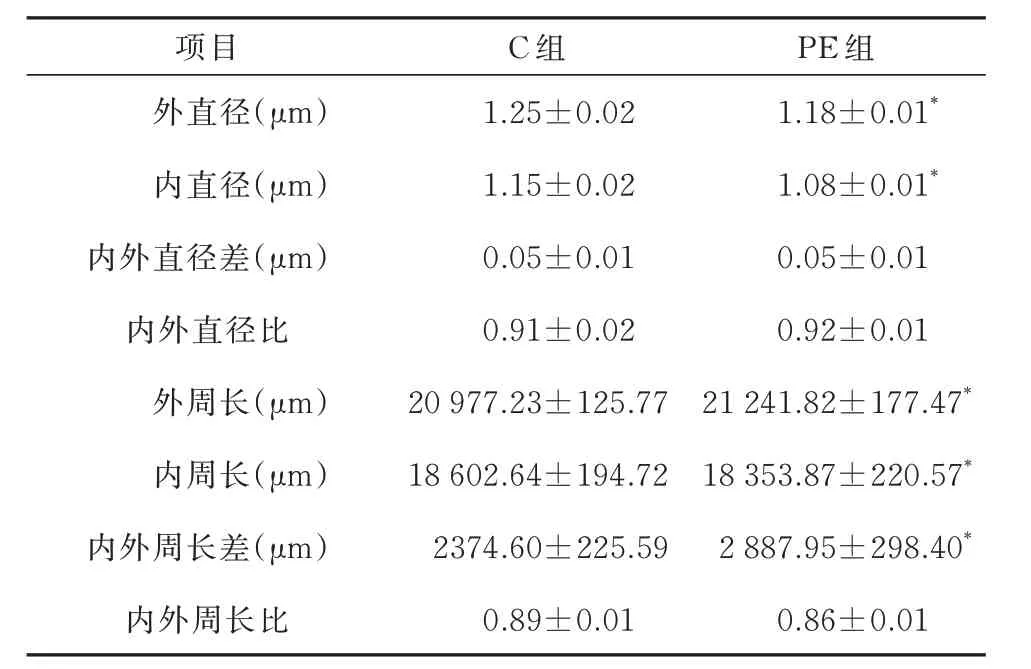
表1 两组小鼠大脑半球白质内有髓神经纤维髓鞘的体视学分析结果()Tab 1 Results of stereoscopic analysis of myelin nerve fiber myelin sheath in the white matter of the brain hemispheres between two groups()
注:与C 组相比,*P<0.05。
项目外直径(μm)内直径(μm)内外直径差(μm)内外直径比外周长(μm)内周长(μm)内外周长差(μm)内外周长比PE 组1.18±0.01*1.08±0.01*0.05±0.01 0.92±0.01 21 241.82±177.47*18 353.87±220.57*2 887.95±298.40*0.86±0.01 C 组1.25±0.02 1.15±0.02 0.05±0.01 0.91±0.02 20 977.23±125.77 18 602.64±194.72 2374.60±225.59 0.89±0.01
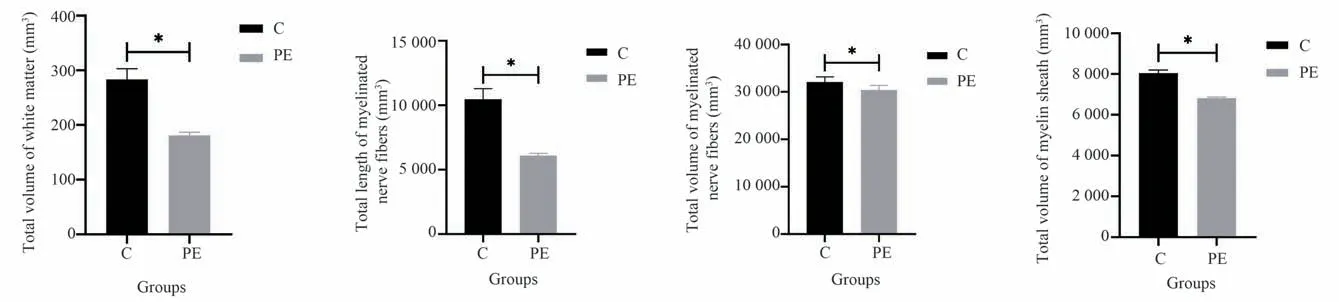
图6 不同实验组大脑白质及其超微结构结果比较Fig 6 Comparison of brain white matter and its ultrastructure between two groups
2.4 脑白质超微结构与子代鼠行为学损害负相关
如图7 所示,脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积与第3 天及第4 天Morris 水迷宫定位航行试验潜伏期、Y 迷宫新颖臂探索距离、探索次数和探索时间与负相关,与Morris 水迷宫空间探索试验平台所在象限滞留时间百分比和穿越平台有效区域次数正相关。

图7 行为学测试结果与脑白质及其超微结构改变相关分析Fig 7 Correlation analysis of behavioral test results & white matter and its ultrastructural changes
3 讨论
压力暴露与大脑损伤及认知功能障碍密切相关[4,20],Sapolsky 等[21]研究发现,压力暴露参与神经系统,特别是边缘系统的可塑性,其提出,严重和/或长期压力削弱海马依赖性显式学习的能力及其基础的可塑性。在动物和人类中均已记录到母体妊娠期压力暴露对胎儿神经发育的负面影响以及长期的情绪和行为障碍[1]。在动物实验中,发现遭受妊娠期压力暴露的子代小鼠杏仁核发育出现差异,表明该暴露可能是子代小鼠出现恐惧相关行为(如焦虑症状)的诱发因素[2];而在恒河猴的怀孕早期和晚期,暴露于产前压力可以抑制胎盘早熟,且在海马齿状回中发现神经发生和海马体积的减少[22];Yang 等[3]发现,妊娠期压力暴露可能会导致子代鼠海马CA1 区长期增强功能受损并长期处于抑制状态,而这种突触可塑性的改变可能与子代鼠空间学习和记忆受损有关。本研究将亲代鼠分为PE 组和C 组,PE 组亲代雌鼠妊娠第14~20 天暴露于束缚压力(3 次/d),持续45 min~1 h/次,对1 月龄子代鼠进行Morris 水迷宫和Y 迷宫测试,Morris 水迷宫检测的被认为是动物的空间参考记忆最为经典的行为学检测方法,Y 迷宫任务是用于测量空间识别记忆的双试验识别测试,研究发现,与C 组相比,PE 组小鼠第3、4 天Morris 水迷宫定位航行试验潜伏期显著延长、空间探索试验平台所在象限滞留时间百分比和穿越平台有效区域次数显著减少,Y迷宫新颖臂探索距离、探索次数及探索时间明显增加,实验结果提示母体妊娠期精神压力暴露损害子代鼠认知功能,研究结果与以往的动物研究发现一致。
人体研究发现,母亲的妊娠期压力暴露与孩子的运动和智力发育延迟以及语言能力较弱之间存在关联。Huizink 等[23]利用Bayley 婴儿发育量表发现,母亲较高的每日烦恼(压力)和焦虑水平都是导致孩子智力低下的独立危险因素,且妊娠中期压力暴露可能是8 个月大婴儿运动和智力发育延迟的决定因素之一,并且可能是以后出现发育问题的危险因素[23];在一项针对加拿大魁北克在严重冰暴中怀孕的妇女的研究发现,母亲经历的客观压力(包括伤害,损失和变化)与Bayley 量表的较低得分以及其2 岁幼儿的语言能力较低有关[24]。在使用动物进行的对照实验中,目前引入的妊娠期精神压力暴露应激因子,包括约束、慢性音译、固定化、隔离、社会压力以及急性感觉或情绪紧张等,其中压力限制(及约束)模型应用最为广泛[10]。因此,本研究应用母体妊娠期压力束缚动物模型发现,母体妊娠期精神压力暴露可明显损害子代鼠认知功能和学习记忆能力,研究结果与以往的动物研究发现一致。如果孕鼠在妊娠期间暴露于重度压力,可能会对胎儿产生负面影响。研究表明,重度压力可以影响孕鼠的生理和行为状态,进而对胎儿的发育产生不良影响,如胎儿发育受限,原因肯能是重度压力可能导致孕鼠体内产生应激激素,如皮质醇,高水平的皮质醇可能穿过胎盘进入胎儿体内,影响其发育,这可能导致胎儿生长受限,出生时体重较轻[25]。孕鼠妊娠期重度压力暴露是指孕鼠在妊娠期间暴露于高强度、长时间的应激刺激。这种应激刺激可以包括各种实验室条件下对孕鼠施加的压力或应激性刺激,如电击、噪音、冷水浸泡等,这些刺激可能导致孕鼠产生生理和行为上的应激反应,进而对孕鼠和胎儿的生理状态和发育产生影响[25,26]。本研究两组间子代鼠出生后体重差异无统计学意义,可能与暴露强度和暴露时间有关,本实验孕期精神束缚压力暴露程度远远低于重度压力暴露。
在受孕后,胎儿的大脑开始形成,随着孕期的进展,胎儿的WM 也逐渐发生变化。WM 是大脑中的一种组织类型,由神经纤维束组成,主要负责传递神经信号。在受孕后的第3 周,神经管开始形成,神经管是胎儿中枢神经系统的前体,最终发展成脑和脊髓,WM 的基础结构开始形成;在受孕后的第6~12 周,神经细胞开始从胎儿的脑室区域迁移到其他区域,这个过程是大脑皮层形成的关键步骤,也是WM 发展的关键阶段;在受孕后的第12 周后,神经细胞开始形成髓鞘,这是一种覆盖神经纤维的脂质层,髓鞘对于神经信号的传导非常重要,它增强了神经冲动的传递速度,这个过程对WM 的发展至关重要;在胎儿发育的后期阶段,神经细胞的连接增加,并且神经元进一步分化,这些神经元之间的连接形成了复杂的神经网络,支持各种认知和运动功能[27,28]。当脂质髓鞘形成在神经元轴突周围时,其作用是增加电脉冲的传导速度,从而改善大脑的连通性,髓鞘化在整个儿童早期(生命的前5年)迅速发展。这种个体发生模式受到神经活动的严格调控,并且与认知技能和能力的出现相吻合,有髓神经纤维的形成和完善及WM 完整性的保持在婴幼儿认知能力的发展中起到重要作用[9,29]。本研究发现,与C 组相比,PE 组小鼠脑白质总体积、有髓神经纤维总长度及总体积、髓鞘总体积明显下降,对有髓神经纤维的内外直径及内外周长的进一步分析发现,PE 组子代小鼠髓鞘内外直径明显下降,内周长明显下降而外周长明显增加,提示生命早期脑白质及其超微结构受损可能与认知功能损害有关,与以往研究一致。本研究对子代鼠行为学测试结果与脑白质及其超微结构改变相关分析发现,脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积与第3 天及第4 天Morris水迷宫定位航行试验潜伏期、Y 迷宫新颖臂探索距离、探索次数和探索时间与负相关,与Morris 水迷宫空间探索试验平台所在象限滞留时间百分比和穿越平台有效区域次数正相关。因此,母体妊娠期精神压力暴露,可能通过损害生命早期脑白质的发展、形成及髓鞘化过程,而损害子代鼠脑白质及其超微结构,并进而降低子代鼠认知功能和学习能力。以往研究虽然提出脑白质的形成、发展及其髓鞘化过程对认知功能可能有重要影响,但未从脑白质超微结构角度进行相关研究,本研究利用现代体视学三维定量测量方法,揭示生命早期脑白质损害与认知功能下降之间的关系,具有创新性和研究价值。
综上所述,母体妊娠期精神压力暴露可损害子代鼠认知功能及脑白质及其超微结构,且认知功能与脑白质间存在相关关系。白质中固有的抗氧化性能可能相对较低[30,31],而富含脂质和蛋白质的髓鞘可以为过氧化反应提供丰富的底物而导致大量ROS 的产生。氧化应激本身可能导致膜完整性破坏,如脂质过氧化可能与滑膜膜中磷脂不对称性的丧失有关[32]。有髓神经纤维髓鞘主要由OLs 构成,有研究发现氧化应激诱导OLs 和OPC 的细胞死亡[33],或抑制少突胶质细胞祖细胞的分化即其破坏OLs 的成熟[34],因此氧化应激可能通过破坏髓鞘结构而影响WM 的传导功能,进而导致学习记忆功能障碍。氧化应激在脑白质损害影响认知功能中有重要作用,但本研究未测定脑内氧化应激水平,后续可进一步研究。
作者贡献度说明:
程艳:参与研究设计、实验设置、数据采集、数据分析和解释以及撰写本文;郭建伟:在解释数据、修改手稿和构思想法方面做出了贡献;朱斌:参与完成动物实验水迷宫和Y 迷宫测试;伊敏敏:参与子代鼠脑白质及其超微结构的计算过程。
所有作者声明不存在利益冲突关系。

