改良自体肝移植治疗儿童肝母细胞瘤1 例并文献复习
董安华,孙延东,王峰,张慧,刘单,吴斌,滕大洪,蔡金贞(青岛大学附属医院儿童器官移植科,山东 青岛 266000)
在儿童中,肝母细胞瘤(hepatoblastoma,HB)被认为是最常见的原发性恶性肿瘤,占所有肝脏肿瘤的50%~60%,占儿童恶性肿瘤总数的1%[1]。该病起病隐匿,诊断时往往缺乏特征性临床表现,部分患儿就诊时已发生转移,预后较差。目前,手术切除是治疗HB 的基石,而巨大肿瘤伴有下腔静脉侵犯难以用常规方式切除。本研究报道1 例应用在体肝切除、肝后下腔静脉置换、自体肝移植手术成功为1 例27 个月大男性患儿切除了伴下腔静脉侵犯的晚期肝母细胞瘤,术后恢复顺利,随访7 个月,各项指标基本正常,现报道如下。
1 病例资料
患儿,男性,27 个月,因“腹部膨隆9 个月,确诊肝母细胞瘤4 个月余”入院。患儿于9 个月前发现腹部膨隆,无腹痛、腹胀,无其他伴随症状,未给予特殊处理,5 个月前腹部膨隆加重,就诊于青岛市妇女儿童医院,行超声检查提示肝右叶占位,9.8 cm×8.4 cm,甲胎蛋白(alpha-fetoprotein,AFP)>0.001 g/L,于2022 年3 月22 日 行 肿 瘤穿刺活检术,提示肝母细胞瘤,后于青岛市妇女儿童医院行6 次化疗,第4、5 次出现骨髓抑制,给予输血治疗,化疗后,腹部膨隆较前未见明显好转,现患儿一般情况尚可,为行肝移植评估就诊于本院门诊,门诊以“肝母细胞瘤”收入本科。入院查体:体温为36.3℃,脉搏为102 次/分,呼吸频率为22 次/分,血压为82/50 mmHg(1 mmHg =0.133 kPa),身高为90 cm,体重为14 kg。腹部膨隆,对称,腹壁静脉无曲张,未见胃肠型及蠕动波,腹软,肝肋下6 cm、剑突下5 cm 可触及,质硬,脾肋下未触及。腹部叩诊:肝上界位于右锁骨中线第四肋间,肝区有叩击痛,无移动性浊音。肠鸣音3 次/ min。未闻及血管杂音。辅助检查:血常规,肝功能、肾功能及血凝常规均无异常,AFP 为0.054 ng/ml,Child-Pugh 评分为5 分,肝功能A 级。上腹部强化CT 及三维重建:肝脏右叶体积增大,内见巨大团块状混杂密度影,最大截面约为108 mm×97 mm,边界不清。肝总体积1395 ml,肝肿瘤体积为757 ml,肿瘤切除后剩余肝体积为638 ml(45.7%)(图1)。
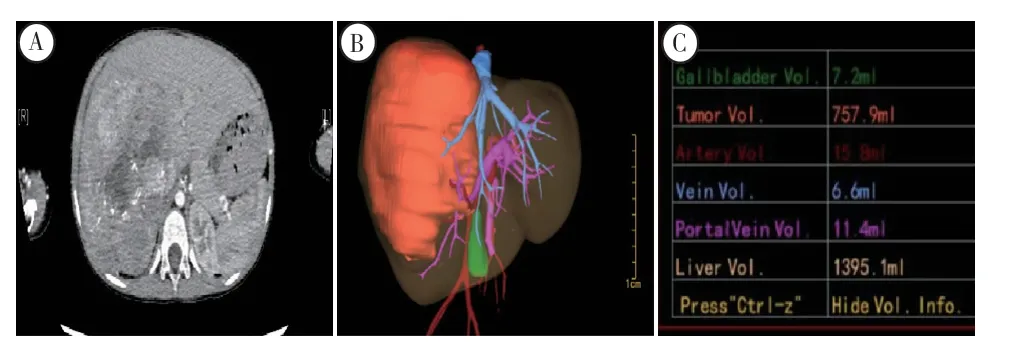
图1 术前CT 及三维重建
2 手术方案
患者平卧位,腰部垫高,常规手术区皮肤消毒,铺无菌洞巾,手术取上腹部“人”字切口,切口长约25 cm。逐步切开皮肤、皮下组织、肌肉各层及腹膜进入腹腔,轻度黏连,探查肝右叶见巨大肿瘤,直径约10 cm,质硬,边界清楚,与下腔静脉边界不清,左半肝颜色红润,质软,未触及肿瘤。决定行自体肝移植术。
游离肝脏脏面及膈面,显露肝脏。轻柔操作并分离解剖第一肝门,肝总动脉直径为0.3 cm,胆道直径为0.3 cm,门静脉直径为0.5 cm。游离第二肝门,分离、显露肝中静脉、肝右静脉。分离第一肝门,顺行切除胆囊。分离、显露肝动脉,分离、显露门静脉主干及左右支。从肝中静脉右侧、胆囊窝、右肝管确立劈离平面。依次钳夹、切断、结扎肝内胆管、血管,将左右半肝完全游离。断左肝管,见金黄色胆汁流出,探查胆总管通畅。于肝总动脉、胃十二指肠动脉分叉处断肝总动脉,断门静脉主干及右支,及肝中、肝左静脉,完整取下左半肝,台下关注UW 液保存,质量为280 g。试阻断下腔静脉后,生命体征平稳,阻断肝上下腔静脉、肝下下腔静脉后完整切除剩余右半肝及肝后下腔静脉、肝尾叶。以髂静脉重建肝后下腔静脉(图2),肝下端端吻合(6-0PDS),肝上下腔静脉后壁吻合(6-0PDS),前壁修整呈倒三角形开口。
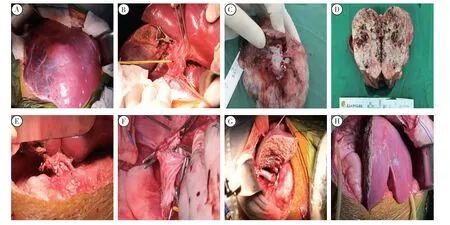
图2 术中肿瘤及血管、胆道吻合情况
修整左半肝,以背驮植入,左半肝肝左、肝中静脉开口修整成型与肝后下腔静使用5-0PDS 做吻合,将门静脉以7-0PDS 线做端端吻合,门静脉开放前放血约10 ml,门静脉吻合完毕后开放。结束无肝期(无肝期时间约43 min),血流开放后,供肝色泽正常,质地柔软。依次检查各吻合口无渗血。受体肝总动脉/胃十二指肠动脉分叉与供肝肝总动脉/胃十二指肠动脉分叉端端缝合,动脉开放后血流好。以7-0PDS 线将左肝管与受体胆总管作端端缝合,未放置T 管。仔细止血,反复检查腹腔内无出血后,于肝断面、肝门、左肝下留置乳胶管3 根引出并固定于腹壁。
3 讨 论
HB 约占肝脏肿瘤的50%~60%,年发病率为(1.2 ~1.5)/100 万,常见于3 岁以下患儿[2]。起病隐匿,通常以腹部肿块、腹痛、腹胀就诊,就诊时已有转移,早期发现及诊断尤为重要。超声检查是一种既简单又方便的检查方法,其次,CT 和MRI 有助于确定肿瘤的位置与肝血管的接近程度[3]。HB 最主要治疗方法是手术切除。然而,HB 患者只有不到50%的肿瘤可以完全切除[4],有些巨大的肿瘤或者和周围血管组织分界不清的肿瘤,可以通过辅助化疗,使肿瘤缩小、变硬,87%的患者可以手术[5-6]。术后有残存肿瘤组织容易复发,复发的患者预后较差[7-8]。因此,如果肿瘤未完全切除,在选择手术治疗时应考虑肝移植作为首要选择[8]。
离体肝切除联合自体肝移植(exvivo liver resection and autotransplantation,ELRA)是指应用肝移植技术将肝脏离体或半离体状态,在持续低温灌注下,将病灶切除,并将剩余的肝脏进行修整,再将自体肝脏原位重新植入体内的一种外科术式。ELRA 优点在于:① 肝脏复杂的占位手术无法切除。② 异体肝移植的供体肝来源短缺[9-10]。③ 异体肝移植术后需用抗排斥药物,抗排斥药物产生很多不良反应。④ 自体肝移植较异体肝移植花费低。有研究报道[11-12],在肝脏肿瘤无法进行根治性手术切除患者中,有约20%患者需要进行肝移植。一项回顾性单中心研究报道[13],肿瘤位置无法完全切除的情况下肝移植可以提高生存率。焦瑒瑒等[14]一项研究报道儿童肝母细胞瘤目前的治疗方式是许多种方法相结合的综合模式,整肝切除与肝移植相结合获得了满意的效果。国家癌症协会美国数据库也显示,无论血管有无侵犯,接受肝移植的HB 患者预后良好[15]。
本病例右半肝巨大肿瘤且肝后下腔静脉受侵犯,常规的手术方法无法将肿瘤完整切除。虽可考虑行同种异体肝移植,但目前肝源紧张,短时间内可能无法获取供肝且术后可能发生免疫排斥反应等并发症。患儿术前评估Child-Pugh 评分为5 分,肝功能A 级,三维重建提示残余肝体积能满足术后患儿的正常生理代谢需要,符合自体肝移植的手术指征及条件。本例患儿采用在体原位劈离的手术方式,相对于全肝离体劈离,能缩短无肝期和冷缺血时间,从而减轻残肝的缺血/再灌注损伤,降低了术后肝功能衰竭的概率。患儿术后恢复顺利,手术效果良好,AFP 明显下降,剩余肝功能良好,术后7 个月内未发生不良事件。
该病例手术技术要求高,复杂程度大,手术时间长且风险高,对肝移植技术、肝脏精准切除、血管重建技术等要求较高,需要在大型且技术成熟的移植中心实施。本例手术的成功实施,给以后类似复杂肝母细胞瘤的治疗提供了参考,然而,自体肝移植对于儿童肝母细胞瘤治疗的长期效果还需进一步的观察和研究。本报道为个案报道,后期我们将收集更多类似病例并做好术后随访工作,积累经验,为临床治疗复杂肝母细胞瘤带来新希望。

