食管鳞癌外周血细胞PD-L1、PD-1及TCF-1 mRNA表达与预后的关系
李林清,程维刚,李孟祥,张升华,郭 苒,朱巧晴,伍当柔,乔 亮,高社干,齐义军
0 引 言
肿瘤的发生发展不仅由肿瘤细胞的固有特征决定,如癌基因激活、肿瘤抑制基因失活,肿瘤微环境中其它多种类型细胞、炎症因子、微生物等也影响着肿瘤发生发展进程[1-2]。肿瘤微环境中浸润的免疫细胞识别、清除肿瘤细胞;反之,肿瘤细胞也能够影响免疫细胞的表型和功能,促进肿瘤细胞免疫逃逸[3-4]。程序性死亡配体-1(programmed death-ligand 1,PD-L1)表达于多种肿瘤细胞和肿瘤浸润免疫细胞,与程序性死亡受体(programmed death-1,PD-1)结合后逃避免疫系统的监视和杀伤[5-6]。抗PD-1(Nivolumab、Pembrolizumab等)或抗PD-L1单克隆抗体(Atezolizumab、Durvalumab、Avelumab等)阻断PD-1/PD-L1结合,能够重新激活机体免疫系统对肿瘤细胞的免疫反应,是近年来免疫治疗的重要手段。抗PD-1/PD-L1免疫检查点治疗的临床疗效与肿瘤细胞、肿瘤微环境中免疫浸润细胞的PD-L1表达密切相关[3,7-9]。此外,肿瘤免疫浸润细胞表达的PD-L1还与Th1型免疫反应、效应T细胞、干扰素γ(interferon γ,IFN γ)等免疫激活相关基因的表达呈正相关[3,7,10]。由此可见,PD-1/PD-L1在肿瘤演进过程中具有双重作用,在不同肿瘤、肿瘤进展不同阶段、肿瘤患者机体不同组织中发挥着促进或抑制肿瘤的作用。TCF-1作为调节T细胞生长的因子,不仅在T细胞的生长发育中起到重要作用,更是作为一个重要的抗肿瘤因子,确保T细胞正常生长,而不发生癌变。有研究表明,TCF-1在早期TeX细胞的生长和发育中起到促进作用,并明确了PD-1和TCF-1有协同作用[3-4]。然而至今未有研究阐明食管鳞癌外周血细胞中PD-L1、PD-1和TCF-1 mRNA表达的关系。
无症状肿瘤患者外周血中,肿瘤自身抗体检出时间可比临床症状或体征提早出现数月至数年,表明早期肿瘤细胞已激活机体免疫系统,产生体液免疫反应[11-13]。应用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者外周血中p53、NY-ESO-1、MMP-7、Hsp70、Prx VI、Bmi-1等6项肿瘤相关抗原的特异性抗体,57%患者外周血中至少检测出1种肿瘤自身抗体;并且这些抗体组合鉴别诊断早期ESCC的敏感性和特异性达到了46%和96%[14]。非小细胞肺癌早期病变中能够检测到肿瘤克隆新抗原特异性PD-L1+CD8+T细胞,表明抗肿瘤免疫反应激活,并且PD-L1+CD8+T细胞富集与抗PD-1/CTLA-4免疫检查点治疗的临床疗效呈正相关[15]。肿瘤患者外周血中PD-1、PD-L1、CD8等免疫反应相关基因表达与乳腺癌、胃癌等多种肿瘤预后相关[16-17]。因此,本研究应用实时定量PCR检测ESCC患者外周血细胞中PD-L1、PD-1和TCF-1 mRNA 表达并分析这3个mRNA分子在ESCC诊断和预测预后的效能。
1 资料与方法
1.1 研究对象回顾性分析2019年1月至2019年12月病理确诊的91例ESCC患者术前外周静脉血标本。其中,男60例、女31例,年龄44~80岁,平均(67.0±7.4)岁。患者临床病理资料通过医院病案管理系统收集,电话随访收集患者生存信息,末次随访时间为2021年2月,总生存期(overall survival,OS)为手术日至患者死亡或末次随访时间。ESCC患者外周血标本于手术日前1 d经肘静脉采集静脉血5 mL,室温静置30 min,以3000 r/min离心5 min分离血细胞和血浆,分装后-80 ℃冰箱保存。另收集63例非癌对照者,其中男27例、女36例,年龄47~86岁,平均(67.0±8.4)岁。所有非癌对照者在外周血采集后随访12个月,排除在此期间确诊的癌患者。根据美国癌症联合会与国际抗癌联盟(AJCC-UICC)制定的第8版食管癌TNM分期标准,对淋巴结转移、TNM进行分期。该研究经河南科技大学第一附属医院医学伦理委员会批准(批准号:2022-03-13050)。
1.2主要试剂反转录试剂HiScript II 1st Strand cDNA Synthesis Kit (R211-01/02)、qRT-PCR试剂AceQ qPCR SYBR Green Master Mix(Q111-02/03)均购自南京诺唯赞生物科技有限公司;Trizol购自北京全式金生物技术有限公司;异丙醇、三氯甲烷和无水酒精均购自上海麦克林生化科技有限公司;DEPC水购自上海吉玛制药有限公司。
1.3研究方法
1.3.1 外周血细胞RNA提取和cDNA反转录于200 μL血细胞中加入800 μL Trizol,提取RNA,NanoDrop Lite 紫外分光光度计测定A260/280值;HiScript II 1 st Strand cDNA Synthesis Kit反转录试剂盒进行反转录合成cDNA。
1.3.2实时定量PCRPD-L1、PD-1、TCF-1和GAPDH引物由生工生物工程有限公司合成。见表1。qPCR使用AceQ qPCR SYBR Green Master Mix (Q111-02/03)试剂盒,反应体系为20 μL,每个样品重复3次。血细胞PD-L1、PD-1和TCF-1 mRNA表达量以GAPDH作为内参基因,用2-ΔΔCt值表示目的基因mRNA的相对表达量。

表1 实时荧光定量PCR所需引物序列
1.4统计学分析应用R4.1.0进行统计学分析。外周血细胞PD-L1、PD-1和TCF-1 mRNA表达差异应用两独立样本t检验,Pearson进行相关性分析,χ2检验进行临床病理特征相关性分析。受试者操作特征(ROC)曲线分析确定最佳界值,曲线下面积(AUC)评估各分子标志物的敏感性和特异性。Cox单因素、多因素比例风险回归模型分析PD-L1、PD-1、TCF-1和临床病理特征对OS影响。Kaplan-Meier绘制生存曲线,log-rank检验确定不同组别生存曲线差异。检验水准α=0.05。
2 结 果
2.1 食管鳞癌患者和非癌对照者外周血细胞PD-L1、PD-1和TCF-1 mRNA表达qRT-PCR检测91例ESCC患者外周血细胞中PD-L1、PD-1和TCF-1 mRNA表达,其相对表达量均值分别为5.75±2.50、6.66±2.70和6.50±2.29,显著高于非癌对照组的4.38±2.25、3.54±1.61和4.45±1.15(P=1.2E-3、P=4.9E-11和P=8.3E-9)。见图1。
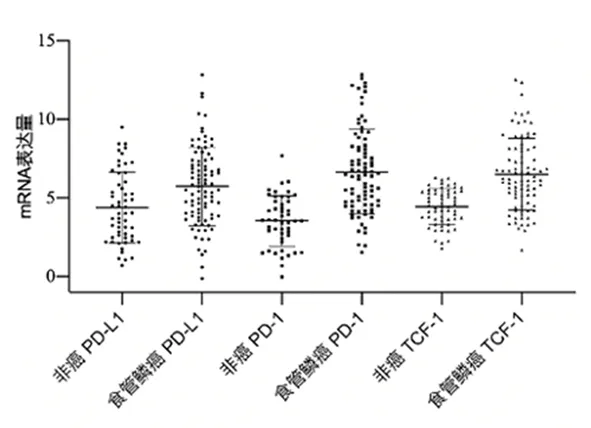
图1 食管鳞癌和非癌对照外周血细胞中PD-L1、PD-1和TCF-1 mRNA表达
2.2外周血细胞PD-L1、PD-1和TCF-1 mRNA表达相关性分析和ROC分析ROC分析确定PD-L1、PD-1和TCF-1 mRNA诊断ESCC的最佳界值分别为4.52、5.42、5.96,其诊断ESCC的敏感性和特异性分别为0.58/0.68、0.92/0.64和0.95/0.58,AUC分别为0.66、0.84和0.78。见图2。Pearson相关性分析结果显示,PD-L1与PD-1相关性系数为0.61,TCF-1和PD-L1、PD-1相关性系数分别为0.62、0.64。见图3。

图2 外周血细胞PD-L1、PD-1和TCF-1诊断食管鳞癌ROC曲线
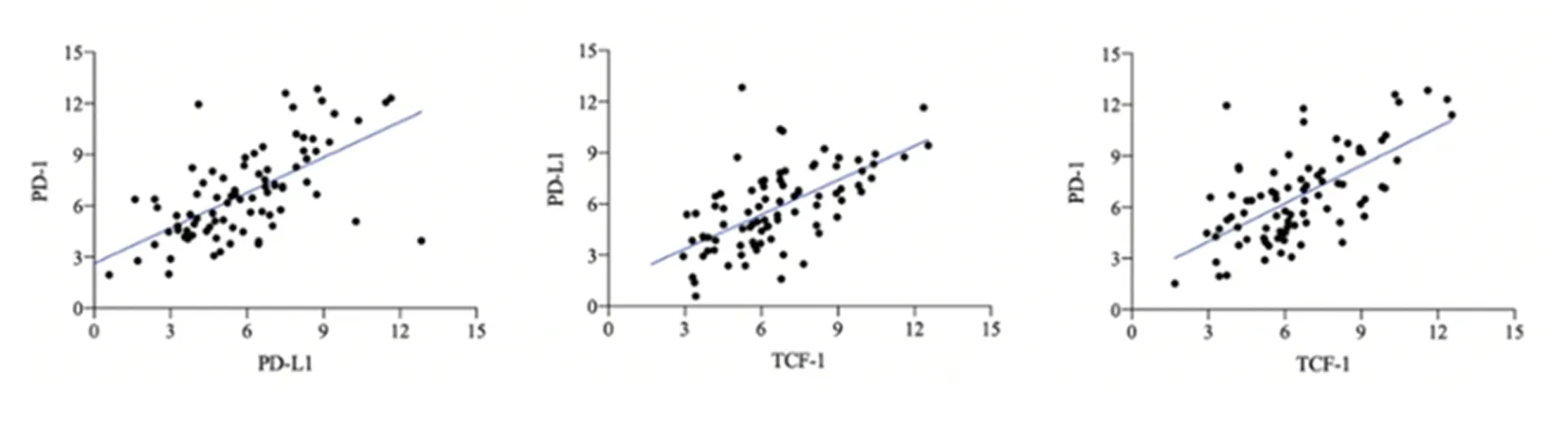
图3 PD-L1、PD-1和TCF-1 mRNA表达的相关性分析散点图
2.3外周血细胞PD-L1、PD-1和TCF-1 mRNA表达与临床病理特征的相关性ROC分析确定PD-L1、PD-1和TCF-1 mRNA诊断ESCC的最佳界值分别为4.52、5.42、5.96,据此,本研究ESCC患者中PD-L1、PD-1和TCF-1 mRNA高表达/低表达的分别为60/28、54/31、49/36例。女性ESCC患者外周血细胞PD-1表达高于男性,表达量分别为7.74±3.00、6.10±2.37(P=0.01),外周血细胞PD-L1、PD-1和TCF-1 mRNA与其他临床病理特征无显著相关性。见表2。

表2 食管鳞癌患者外周血细胞中PD-L1、PD-1和TCF-1 mRNA与临床病理特征相关性分析
2.4外周血细胞PD-L1、PD-1和TCF-1 mRNA与生存期ROC确定血细胞PD-L1、PD-1和TCF-1 mRNA区分ESCC高低风险最佳界值分别为3.67、4.74和5.37,据此,本研究中PD-L1、PD-1和TCF-1 mRNA高表达/低表达的ESCC患者分别为64/16、57/20和53/22例。PD-L1、PD-1和TCF-1高表达ESCC患者OS明显高于低表达者。见图4。采用Cox单因素、多因素比例风险回归模型分析影响OS因素,发现PD-L1、PD-1和TCF-1和淋巴结转移是影响ESCC患者预后的的重要因素,但这些因素并不是ESCC的独立预后因素。见表3。

a:PD-L1;b:PD-1;c:TCF-1
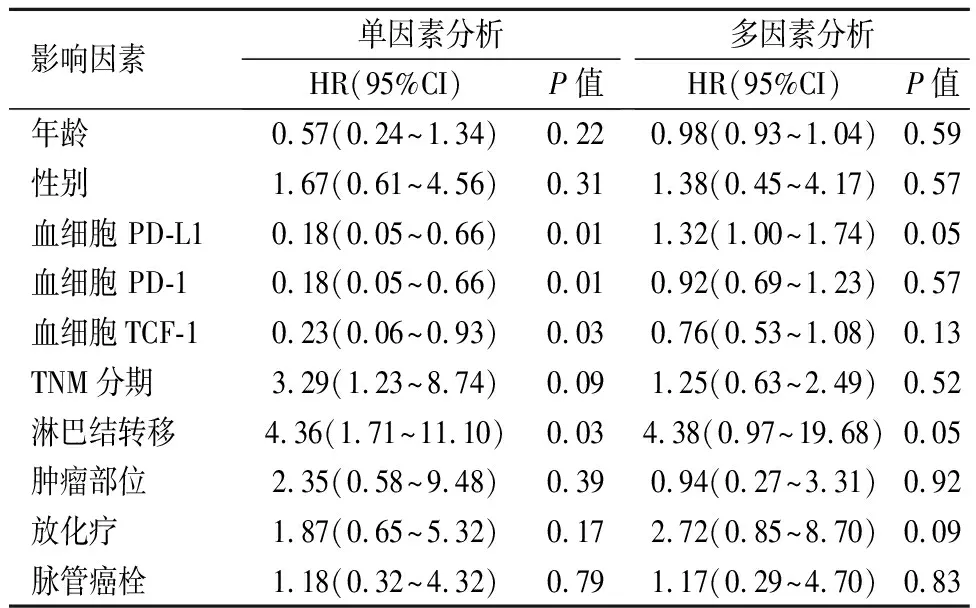
表3 Cox单因素、多因素比例风险回归模型分析影响食管鳞癌患者预后因素
3 讨 论
食管癌是消化道常见的恶性肿瘤之一,主要组织学类型包括ESCC和食管腺癌。中国的食管癌主要是ESCC,约占所有食管癌90%以上[18]。食管癌起病隐匿,早期症状不典型,目前以食管胃内镜为主的食管癌早期筛查方法不适于大范围人群筛查。因此,大多数ESCC患者初次确诊时已发生了远处转移,失去了根治性手术治疗机会,5年总生存率低于20%;与晚期ESCC明显不同,早期ESCC患者手术后5年生存率高达90%[14]。因此,积极探索简便易行的食管癌早期筛查方法,是提高ESCC治愈率的关键。
ESCC具有高度异质性,其发生发展过程涉及大量分子异常变化,包括TP53、ZNF750、NOTCH1、FAT1、NFE2L2、CDKN2A、KRT5、YEATS2等多个基因突变,miRNA34a、miRNA375、NEAT1等非编码RNA异常表达,肿瘤抑制基因CDKN2A、RASSF1A等基因启动子区的甲基化等[19-20]。这些异常分子表达于肿瘤细胞,形成的肿瘤新抗原可被机体免疫系统识别,激发抗肿瘤免疫反应[11-13]。从正常食管黏膜发展至癌前病变、原位癌、浸润癌的过程中,外周血CD4细胞、CD8细胞和食管黏膜中IgG、IgA异常改变,CD4/CD8比值在ESCC患者明显降低,IgG与ESCC浸润深度、淋巴结转移相关[21-22]。Xu等应用ELISA检测388例ESCC和125例非癌对照外周血中6个肿瘤相关抗原(p53、NY-ESO-1、MMP-7、Hsp70、Prx VI、Bmi-1)的自身抗体,多数ESCC患者机体至少检出1种肿瘤自身抗体[14]。ESCC患者外周血抗牙龈卟啉单胞菌IgG和IgA抗体滴度明显高于食管良性病变和健康对照者,并与ESCC患者的生存期呈显著负相关,是ESCC独立的预后因素之一[23]。本研究发现ESCC患者外周血中PD-L1、PD-1和TCF-1 mRNA表达水平显著高于非癌对照人群,诊断ESCC的敏感性和特异性高于目前临床常用的SCCA、CYFRA21-1、CEA、CA19-9等血清标志物,表明ESCC患者针对肿瘤细胞发生免疫应答反应是ESCC潜在的生物标志物。
PD-1是B7-CD28家族的共抑制受体,表达于激活的T细胞、B细胞和髓系细胞。侵入人体的细菌、病毒等激活机体免疫系统,同时诱导PD-1表达上调进而维持机体免疫平衡,PD-1缺失会导致自发性自身免疫性疾病的发生[5,24]。PD-L1和PD-L2是PD-1配体,表达于巨噬细胞、树突状细胞、内皮细胞和多种肿瘤细胞,与PD-1结合后,抑制免疫反应发生[5-6]。PD-L1和PD-L2异常表达见于多种肿瘤,在ESCC中,PD-L1和PD-L2表达于肿瘤细胞和肿瘤浸润淋巴细胞,但两者的表达水平与ESCC患者预后相关性,目前报道并不一致[25-29]。乳腺癌患者外周血中PD-1 mRNA表达高于健康对照人群,并与相对应的乳腺癌组织中PD-1表达呈负相关,外周血中高表达和乳腺癌组织中低表达的PD-1乳腺癌患者预后不良[16]。与健康对照相比,胃癌患者外周血PD-1、PD-L1和CD8 mRNA表达明显升高,并且PD-1和CD8高表达患者预后好于低表达胃癌患者[17]。多数研究表明,PD-L1和PD-L2的功能异质性与肿瘤进展阶段相关,肿瘤早期阶段(TNMⅠ和Ⅱ期)的PD-L1和PD-L2高表达提示预后较好。
免疫细胞是一个多功能细胞群,包括T、B、NK、粒细胞、巨噬细胞、树突状细胞、浆细胞等,这些细胞又由多个不均一的亚群构成,发挥免疫应答或免疫抑制功能[1,4]。肿瘤患者机体的免疫细胞具有高度异质性,不同来源组织(外周血、引流淋巴结、肿瘤浸润淋巴细胞)、肿瘤进展不同阶段、不同类型肿瘤、肿瘤浸润淋巴细胞的空间分布等多个因素均能够影响免疫细胞的分子表型和功能[30-32]。文献已报道的ESCC中肿瘤浸润淋巴细胞包括CD8+、CD4+、骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSC)、巨噬细胞(tumor-associated macrophages,TAM)、Treg细胞、Th17细胞等,这些细胞在ESCC和/或外周血中比例变化与ESCC临床病理特征相关,影响化疗疗效和患者预后[1]。比较分析肝癌和肾透明细胞癌癌巢、癌细胞浸润前缘和正常组织,发现CD4+CD8+T细胞主要富集于浸润前缘区域,单细胞测序可将这群CD4+CD8+T细胞分为11个亚群,分别表达细胞毒性表型、幼稚表型、免疫激活表型、耗竭表型等标志性分子,其中的LA3亚群同时高表达PD-1、细胞毒性和耗竭性分子,TCR克隆型表征发现CD4+CD8+T细胞可能由浸润前缘CD8+T分化而来,CD4+CD8+T和PD-1+CD4+CD8+T亚群细胞在浸润前缘富集与癌患者的生存期呈正相关[30,32-33]。在肝癌和结肠癌患者外周血、正常组织和癌组织中,各亚群细胞分布具有组织倾向性,如幼稚、中央型记忆细胞、近期激活效应记忆CD8+细胞主要分布于外周血,富集于肿瘤组织的耗竭性CD8+高表达IFNG、GZMB/GZMH、PRF1等效应分子,仍发挥抗肿瘤免疫功能,这些结果表明,从外周血、浸润前缘至TME,免疫抑制表型逐渐增强,TME中多种免疫细胞表达耗竭性分子[30-32]。上述研究表明,特定的CD8+细胞和CD4+细胞亚群共表达PD-1、多种免疫抑制性分子、Ki67、激活分子(如CD137+、CD38+、HLA-DR+),但不表达耗竭性分子EXOME,并不能代表该亚群细胞抗肿瘤免疫功能缺失,与之相反,还是拮抗性PD-1抗体的效应细胞。此外,TCF-1作为T细胞早期发育的重要调节因子,其缺失发生在T细胞发育早期阶段会导致T细胞淋巴瘤发生,有研究表明TCF-1+T细胞亚群是PD-1治疗的效应细胞[3]。因此,本研究检测了ESCC外周血中与肿瘤免疫活性相关分子的表达,发现PD-1、PD-L1和TCF-1高表达的ESCC患者预后较好,提示PD-1/PD-L1治疗可能更适用于高表达PD-L1、PD-1和TCF-1的ESCC患者。
综上所述,本研究发现ESCC患者外周血PD-1、PD-L1和TCF-1 mRNA表达上调,诊断ESCC准确率高于SCCA、CYFRA21-1、CEA、CA19-9等血清标志物,高表达这些分子的ESCC患者预后较好,这部分ESCC患者可能仍处于肿瘤发展早期阶段(机体出现免疫耗竭状态之前),免疫检查点抑制剂治疗可能使这些患者生存获益,但需更深入研究阐明。

