氯硝柳胺抑制宫颈癌细胞增殖和迁移
罗艳林,陈义兵
(1.郑州大学附属肿瘤医院/河南省肿瘤医院 妇科,河南 郑州 450008;2.郑州大学基础医学院 临床药理研究所,河南 郑州 450001;3.郑州大学第一附属医院 妇产科,河南 郑州 450052)
宫颈癌是全球第二常见的女性恶性肿瘤,近年来中国宫颈癌发病率和死亡率均呈上升趋势及年轻化趋势,2020年中国宫颈癌新发和死亡病例分别占全球发病和死亡总数的18.17%和17.28%,尤其晚期、复发转移宫颈癌常规的手术、放化疗效果欠佳,5 a生存率不足20%,治疗手段有限,急需新的治疗手段[1-2]。为了克服这些局限性,探寻针对靶向癌症病程发生与发展过程中的相关信号转导通路的新治疗方法是改善宫颈癌预后的关键因素。细胞上皮间质转化(epithelial-mesenchymal transition,EMT)可影响多种生物过程,包括细胞增殖、迁移、分化和炎症反应等[3]。研究表明EMT在各种恶性肿瘤进展中起了重要作用,包括结直肠癌、食管癌、乳腺癌、脑癌、子宫内膜癌、宫颈癌等[4-5]。
氯硝柳胺对绦虫特别有效,已被用来治疗绦虫感染近50年[6];近年来,氯硝柳胺已被确定为一种潜在的抗癌药物[7]。最近有研究报道,氯硝柳胺对乳腺癌、结肠癌、卵巢癌、肾癌和血液肿瘤等都显示出抗肿瘤活性[8-12]。也有研究表明氯硝柳胺能够抑制宫颈癌细胞的增殖,且能够逆转宫颈癌细胞对紫杉醇的耐药[13],但具体的作用机制并不十分明晰。因此,本研究旨在探讨氯硝柳胺对宫颈癌的影响和潜在抗肿瘤作用的分子机制,这可能对宫颈癌的治疗有价值,并为特定抑制剂的开发提供研究基础。
1 材料和方法
1.1 主要材料
人宫颈癌细胞系HeLa、SiHa购自中国科学院细胞库,其中HeLa细胞来源于人子宫颈腺癌组织,含有人乳头瘤病毒18型基因序列,SiHa细胞来源于人子宫颈鳞癌组织,含有人乳头瘤病毒16型基因序列;10%胎牛血清(Gibco)、DMEM培养基(Gibco)均购自美国Thermo公司;氯硝柳胺购自美国Selleck Chemicals,抗体Vimentin和N-Cadherin、Actin 购自美国Cell Signaling Technology。
1.2 细胞培养和药物处理
HeLa、SiHa细胞培养在体积分数10%胎牛血清的DMEM培养基中,置于37 ℃、体积分数5% CO2的培养箱中培养,每隔2~3 d传代培养1次。将氯硝柳胺溶解于无菌二甲基亚砜(dimethyl sulfoxide, DMSO)中,配置成20 mmol·L-1的储备溶液,将其储存于-20 ℃,使用时用细胞培养基稀释。
1.3 MTT检测
取对数生长期浓度为5×104个·mL-1的SiHa、HeLa细胞接种于96孔板中,每孔100 μL。在培养箱中培养12~16 h后,分别用0、1、2、4 μmol·L-1的氯硝柳胺处理SiHa、HeLa细胞,每种浓度平行5孔,各组实验重复3次。各处理组分别在加药后24、48、72 h后加20 μL新鲜的MTT(5 g·L-1)溶液处理,37 ℃孵育4 h后,吸掉上清,用150 μL DMSO溶液溶解紫色结晶沉淀物,振荡混匀后置于酶标仪上选取波长570 nm测定吸光度(A)值。细胞存活率(%)为实验组A值除以对照组A值乘以100%。
1.4 细胞划痕试验
将生长状态良好的SiHa、HeLa细胞按照每孔5×105接种在35 mm培养皿中,每组设置3个平行样。放置在体积分数5% CO2的37 ℃培养箱中培养至细胞接近饱和后,加药处理后用无菌的200 μL枪头在每皿中划出等宽的直线划痕,无菌PBS清洗后加新鲜培养基,并用0.5 μmol·L-1的氯硝柳胺分别处理SiHa、HeLa细胞,体积分数为0.05%的DMSO处理作为对照组。处理后继续培养24 h,在倒置显微镜下观察划痕宽度,实验重复3次。
1.5 Western blot
用2.5 g·L-1胰蛋白酶消化各组细胞,离心收集细胞沉淀,用RIPA缓冲液置于冰上裂解。通过Bradford染料法测定蛋白质浓度。将等量(20~40 μg)细胞提取物在100 g·L-1SDS-PAGE中电泳,并转移至硝酸纤维素膜(Millipore,HATF00010)进行转膜,100 mA恒流转移2 h,用50 g·L-1BSA室温封闭1 h,摇床上TBST洗脱3次,每次5 min。一抗用抗体稀释液1∶500稀释,4 ℃孵育过夜,取出膜,摇床上TBST洗脱3次,每次5 min。二抗用50 g·L-1BSA 1∶10 000稀释,摇床上室温孵育1 h。摇床上TBST洗脱,室温3次,每次10 min。ECL显色,A液和B液1∶1混合,显影成像。
1.6 统计学方法
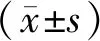
2 结果
2.1 氯硝柳胺抑制人宫颈癌细胞增殖
MTT实验结果显示,4 μmol·L-1的氯硝柳胺处理HeLa细胞48、72 h后,细胞活力分别是(24.15±1.13)%和(16.22±2.63)%,4 μmol·L-1的氯硝柳胺处理SiHa细胞48、72 h后,细胞活力分别是(37.23±1.52)%和(23.18±2.82)%。随着氯硝柳胺浓度的升高和处理时间的延长,氯硝柳胺对HeLa和SiHa细胞的抑制率越来越高,HeLa和SiHa细胞活力越来越低,氯硝柳胺呈浓度和时间依赖方式抑制宫颈癌细胞系SiHa和HeLa的增殖。见图1。

A为MTT法测定HeLa细胞的细胞活力;B为MTT法测定SiHa细胞的细胞活力;各组实验重复3次,*P<0.05,**P<0.01,***P<0.001。
2.2 氯硝柳胺抑制人宫颈癌细胞迁移
细胞划痕试验结果显示,0.5 μmol·L-1的氯硝柳胺处理HeLa细胞48 h后,细胞的迁移率为(41.61±12.34)%,而此时对照细胞迁移率为(70.58±3.19)%,氯硝柳胺处理使HeLa细胞迁移率降低(t=3.937,P=0.017)。0.5 μmol·L-1的氯硝柳胺处理SiHa细胞48 h后,细胞的迁移率为(13.26±3.87)%,而此时对照细胞迁移率为(68.92±8.92)%,氯硝柳胺处理使SiHa细胞迁移率降低(t=9.915,P<0.001)。见图2。

A为细胞划痕试验测定HeLa细胞迁移能力;B为细胞划痕试验测定SiHa细胞迁移能力。
2.3 氯硝柳胺抑制HeLa和SiHa细胞中EMT蛋白表达
Western blot结果显示,氯硝柳胺处理HeLa和SiHa细胞48 h后,氯硝柳胺抑制N-Cadherin和Vimentin表达,并且随着氯硝柳胺的浓度升高,对N-Cadherin和Vimentin表达抑制程度也越高。见图3。

A为Western blot检测HeLa细胞N-Cadherin和Vimentin表达;B为Western blot检测SiHa细胞N-Cadherin和Vimentin表达。
3 讨论
宫颈癌发病率和死亡率高,严重威胁女性健康。尽管早期宫颈癌通过手术或放化疗等能达到较好的效果,但是晚期、转移和复发宫颈癌无有效治疗手段,预后差,急需开发新的治疗手段来改善患者的预后。近50年来,氯硝柳胺用于人体和动物绦虫感染,为治疗牛带绦虫、阔节裂头绦虫、短小膜壳绦虫等感染的良好药物[14]。值得注意的是,许多体外和体内研究表明,通过失活多种信号通路证实氯硝柳胺具有潜在的抗癌活性[15]。已有众多研究结果表明,氯硝柳胺对乳腺癌、肺癌、结肠癌、卵巢癌、头颈癌等具有抗肿瘤活性[16-17],然而潜在的分子机制仍然知之甚少。本研究结果显示氯硝柳胺以剂量依赖性和时间依赖性方式降低宫颈癌细胞活力,抑制宫颈癌细胞转移,促进宫颈癌细胞凋亡,这一发现显示氯硝柳胺可有效抑制宫颈癌。
从最初的药物发现到最终用药的药物开发过程代价高昂,费时费力。与从头开始的新药研发相比,寻找老药或天然药物的新用途更加经济、安全、高效[18-20]。不同课题组的多项研究表明氯硝柳胺可抑制多种分子和信号通路发挥抗肿瘤作用,包括核因子κB信号通路、mTOR信号通路、Wnt/β-catenin信号通路、STAT3信号通路的信号转导和激活以及Notch等信号通路[21-22]。有研究报道,氯硝柳胺通过Wnt/β-catenin信号通路逆转食管癌对紫杉醇药物抵抗[23]。另有研究报道,氯硝柳胺通过诱导GSK3-β调控的β-catenin泛素化降解来抑制胰腺癌细胞的增殖和迁移,同时能够提高吉西他滨对胰腺癌细胞治疗的敏感性并减少胰腺癌免疫逃逸的发生[24]。另一项研究显示,对于去势治疗抵抗的前列腺癌,体内、体外实验均证明氯硝柳胺可通过抑制FOXM1介导的DNA损伤修复系统来发挥抗肿瘤作用[25]。
然而,氯硝柳胺对宫颈癌细胞的作用及可能的作用机制尚不完全清楚。EMT是重要的信号转导通路,包括Vimentin和N-Cadherin蛋白,与细胞的异常增殖、进展密切相关[26]。大量研究表明,EMT信号通路在恶性肿瘤细胞和组织中均异常表达,并参与恶性肿瘤的发生、发展、侵袭、转移和治疗抵抗[27]。本研究发现氯硝柳胺能够抑制Vimentin和N-Cadherin蛋白表达,氯硝柳胺在SiHa和HeLa细胞系中以剂量依赖性方式抑制Vimentin和N-Cadherin蛋白,初步推测,氯硝柳胺可能是通过抑制EMT信号通路来发挥其对宫颈癌的抑制作用。既往研究也有报道氯硝柳胺联合或不联合顺铂均可通过抑制EMT抑制铂敏感和铂耐药型三阴性乳腺癌的增殖,尤其是铂耐药型三阴性乳腺癌[28]。本研究仅在体外进行,还需要在体内实验和临床研究中进一步验证其抗癌效应及可能分子机制,以协同方式评估其抗癌潜力,证实氯硝柳胺是否为治疗宫颈癌的候选药物之一。
4 结论
氯硝柳胺以剂量依赖性和时间依赖性方式降低宫颈癌细胞活力,抑制宫颈癌细胞转移,促进宫颈癌细胞凋亡,抑制Vimentin和N-Cadherin蛋白表达,可能成为一种新的治疗宫颈癌的药物。

