苹果甘油二酯激酶基因MpDGK7过表达对拟南芥植株抗旱性的影响
谭延肖 韩梅梅 张 超 常培培 徐文胜
(德州市农业科学研究院,山东 德州 253015)
在自然界中,干旱、高盐、极端温度以及病虫害等生物和非生物胁迫常常会对植物的生长发育造成严重的不良影响[1]。为了在各种不利的生存环境下维持生命并进行持续的生长发育,植物进化出一系列复杂的调控机制以应对外部环境刺激并保护自身免受胁迫伤害,其中包括磷脂酸(phosphatidic acid,PA)信号调控网络[1-2]。
PA 是植物中一种重要的信号分子[2],可以被各种生物及非生物逆境胁迫触发,包括干旱[1]、病原菌侵染[3]、脱落酸[4]、高盐[5]、冷害[6]和物理伤害[7]等。PA的合成有利于提高植物对不利环境的适应性。在植物细胞中,PA 可以通过两种不同的代谢途径产生:1)通过磷脂酶D(phospholipase D,PLD)的不同亚型作为结构磷脂的水解产物;2)通过磷脂酶C(phospholipase C,PLC)和甘油二酯激酶(diacylglycerol kinase,DGK)的联合活性[8]。其中,DGK 可以通过磷酸化甘油二酯(diglycerylester, DAG)催化合成PA。
DGK 在高等植物中以不同亚型存在,其活性已在不同物种中得到证实,包括拟南芥(Arabidopsisthaliana)[9]、水 稻(Oryza sativa)[10]、番 茄(Solanum lycopersicum)[11]、玉 米(Zea mays)[12]、小 麦(Triticum aestivum)[13]等。植物DGK 具有保守的催化结构域和激酶活性所必需的ATP 结合位点(GXGXXG/A),同时DGK 的活性受到严格调节,以协调DAG 和PA 的水平,使细胞能够正常执行其生理功能[14]。大量研究表明,DGK 在植物生长、发育以及响应生物和非生物胁迫过程中起着至关重要的作用。在拟南芥中,除茎外,AtDGK2基因表达在整个植株中均有发现,并且受低温(4 ℃)胁迫诱导,表明AtDGK2可能参与了冷信号转导[14];而AtDGK7基因转录本主要存在于茎、叶和花中,其活性受pH 值、去污剂和R59022 抑制剂的影响[9]。另外,在水稻中发现的OsBIDK1基因转化烟草增强了转基因植物的抗病性[15],而通过抑制DGK的活性则大大降低了植物的生长和根系的伸长[16]。但目前仍鲜见DGK家族基因在木本植物中的功能研究。
本研究前期通过对苹果DGK 家族成员进行全基因组鉴定和分析,从苹果属楸子(Malus prunifolia)中成功克隆到出4 个DGK基因(GenBank 登录号分别为KM099880,KM099881,KM099882 和KM099883),其中MpDGK7(KM099883)基因表达受高盐、干旱以及外源脱落酸(abscisic acid, ABA)处理调控[1]。本研究通过农杆菌介导法将MpDGK7基因在拟南芥Columbia中进行过量表达,鉴定过表达株系材料的抗旱性,探索MpDGK7基因在干旱胁迫响应过程中的功能,以期为进一步揭示该基因的生物学功能奠定基础。
1 材料与方法
1.1 试验材料
本试验用拟南芥为Columbia 生态型,克隆载体pMD18T-simple 购于日本TaKaRa,植物表达载体pBI121 为德州市农业科学研究院实验室保存。大肠杆 菌(Escherichia coli)Top10 感受态细胞、农杆菌(Agrobacterium tumefaciens)EHA105 购于北京天根生化科技有限公司。
1.2 试验方法
1.2.1MpDGK7过表达拟南芥植株的获得 采用Weigel 等[17]的方法对拟南芥种子进行消毒,然后置于1/2 MS 固体培养基中,4 ℃暗箱条件下孵育3 d。转移到人工气候箱发芽7~10 d 后,成苗移栽到土壤中。人工气候箱培养条件:温度22 ℃,空气相对湿度70%,光强度100 μmol·m-2·s-1,光周期16 h光/8 h暗。
首先将MpDGK7编码区克隆到pBI121 载体CaMV 35S启动子下游[15],所用引物见表1。然后将重组将质粒转化农杆菌EHA105 菌株感受态细胞,用花浸渍法转化拟南芥[18]。最后将收获的转化T1 代种子进行表面消毒后,播种在含有50 mg·L-1卡那霉素的MS 筛选培养基上,筛选至T3代。
拟南芥DNA提取方法参考植物DNA提取试剂盒说明书(北京天根生化科技有限公司)进行,分别以野生型和转基因T3代拟南芥叶片DNA为模板,进行目的基因PCR 检测。对PCR 检测呈阳性的转化株系,采用改良CTAB法[19]提取叶片RNA,并利用半定量RT-PCR(semiquantitative real-time PCR)和实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)[1](所用引物见表1)检测MpDGK7在转基因株系中的表达水平。
1.2.2MpDGK7过表达拟南芥植株抗旱性鉴定 采用土壤控水的方式对生长3 周的拟南芥野生型和转基因株系进行逐渐干旱处理7 d[1],对照为正常供水。处理3 d时,采样观察叶片气孔特性。处理7 d时,测定对照和处理植株的叶片鲜重、相对电导率及叶绿素含量,采样液氮速冻,-80 ℃条件下保存。
1.2.3 叶片相对电导率及叶绿素含量测定 参考Dionisio-Sese 等[20]的方法,使用DSS-307 电导率仪(上海虹益仪器仪表有限公司)测定叶片相对电导率。蒸馏水空白电导率为C0;将10 个叶圆片投入10 mL 蒸馏水中,30 ℃水浴2 h 时,测定值记录为初始电导率C1;沸水条件下10 min,冷却,测定最终电导率C2。叶片相对电导率(electrical conductivity,EC)计算公式如下:
取1 g 叶片,加入10 mL 80%丙酮浸提24 h,使用UV-2550 分光光度计(日本岛津)测定663、645 和470 nm 波长下的吸光值,计算叶绿素含量,计算方法参考文献[21]。
1.2.4 叶片气孔特征观察 在JSM-6360LV 扫描电镜(日本JEOL)下观测叶片气孔特征。样品制备参考马小卫[22]的方法。使用Image J 1.8.0 软件统计气孔密度和气孔开张度。
1.2.5 过氧化氢(H2O2)和丙二醛(MDA)含量测定H2O2提取和测定方法参考文献[23]。使用UV-2550分光光度计在410 nm波长下测量吸光值,根据标准曲线计算H2O2的浓度,计算方法参考文献[23]。
MDA含量测定:取1 g叶片,加入2 mL预冷的0.1%(w/v)三氯醋酸(trichloroacetic acid, TCA)溶液充分研磨,4 ℃下12 000×g离心20 min;取1 mL 上清,加入1 mL 0.65%硫代巴比妥酸(thiobarbituric acid,TBA),沸水浴30 min,移至冰中终止反应,4 ℃条件下5 000×g离心10 min。用UV-2550分光光度计测定532和600 nm波长下的吸光值,计算MDA 含量,计算方法参考文献[24]。
1.2.6 抗氧化系统相关酶活性测定 取1 g叶片,加入2 mL 50 mmol·L-1磷酸二氢钾缓冲液(pH 值7.8,含1 mmol·L-1EDTA-Na2和11% Triton X-100)和2%(w/v)聚乙烯吡咯烷酮研磨至匀浆。4 ℃下12 000×g离心20 min,取上清测定过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性,测定方法参考文献[25]。
1.3 数据分析
试验处理重复3 次,数据统计进行3 次生物学重复。采用Excel 2010 和SPSS 13.0 软件进行数据处理,使用Sigma Plot 软件作图,并应用独立样本的t检验对变量进行显著性差异分析。
2 结果与分析
2.1 MpDGK7 转基因拟南芥植株的获得及分子水平检测
为研究MpDGK7的生物学功能,将MpDGK7基因的开放阅读框(open reading frame, ORF)插入CaMV 35S启动子下游,利用农杆菌介导法转化拟南芥Columbia野生型。经目的基因PCR 鉴定,共获得6 个转基因株系(图1-A),随后利用半定量RT-PCR 和qRT-PCR 检测MpDGK7基因表达量,发现MpDGK7基因在所有转化株系中均有表达,选取其中表达量较高的两个株系(#3和#4)用于后续试验(图1-B、C)。
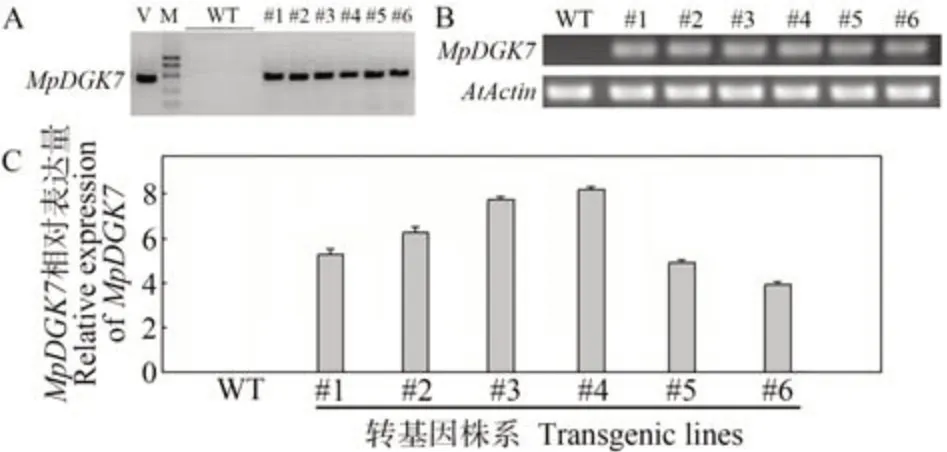
图1 MpDGK7转基因拟南芥分子检测Fig.1 Molecular characterizations of MpDGK7 transgenic Arabidopsis plants
2.2 MpDGK7转基因拟南芥抗旱性鉴定
前期研究发现,干旱胁迫可以诱导MpDGK7基因上调表达[1]。为进一步明确MpDGK7基因在干旱胁迫响应过程中的生物学功能,本试验对野生型和转基因拟南芥株系进行了自然干旱处理。从图2-A 可以看出,干旱处理前野生型和转基因株系均生长良好且没有明显差异,经过7 d 控水处理后,转基因株系明显比野生型长势更强。在处理7 d 时,与野生型相比,转基因株系保持了较高的叶片鲜重(图2-B)、较低的叶片相对电导率(图2-C)和较高的叶绿素含量(图2-D)。由此可以看出,MpDGK7基因过量表达有利于提高拟南芥植株的抗旱性。

图2 MpDGK7转基因拟南芥抗旱性鉴定Fig.2 Drought tolerance test of MpDGK7 transgenic Arabidopsis
2.3 干旱胁迫下MpDGK7 转基因拟南芥叶片气孔特性的变化
干旱条件下,气孔运动是影响植物叶片水分散失的重要因素。因此,在自然干旱3 d 后,对转基因株系和野生型叶片气孔特性进行观察,如图3-A 所示。正常供水和干旱处理后,转基因株系与野生型叶片气孔密度均无显著差异(图3-B),而在干旱胁迫下转基因株系气孔张开度更低(图3-C)。这些结果表明,MpDGK7基因过量表达能够促进干旱下拟南芥叶片气孔的迅速关闭。

图3 干旱胁迫下MpDGK7转基因拟南芥的气孔特征Fig.3 Stomatal characteristic of MpDGK7 transgenic Arabidopsis under drought stress
2.4 干旱胁迫下MpDGK7转基因拟南芥叶片H2O2水平和MDA含量的变化
H2O2的产生是植物遭受不利环境的特征和受到伤害的症状指标[26]。本研究中,正常供水下,叶片生长状态良好,转基因株系和野生型植株体内H2O2的积累量都保持在较低的水平,而干旱胁迫导致H2O2大量积累,但转基因植株积累的H2O2含量显著低于野生型植株(P<0.001)(图4-A)。
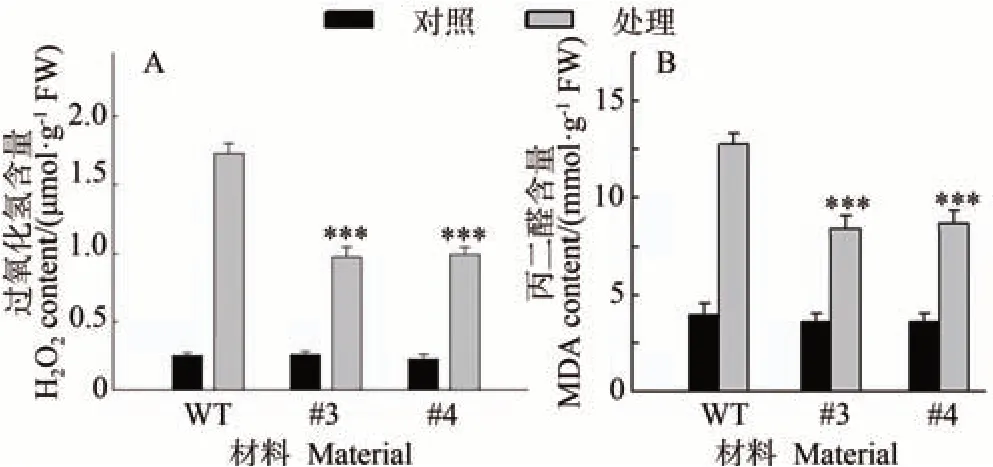
图4 干旱胁迫下MpDGK7转基因拟南芥H2O2和MDA含量Fig.4 H2O2 content and MDA accumulation of MpDGK7 transgenic Arabidopsis under drought stress
同时,植物体积累的活性氧(reactive oxygen, ROS)可以直接与氨基酸、蛋白质和核酸发生反应,导致脂质过氧化产物MDA 含量增加。本试验中,干旱胁迫下转基因株系和野生型叶片中MDA 含量均有所升高,但转基因株系中MDA 的积累量显著低于野生型植株(图4-B)。这表明MpDGK7过量表达可以缓解干旱胁迫诱导的膜脂过氧化损伤。
2.5 干旱胁迫下MpDGK7 转基因拟南芥叶片抗氧化系统酶活性的变化
CAT、POD 和APX 可以促进H2O2的降解[26-28],在ROS清除过程中发挥重要作用。通过对转基因株系和野生型叶片中几种关键抗氧化酶活性进行检测,发现在干旱胁迫下,CAT、POD和APX的活性都出现了明显变化,然而在转基因植株体内这些抗氧化酶的活性显著高于野生型(P<0.01 或P<0.001)(图5-A~C)。表明MpDGK7可能通过影响抗氧化酶活性调控植株体内H2O2的平衡进而影响对干旱胁迫的抗性。
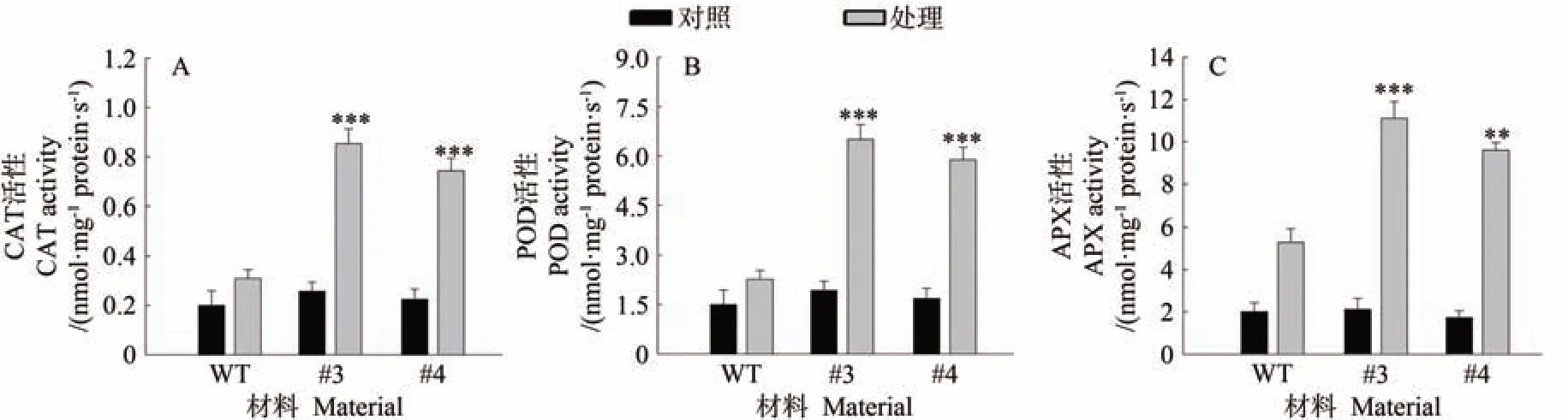
图5 干旱胁迫下MpDGK7转基因拟南芥的抗氧化酶活性Fig.5 Antioxidant enzyme activities of MpDGK7 transgenic Arabidopsis under drought stress
3 讨论
真核细胞中,由PLD 或PLC/DGK 偶联途径合成PA是重要的信号转导过程[8]。在植物中,DGK、DAG和PA 参与植株的生长、发育和对环境胁迫的响应过程[16,29-30]。本试验对苹果MpDGK7基因在干旱胁迫下的生物学功能进行了相关研究,结果表明,当遭受干旱胁迫时,MpDGK7基因的过量表达提高了拟南芥植株的抗旱性,使转基因植株的细胞活力得以更好地维持,包括电导率、叶绿素浓度和脂质过氧化水平(即MDA含量)。
气孔的开放和关闭受外部环境变化和内部调节因子的调控,进而维持细胞水平衡和完成复杂的信号转导过程[31-32]。通过调节气孔,植物可以对干旱、低温和盐碱化等环境胁迫做出快速响应,以减少水分流失,维持正常生长发育[33]。本研究发现,MpDGK7转基因株系和野生型植物在气孔密度上无显著差异,而在干旱处理下转基因植物的气孔关闭比野生型植物更敏感。这说明MpDGK7可能会影响环境刺激诱导的叶片气孔关闭过程,从而最大程度地减少干旱环境下通过蒸腾作用造成的水分散失,进而调控植株的抗旱性。
不利的生存环境也会导致植物体ROS 的产生,ROS 与蛋白质、氨基酸、核酸等直接反应,发生脂质过氧化,最终导致细胞损伤甚至死亡[26]。ROS 积累通常是干旱胁迫造成植株细胞损伤的一个主要原因。本研究结果表明,干旱胁迫下转基因植物叶片中H2O2积累明显低于野生型。与野生型植株相比,CAT、POD 和APX 作为主要的H2O2清除酶,在转基因株系中始终保持较高活性。因此,MpDGK7可能在调节H2O2稳态和抗氧化酶活性中发挥重要作用,从而有效减轻逆境胁迫诱导的氧化损伤,提高植物对不利环境的适应性。
综上,某些DGK基因在调控植物应对不利环境的响应中发挥关键作用,但DGKs应答逆境胁迫的分子调控机制仍不明晰,在进一步研究中需要明确其调控的靶蛋白,以及逆境环境下如何影响PA合成及其信号转导过程。
4 结论
本研究结果表明,MpDGK7在植物体对干旱胁迫的响应过程中发挥积极作用,能够通过影响气孔运动,调节H2O2稳态,从而增强植株对不利环境的适应性。

