3D打印n-HA/壳聚糖/米诺环素复合支架的构建与其理化性能、细胞毒性研究
牛婉琼, 杨 楠, 刘佳怡, 汪振华
(1石河子大学医学院, 新疆 石河子 832000; 2乌鲁木齐市口腔医院修复科, 乌鲁木齐 830002)
种植牙技术是目前临床上治疗牙体、牙列缺失的常用手段,具有修复美观、功能改善效果好等优点,但术后部分患者种植体周围因各种原因发生炎症感染,导致种植体周围骨丢失,植体发生松动、脱落,严重影响远期预后[1]。研究种植体周围炎(PI)以及如何控制、治疗种植体周围炎骨缺损是口腔医师急需解决的问题[2]。研究发现局部给药米诺环素微球联合其他药物或者方法清创对种植体周围炎有效[3]。
纳米羟基磷灰石作为骨替代材料已在骨增量和种植体涂层方面广泛应用,参与复合构建新骨成型的支架,但纳米羟基磷灰石(Nano-hydroxyapatite,n-HA)存在脆性较大、强度较低、生物降解速度慢等缺点[4],经常被用来与可降解的天然高分子材料组合来改善其缺点,壳聚糖(Chitosan,CS)是其选择之一。壳聚糖是甲壳素的脱乙酰产物,天然材料,具有无细胞毒性、可降解性、抗菌能力和止血作用的特性[5],还具有载药功能,发挥药物的缓释、控释作用[6]。
临床中,数字化制造技术可以帮助临床口腔医生为牙列缺失和缺损的患者更快、更好地提供新种植体和骨缺损材料[7]。3D打印技术的应用可以节约骨充填材料并减少手术过程中的创伤,达到精准、微创、快速修复的要求,同时还能缩短治疗周期[8]。基于以上背景,本研究通过3D打印技术构建n-HA/CS复合支架,探究不同复合支架的理化性质及细胞毒性。
1 材料与方法
1.1 材料与仪器纳米羟基磷灰石(上海阿拉丁试剂有限公司,规格:97%,粒径<100 nm),壳聚糖(上海阿拉丁试剂有限公司,规格:25 g),米诺环素(天津阿拉丁试剂有限公司),氢氧化钠、无水乙醇、乙酸(新疆农业大学提供),打印成型机(新疆大学自建),小鼠成纤维细胞L-929(山东国际生物科技园提供),培养瓶、离心管、96孔细胞培养板(苏州柯仕达电子材料有限公司),四唑盐(MTT)、磷酸缓冲液(PBS)、二甲基亚砜(DMSO)、RPMI1640细胞培养液,胎牛血清,胰蛋白酶,生理盐水溶液(北京索莱宝科技有限公司)。生物安全柜、低温高速离心机、CO2培养箱(美国Thermo Scientific),全自动酶标仪(美国BioTek),台式低速离心机(湖南赫西仪器装备有限公司),光学显微镜(日本Olympus 1×71),电子万能试验机(三思纵横UTM6000系列),扫描电镜(日本电子JSM-7610F系列),电子天平(瑞士Precisa)。
1.2 实验方法及分组3D打印n-HA/壳聚糖/米诺环素复合支架模型是取1 g壳聚糖(脱乙酰度为85%~90%)粉末,溶解于6 mL浓度为0.2 mol/L的乙酸,在50℃条件下均匀搅拌1 h,此时的溶液为壳聚糖溶液(质量浓度为1%),之后再分批次分别加入2.5、3.5、4.5 g的纳米羟基磷灰石,相同条件下继续搅拌2 h,形成羟基磷灰石/壳聚糖溶液,再分别将1、5、10 μmol/L的米诺环素粉末溶于1 mL无水乙醇,将以上两溶液混合后,继续搅拌20 min,形成米诺环素/CS/n-HA溶液。由于加入不同质量的羟基磷灰石和不同浓度的米诺环素,经组合,实验组分为S1(n-HA 2.5 g、米诺环素1 μmol/L)、S2(n-HA 3.5 g、米诺环素1 μmol/L)和S3(n-HA 4.5 g、米诺环素1 μmol/L);S4(n-HA 2.5 g、米诺环素5 μmol/L)、S5(n-HA 3.5 g、米诺环素5 μmol/L)和S6(n-HA 4.5 g、米诺环素5 μmol/L);S7(n-HA 2.5 g、米诺环素10 μmol/L)、S8(n-HA 3.5 g、米诺环素10 μmol/L)和S9(n-HA 4.5 g、米诺环素10 μmol/L)。对照组分为D1(n-HA 2.5 g、米诺环素0 μmol/L)、D2(n-HA 3.5 g、米诺环素0 μmol/L)和D3(n-HA 4.5 g、米诺环素0 μmol/L)。将各组溶液装入3D打印成型机中,设置长方体编程程序(喷印边长10 mm,高3 mm),启动设置,开始打印支架。待支架打印成形后,浸泡在5%的氢氧化钠溶液中30 min,将乙酸彻底去除,之后材料用蒸馏水冲洗至中性,室温下干燥24 h。
1.3 各组支架理化性质检测
1.3.1 吸水率检测 对复合支架进行吸水试验,评定其亲水性。称得各组支架干燥时的质量M0,37℃下放入装有50 mL蒸馏水(pH=7.4的0.01 mol/L PBS中)的烧杯中,每隔0.5、1、4、8、24、36、48 h取各组的样本,检测样本支架质量,滤纸吸除支架表面多余水分后称得质量M1,计算支架吸水率。吸水率=(M1-M0)/M0×100%。
1.3.2 力学性能检测 支架拉伸试验:将支架裁取成10 mm×1.5 mm的样条,常温下用电子万能试验机对支架进行拉伸测试,以0.5 mm/min的速率进行测试。
1.3.3 孔径检测 每组取3个样品,扫描电镜下观察支架内部结构、孔隙连通性,测量孔径大小取其平均值并记录。
1.3.4 支架表面形貌观察 利用原子力显微镜观察各组支架的表面粗糙度,然后在支架表面喷金,再用扫描电子显微镜观察材料的表面微观结构。
1.3.5 pH值的测定 (1)紫外线30 min照射细胞无菌操作室;(2)照射完毕后,进入操作室内进行实验;(3)将250 mg支架材料加入1 mL培养基中,并放置在37℃恒温培养箱中培养;(4)1~10 d取同一时间的浸出液,同时放入冰箱4℃保存;(5)每次取样结束后,用检测仪对浸出液的pH值进行精确检测;(6)每组样品重复实验3次,统计实验结果并取均值。
1.3.6 支架体外降解性能分析 选择生理盐水溶液作为材料的降解介质,研究材料的体外降解行为。取样品10份,每份干燥称质量,将其浸没于质量为自身质量100倍的生理盐水中,空气环境中在37℃电热恒温培养箱下进行培养,连续10周,分别于每周同一时间随机取出1份,称取质量,分析降解性能。降解率=(M0-M1)/M0×100%,M0为支架材料的原始质量,M1为支架材料降解后的质量。
1.4 复合支架MTT细胞毒性检测取对数生长期小鼠成纤维细胞(L-929)并配置成单细胞悬液,在3块96孔板中,分别将细胞以3×104个/mL,且每孔接种100 μL的质量接种后,放置于CO2培养箱(含体积分数5%二氧化碳气体)中,37℃条件下培养24 h,废弃原培养液。之后分别添加各组复合支架浸出液200 μL,继续放置在5%CO2、37℃的培养箱中,同时以不加浸提液的小鼠细胞为空白对照组。72 h后,再在每孔中加入质量浓度为5 g/L的MTT溶液100 μL,再于4 h后去除孔板中溶液,加DMS0液体600 μL,置于振荡器振荡10 min,在酶标仪560 nm波长下测定各组的吸光度(OD值)。在1、3、5、7、9、11 d的同一时间点各取一块板,记录OD值,倒置显微镜观察细胞生长情况及其形态。细胞毒性分级如下:相对增殖率(RGR)≥100%为0级;99%≥相对增殖率≥80%为1级;79%≥相对增殖率≥50%为2级;49%≥相对增殖率≥30%为3级;29%≥相对增殖率≥0%为4级。

2 结果
2.1 复合支架的表面形态打印出的复合支架为约10 mm×10 mm×3 mm的长方体,呈乳白色,肉眼可见支架纵横结构内存在多孔隙,表面粗糙,有一定的韧性和脆性,见图1。

图1 复合支架表面形态
2.2 各组复合支架的理化性质
2.2.1 各组支架吸水率变化 对照组D1-D3中,随着n-HA质量的增加,吸水率呈逐渐下降趋势,但D1、D2、D3组间差异无统计学意义(P=0.896)。各实验组吸水率在4 h左右趋于稳定,相同n-HA质量下实验组(即S1、S4和S7;S2、S5和S8;S3、S6和S9)的吸水率随着米诺环素浓度的增高缓慢增加(P=0.000 9),其中S7组在4 h时的吸水率最高,为213.5%,但随着时间的延长,各实验组吸水率又慢慢降低,S7、S8、S9组在24~36 h时降低速度最快,可能由于米诺环素自身具有亲水性的特性,可以在2~4 h内溶于水中,见图2。

图2 对照组D1-D3和实验组S1-S9的吸水率变化情况
2.2.2 各组支架力学性能比较 随着n-HA质量的增加,对照组D1-D3复合支架的拉伸强度和最大载荷均有不同程度的降低(P=0.000 2)。实验组S1-S6复合支架的拉伸强度随着米诺环素浓度的增加而增大,当米诺环素的浓度继续增加至10 μmol/L后,S7、S8、S9组拉伸强度反而降低,实验组S9的拉伸强度仅为1.47 MPa,见表1。

表1 各组支架力学性能比较
2.2.3 各组孔径大小比较 研究表明,促进骨组织修复再生的孔隙率应至少在50%以上[9],本研究中各组支架的孔隙率均符合这一要求,且孔径越大支架孔隙率越高,见表2。

表2 各组孔径大小比较
2.2.4 各组支架表面形貌情况 电镜下复合支架呈网状结构,材料间相互结合,有大小不等的孔隙,分布不均匀。电镜下放大1 000倍后,随着n-HA质量的增加,D1、D2、D3对照组的孔隙在逐渐减小。同时随着米诺环素浓度的增加,相同n-HA质量下各实验组的支架孔隙也在逐渐减小,支架表面具有贯通的空隙,见图3。

图3 电镜下各组支架的表面形貌(×1 000)
2.2.5 各组支架pH值的比较 随着n-HA质量的增加,pH值变化不大,未见明显升高或降低(P=0.000 6),随着米诺环素浓度的增加,相同n-HA质量下的实验组pH值降低(P=0.003)。实验组S1-S9的pH值于7~8 d的时间点时趋于相对稳定状态,其中S8组的复合支架的pH值(6.8~7.2)在趋于稳定时更接近健康牙周组织的pH值[10],见图4。

图4 各组支架1~10 d的pH值变化情况
2.2.6 各组支架体外降解性能比较 经过连续10周的降解,显示支架具有一定的生物稳定性,同时随时间推移缓慢降解;随着米诺环素浓度的增加,降解率降低,随着n-HA质量的增加,降解率增加,见图5。

图5 各组支架第10周降解率比较
2.3 复合支架MTT细胞毒性检测小鼠L-929细胞培养的第1天,各实验组间细胞OD值比较差异无统计学意义;培养第3天,S1-S6组复合支架细胞的OD值与对照组比较差异无统计学意义(P=0.65),此时10 μmol/L米诺环素复合支架组(即S7、S8、S9)的OD值到达峰值,随着时间增加OD值在不断降低,抑制了细胞增殖(P=0.007),说明具有一定的细胞毒性。而1 μmol/L、5 μmol/L米诺环素复合支架组(即S1-S6)的OD值在第5天左右达到最高水平,后期则基本保持不变,见图6。
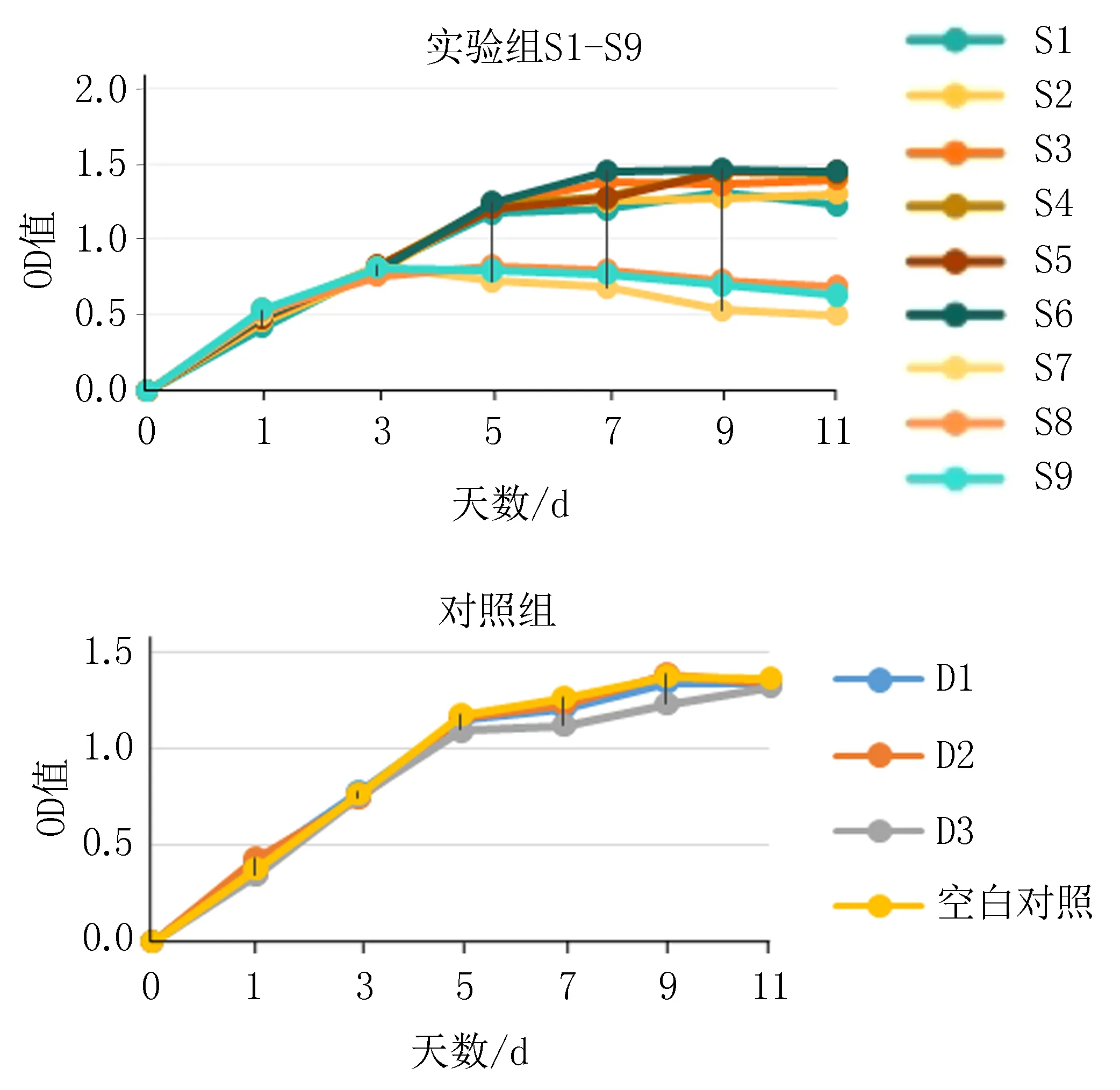
图6 不同浓度米诺环素支架处理后的小鼠L929细胞11 d内增殖情况
S1-S6组的细胞相对增殖率(RGR)均在80%以上,毒性分级为0~1级,细胞毒性评价均合格。S7、S8、S9组RGR的分级中出现了2、3级,其余各组之间细胞增殖率差异无统计学意义,见表3。

表3 各组支架培养小鼠L-929细胞相对增殖率与细胞毒性分级评价
在1~11 d内显微镜下观察细胞形态发现,各组复合支架材料浸提液中的小鼠L-929细胞贴壁生长、增殖情况非常好,第3天时镜下观察细胞数量的差异不大,此后细胞逐渐贴壁生长,多数呈卵圆形或者是梭形,细胞数量开始增多,见图7。

图7 各组支架浸提液中的小鼠L-929细胞形态(×400)
3 讨论
随着骨组织工程的发展,支架作为细胞的载体,主要为细胞提供营养和代谢的化学环境和物理支撑;利用支架材料修复骨组织损伤的过程中,支架是决定缺损部位组织结构能否实现重建、恢复组织再生能力的关键性因素,同时也为细胞的黏附、生长、增殖、迁移、分化等生物学功能提供有利场所[11-12]。支架的组成材料及复合方式决定了支架的内部结构,同样也决定着其物理性质和机械性能。本实验通过3D打印技术完成羟基磷灰石、壳聚糖、米诺环素材料的结合,成功构建了复合载药支架。
对复合支架试验研究中发现,3D打印不同质量n-HA/CS/米诺环素复合支架具有良好的物理、化学、细胞毒性低的性能,力学检测中随着n-HA质量的增加,对照组支架的拉伸强度和最大载荷均有不同程度的降低,实验组S1-S6复合支架拉伸强度随米诺环素增加而增大,当米诺环素的浓度持续加至10 μmol/L后,S7、S8、S9组拉伸强度反而降低;随着n-HA质量的增加,吸水率呈逐渐下降趋势,同一n-HA质量下实验组的吸水率随着米诺环素浓度的增高缓慢增加,但随着时间的延长,各实验组吸水率又慢慢降低;相同n-HA质量下的实验组pH值随米诺环素浓度的增加在降低;随着米诺环素浓度的增加,降解率降低,随着n-HA质量的增加,降解率反而增加;MTT细胞毒性检测中,低浓度米诺环素实验组与对照组差异不大,当米诺环素浓度为10 μmol/L时,实验组OD值在3 d后出现抑制细胞增殖的情况,有细胞毒性。
有研究表明,米诺环素、壳聚糖、纳米羟基磷灰石的降解速率依次降低,随着米诺环素、壳聚糖比例的增加,支架材料的降解率变快,可能由于这两种材料有较好的亲水能力[13-14]。因此控制好米诺环素、壳聚糖、纳米羟基磷灰石的质量比例,使得降解速度与成骨速率相当,这样才能有效地修复骨缺损,从而做到在支架材料降解的同时有新骨进入生长。
本实验中MTT浸提比例的问题还有待研究,马凤森等[15]的研究认为可降解材料在体内的降解与吸收是一个动态平衡过程,研究其浸提比例应该引起人们的重视。本实验未能详细研究浸提液比例的分组实验,在后期会进一步完善。
本次构建的支架还需进行后续的动物实验来进行种植体周围炎的骨缺损的修复,观察支架能否进行3D个性化打印并帮助支持骨恢复原有状态[16]。米诺环素不仅能够抑制种植体周围炎的致病菌,还能够促进牙周膜细胞的增殖[17-18],所以动物实验时会着重观察支架的植入是否会抑制植体周围的致病菌和能否促进成植体周围的成骨细胞生长、增殖[19]。在本课题组的后续实验中将精进实验进一步提供有用的实验数据。
综上,3D打印的n-HA/CS/米诺环素复合支架有较好的物理性能及亲水性,未来可能会成为治疗口腔种植体周围炎骨缺损的一种性能更为优良的修复材料,但该复合支架对种植体周围炎的相关性能表现及临床应用仍需做进一步的探讨和实验。

