厄尔尼诺-南方涛动对秘鲁外海茎柔鱼耳石形态的影响
李建华,高春霞,刘必林,王 岩,张伊宁
(1.上海海洋大学海洋科学学院,上海 201306;2.农业农村部大洋渔业开发重点实验室,上海 201306;3.大洋渔业资源可持续开发教育部重点实验室,上海 201306;4.国家远洋渔业工程技术研究中心,上海 201306;5.大连海洋大学,辽宁大连 116023)
茎柔鱼(Dosidicus gigas)是柔鱼科(Ommastrephidae)的一种重要经济捕捞种类,广泛分布于东太平洋加利福尼亚(37°N)至南智利(47°S)、南北美洲海岸线至140°W 的上升流及高饵料丰度海域[1-3]。同时,秘鲁外海茎柔鱼具有在夏秋季向浅岸洄游、冬季向深水洄游的季节性洄游特征[4]。茎柔鱼仅有1~2年的短生命周期,因此其整个生活史过程对栖息地环境以及大尺度气候事件的变化极为敏感[5-6]。已有研究发现,厄尔尼诺-南方涛动(El Niño-Southern Oscillation,ENSO)事件会影响茎柔鱼渔场环境,进而造成其资源发生空间上的变化[7]。目前已有使用外部轮廓分析法比较不同年间秘鲁外海茎柔鱼耳石形态差异的报道[8],但未见采用传统形态法分析ENSO事件对秘鲁外海茎柔鱼耳石影响的报道。因此,本研究依据我国鱿钓船于2013—2016年和2020年在秘鲁外海生产期间采集的茎柔鱼的耳石作为研究对象,通过传统形态分析法分析不同ENSO事件年间秘鲁外海茎柔鱼耳石形态差异,并分析其生长特性的年间差异,以期为秘鲁外海茎柔鱼渔业生物学及基于耳石形态的茎柔鱼种群鉴定研究提供基础数据支持。
1 材料与方法
1.1 采样时间和范围
选取2013—2016年和2020年7—11月的秘鲁外海茎柔鱼样本进行实验分析,样本由中国远洋渔业鱿钓技术组提供,均采集于秘鲁外海,采样时间、数量、站位信息如表1所示。每一站点所采集的样本均从渔获物中随机取样,采集后的茎柔鱼样本直接在鱿钓船上冷冻,随后通过运输船运回实验室进行实验分析。
1.2 ENSO事件
根据美国国家海洋和气候大气管理局(National Oceanic and Atmospheric Administration,NOAA)网站(https://origin.cpc.ncep.noaa.gov/products/analysis_monitoring/ensostuff/ONI_v5.php)发布的尼诺指数(Niño index,NI)可知,当NI>0.5即为发生厄尔尼诺事件,当NI<-0.5即为发生拉尼娜事件,当-0.5≤NI≤0.5时,即为正常时期。因此将采样时间分为3类年份,2013和2014年为正常年份,2015年为厄尔尼诺年,2016年和2020年为拉尼娜年,其中2016年为厄尔尼诺转拉尼娜年,2020为正常转拉尼娜年。
1.3 研究方法
1.3.1 生物学测定和耳石提取
将样本在实验室室温下自然解冻,以防止外界因素对茎柔鱼样本造成影响。解冻后对茎柔鱼进行生物学测定,测定内容包括胴长(mantle length,ML)、体质量(body weight,BW)、性别以及性腺发育程度,其中,胴长测定数值精确到1mm,体质量测定数值精确到1 g,性腺发育程度测定根据LIPIN'SKI和UNDERHILL[9]的鉴定方法,将茎柔鱼的性腺发育分为5个阶段(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期和Ⅴ期),Ⅰ~Ⅱ期为未成熟阶段,Ⅲ~Ⅴ期为成熟阶段。从茎柔鱼头部的平衡囊内取出耳石后,放入盛有75%浓度的乙醇溶液的离心管中进行保存,以除去耳石表面附着的软膜和有机物质。
1.3.2 耳石外部形态测量
对左、右耳石进行t检验显示,左、右耳石形态学指标无显著差异(P>0.05),因此,统一选取左侧耳石进行分析。将去除附着物的耳石置于奥林巴斯CX23显微镜下以40倍放大进行电荷耦合器(charge-coupled device,CCD)拍照,利用FCSnap专业测量软件进行耳石形态测定,测定的9个形态参数如图1所示,包括耳石总长(total statolith length,TSL)、最大宽度(maximum width,MW)、翼区长(wing length,WL)、翼区宽(wing width,WW)、吻区长(rostrum length,RL)、吻区宽(rostrum width,RW)、背侧区长(dorsal lateral length,DLL)、侧区长(lateral dome length,LDL)和吻侧区长(rostrum lateral length,RLL)。形态参数由两人分别测量,若两者测得结果误差超过5%,则重新测量,最终取两者测量的平均值,测量结果精确到1μm。

图1 茎柔鱼耳石各区和形态参数示意图Fig.1 Dome and morphometric parameters of D.gigas’s statolith
1.4 数据处理
1.4.1 耳石形态差异分析
为消除茎柔鱼个体差异对耳石形态值的影响,采用标准化公式对茎柔鱼各个耳石形态参数进行标准化:
式中,Yi和分别表示第i个个体标准化前和标准化后的耳石形态参数值,MLm和MLi分别表示胴长的平均值和个体i的胴长值,b为回归参数,具体参考LLEONART等[10]的文献。利用Levene’s法进行方差齐性检验,不满足齐性方差时将数据反正弦或平方根处理,同时进行正态检验,利用单因素方差分析(one-way ANOVA)对不同年份耳石形态参数进行差异分析。文中标准化后的形态参数以形态参数加下标小写字母s表示,如TSLs表示标准化后的TSL。
1.4.2 主成分分析
为探究表征秘鲁外海茎柔鱼耳石的形态参数,对5年样本进行主成分分析。
1.4.3 耳石生长差异分析
根据主成分分析结果,利用不同的生长模型(线性、指数、对数、幂函数)拟合耳石形态参数与胴长之间的关系。根据赤池信息准则(Akaike information criterion,AIC)选取最适方程,利用协方差分析(ANCOVA),以各个耳石形态参数作为协变量,分析不同海洋环境年茎柔鱼耳石的生长差异。
2 结果与分析
2.1 耳石形态特征分析
通过对标准化后的耳石形态值进行ANOVA方差分析发现,雌、雄个体间各个形态参数不存在显著差异(P>0.05),因此下述分析不区分性别。由图1可知,茎柔鱼的耳石具有柔鱼科耳石共性的外部形态特征,即具有明显的翼区、吻区、背区和侧区。通过TSLs和MWs来看,拉尼娜年(2016年和2020年)耳石偏小,而厄尔尼诺年(2015年)耳石偏大,正常年份(2013年和2014年)耳石大小居中(表2)。
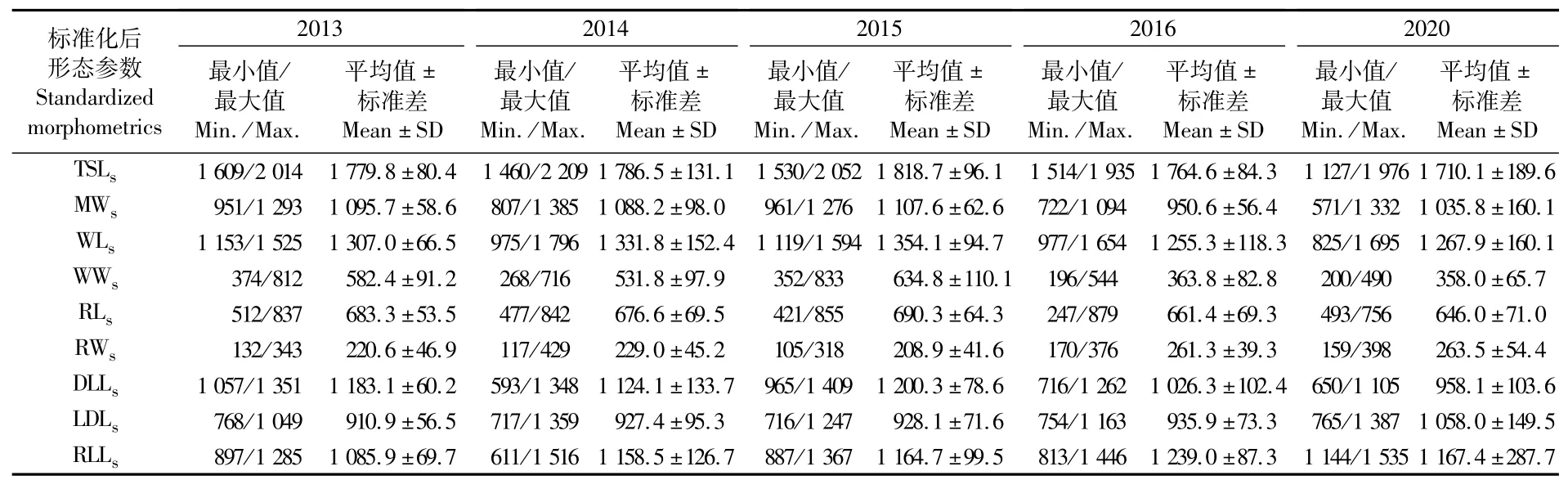
表2 不同年份茎柔鱼标准化后的耳石形态参数Tab.2 Standardized morphometrics of statolith of D.gigas in different years(μm)
表3为不同年份茎柔鱼耳石形态方差分析结果。多重比较(Tukey-HSD)发现,拉尼娜年(2016年和2020年)与其他各年间存在显著差异的形态参数最多,且2016年和2020年的耳石间也存在有显著性差异的形态参数。相比拉尼娜年份,正常年份之间(2013年和2014年)耳石形态则较为相似,仅有少数形态参数存在显著差异。

表3 不同年份茎柔鱼耳石形态参数方差分析Tab.3 Variance analysis of statolith morphometrics of D.gigas in different years
2.2 主成分分析
茎柔鱼耳石9个形态参数的主成分分析结果如表4所示,5个因子解释形态值的贡献率分别为40.043%、26.366%、11.827%、8.587%和4.283%,累计贡献率达91.106%。第1主成分中,TSL负荷值最大,RW 负荷值最小;该主成分与各个形态参数均呈正相关。第2主成分中,WW 的负荷值最大;第2主成分与WW、DLL呈正相关,与RW、RLL呈负相关。第3主成分中,RL负荷值最大,且第3主成分与RL呈负相关。第4主成分中,RW 负荷值最大,且第4主成分与RW呈正相关。第5主成分中,DLL负荷值最大,且第5主成分与DLL呈负相关。

表4 茎柔鱼耳石9个形态参数的5个主成分负荷值和贡献率Tab.4 Loading values and contribution rates of 5 principal components for 9 m orphologic parameters of D.gigas’s statolith
根据主成分负荷值大小,选取负荷值较大的形态参数作为表征参数。因此,秘鲁外海茎柔鱼耳石长度表征参数为TSL、RL和DLL,耳石宽度表征参数为WW 和RW。
2.3 耳石形态与胴长的关系
总体上,茎柔鱼耳石各区随着胴长的增加而增大,拟合结果显示,5个形态表征参数中,TSLs、DLLs和WWs与胴长之间存在显著相关性(P<0.05),而RLs和RWs与胴长之间不存在显著相关性(P>0.05)。根据AIC准测,选取最适生长方程,结果如表5所示。其中,2013年和2015年均为线性模型;2014年和2020年均为指数模型;2016年,TSLs与胴长的关系为指数模型,WWs与胴长的关系为线性模型,DLLs与胴长的关系为幂函数模型。从协方差分析(ANCOVA)结果发现,3个耳石形态参数与胴长的关系在不同年间均存在极显著差异(P<0.01)。
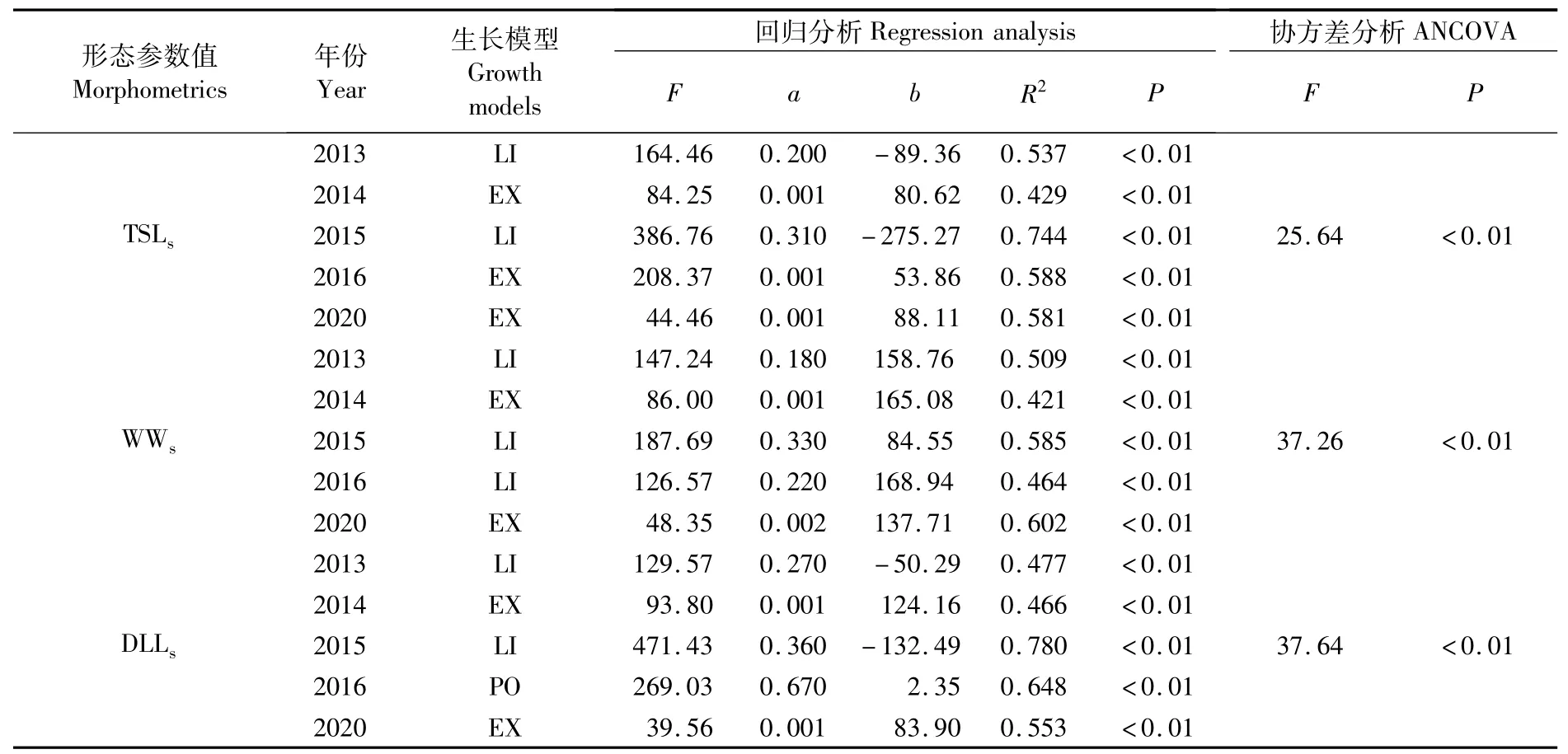
表5 不同海洋环境年茎柔鱼耳石形态参数与胴长之间的生长模型Tab.5 G row th models ofm orphometrics and mantle length of D.gigas in differentmarine environm ent years
2.4 不同海洋环境年耳石形态差异
2.4.1 耳石整体形态差异
如图2-A所示,厄尔尼诺年(2015年)耳石整体形态偏大,具有较大的TSL和MW;正常年份(2013年和2014年)耳石大小居中;而拉尼娜年(2016年和2020年)耳石整体形态偏小,其中,2016年的TSL和MW 为各年中最小。

图2 不同海洋环境年茎柔鱼耳石形态差异Fig.2 M orphological differences of D.gigas’s statolith in differentmarine environment years
2.4.2 耳石翼区形态差异
如图2-B所示,厄尔尼诺年(2015年),茎柔鱼耳石的翼区较大;正常年份(2013年和2014年)的翼区较厄尔尼诺年(2015年)小;拉尼娜年(2016年和2020年),耳石的翼区最小。
2.4.3 耳石吻区形态差异
如图2-C所示,厄尔尼诺年(2015年),耳石具有长且窄的吻区;拉尼娜年(2016年和2020年),耳石具有短且宽的吻区;正常年份(2013年和2014年)的吻区大小介于两个气候事件年耳石吻区大小之间。
3 讨论
3.1 耳石形态特征
耳石作为头足类重要的硬组织之一,被广泛应用于头足类种群鉴别、年龄鉴定以及空间分布推测等研究[11-13]。不同头足类耳石各区的大小不完全相同[14]。茎柔鱼的耳石与同科的北太平洋柔鱼(Ommastrephesbartramii)一样,均具有明显的翼区、吻区、背区和侧区4个主要分区[15]。与本研究茎柔鱼耳石相比,阿根廷滑柔鱼(Illex argentinus)背区较小,吻区下端未超过翼区[16]。
有研究表明,耳石形态特征与头足类栖息水层有关,因此,生活在上层水域的茎柔鱼具有长且窄的吻区和宽大的翼区[17-18]。ARKHIPKIN 和BJORKE[19]发现,头足类的耳石在幼体阶段呈水滴状。随着个体生长,耳石逐渐增大,各区逐渐形成[20]。然而,茎柔鱼生长过程中耳石的生长速度存在变化,贾涛等[21]发现,哥斯达黎加外海茎柔鱼260~300 mm的个体耳石生长速度较快,随后呈减慢的趋势;王韫沛等[18]发现,东太平洋赤道海域茎柔鱼耳石生长速度随胴长增加先由快变慢,在胴长大于350 mm后耳石生长速度又加快。这种生长“拐点”的不同,可能是造成不同头足类耳石形态差异和不同海域同种头足类耳石形态差异的原因[18,22-23]。
3.2 形态表征参数选取
通过主成分分析选取出的代表耳石形态的表征参数已被广泛应用于头足类耳石形态研究[15,18,24-29]。本研究通过主成分分析筛选出TSL、RL和DLL作为耳石长度表征参数,WW 和RW 作为耳石宽度表征参数,说明耳石总长、翼区和吻区的变化能够较好地反映耳石形态变化。研究表明,不同头足类的耳石形态表征参数不同,其中TSL作为主要的耳石长度参数,被广泛选取为头足类耳石形态表征参数(表6),说明TSL 是表征耳石形态特征最显著的指标[15,18,24-29]。不同海域的同种头足类耳石形态表征参数选择也存在差异,哥斯达黎加外海、智利外海、东太平洋赤道海域以及本研究中秘鲁外海的茎柔鱼均选择TSL为耳石长度表征参数,而其他表征参数则不完全相同[18,24-25]。这可能是由于茎柔鱼个体差异导致的,研究表明,东太平洋赤道海域和哥斯达黎加外海茎柔鱼个体远小于秘鲁和智利外海海域[18,30]。除个体大小因素外,季节性捕捞和海域环境差异也可能是造成这种现象的原因,目前尚未见相关结论报道,因此后续还需深入开展不同海域同种头足类耳石形态表征参数选取研究。
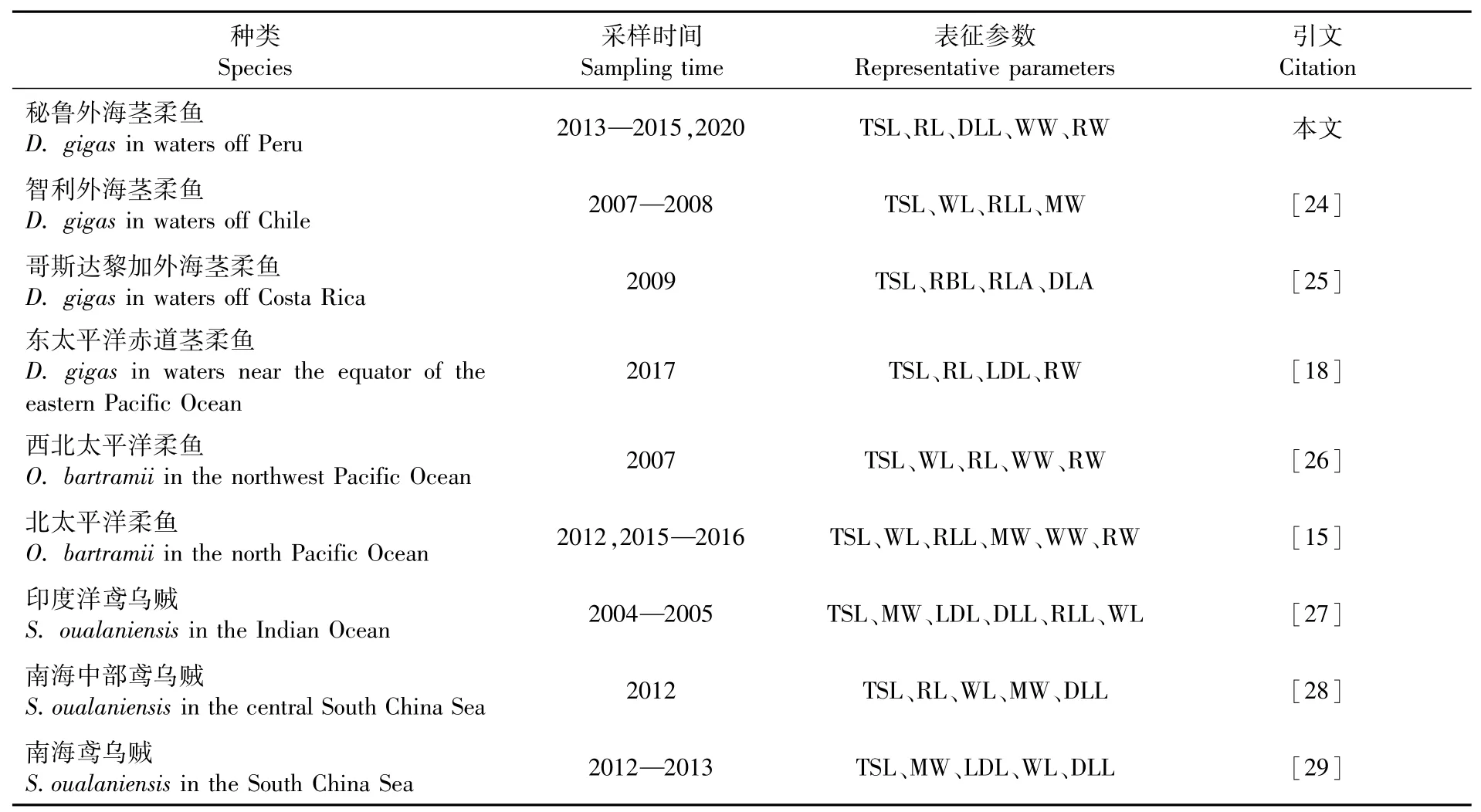
表6 不同头足类耳石的形态表征参数Tab.6 M orphological representative parameters of statolith for different cephalopods
3.3 ENSO对耳石形态的影响
ENSO事件是太平洋主要的气候事件之一,对该海域内的渔业资源丰度、空间分布及栖息地环境都会造成影响[31-32]。在厄尔尼诺和拉尼娜事件的影响下,短生命周期的茎柔鱼资源量发生巨大波动[33]。有研究表明,北太平洋柔鱼在不同气候条件下,资源量发生变动的同时,其耳石的形态特征和生长也存在着年间差异[15],本研究结果与其一致。同时,本研究还发现,耳石形态参数与胴长的关系在不同年间也存在显著差异(表5),茎柔鱼的个体生长可能对这种关系造成影响,另外,这种现象也可能是由于外界环境变化导致的。相关研究发现,耳石的形态会受到外界环境因素如温度、二氧化碳以及海洋酸化等的影响[34-36]。比如,水温等海洋环境因素变化可能影响不同年间茎柔鱼的耳石沉积速率,进而导致耳石形态存在差异。此外,秘鲁外海茎柔鱼主要栖息于上升流海域,厄尔尼诺发生期间,海平面上升,升高的水温会导致上升流速度变慢,从而降低了浮游植物的密度[32]。而拉尼娜发生期间,上升流相对较强,浅层营养盐较为充足,初级生产力较高,形成了适宜茎柔鱼生长的环境条件[32,37]。汪惠琼等[38]研究发现,发生厄尔尼诺的年份茎柔鱼的营养级较正常年份低,这可能使得茎柔鱼的生长产生年间差异,间接导致耳石形态与胴长关系产生差异。
本研究发现,厄尔尼诺年(2015年),茎柔鱼耳石具有长且窄的吻区以及较大的翼区;拉尼娜年(2016年和2020年),茎柔鱼耳石具有短且宽的吻区以及较小的翼区;正常年份(2013年和2014年)的耳石形态介于这二者之间。这与胡贯宇[8]利用外部轮廓分析法得出的结果一致。耳石能够调节头足类淋巴液流动,感知游泳加速度,头足类活动能力强时,对耳石感知加速度的需求降低,因此耳石生长可能较慢;反之,当其活动能力弱时,对耳石感知加速度的需求升高,导致耳石生长加快[39]。海水温度升高除了会影响头足类食物丰度,还会影响大洋性头足类的游泳能力和垂直分布:厄尔尼诺事件的发生导致水温异常变化,可能会限制茎柔鱼的游泳能力,使厄尔尼诺年的茎柔鱼栖息于水深较浅的海域以保证其昼夜垂直移动的行为;而拉尼娜事件发生期则相反[32,37,40-41]。有研究表明,耳石形态可能与头足类所处水层深度有关,底层种类具有较大的耳石、短且宽的吻区以及较窄的翼区;上层种类具有较小的耳石、长且窄的吻区以及较宽的翼区[14,42]。陆化杰等[17]通过对比不同种类的头足类耳石各区的大小情况,发现柔鱼类耳石形态特征与其栖息水深有密切关联,也验证了这一观点。因此,ENSO事件所引起的环境变化可能会从摄食生态和游泳能力等方面限制茎柔鱼的摄食和空间分布,进而导致茎柔鱼的耳石形态产生差异。
本研究初步分析了ENSO事件可能对茎柔鱼耳石形态造成的影响,为后续利用耳石进行茎柔鱼种群鉴定、生活史研究提供了科学依据,也为研究气候变化对头足类硬组织生长的影响提供了参考。在将来的研究中,拟建立海洋环境因子对耳石形态参数影响的效应模型,进而分析影响因子的主次性,以期为茎柔鱼的生态学研究提供更多的数据支持。

