基于HPLC指纹图谱及网络药理学的杜仲质量标志物预测分析
曾 梅,王朝晖,2,王志辉,2,龙雨青,曾 娟,周新茹,周日宝,2,3*,刘湘丹,2,3*
1湖南中医药大学药学院;2湘产大宗道地药材种质资源及规范化种植重点研究室;3湖南省普通高等学校中药现代化研究重点实验室,长沙 410208
杜仲(EucommiaulmoidesOliv)为杜仲科(Eucommiaceae)杜仲属(Eucommia)植物,单属单种,主产陕西省、四川省、河南省、湖南省、湖北省、重庆市、贵州省、山东省、甘肃省、江苏省和山西省等地,其中湖南慈利为杜仲之乡,杜仲资源丰富。杜仲传统以树皮入药,在我国有两千多年的用药历史,其味甘、性温,有补肝肾、强筋骨、安胎等功效[1]。杜仲叶于2015年新收录入《中华人民共和国药典》,现为药食同源试点品种,市场常见有杜仲茶等产品。杜仲雄花在杜仲产地也常作茶用;杜仲果荚一般作为胶的提取原料。
市场杜仲产品质量参差不齐,2020年版《中华人民共和国药典》中杜仲皮、叶含量测定项下仅对松脂醇二葡萄糖苷、绿原酸进行控制,杜仲化学成分种类较为复杂,制定合理的杜仲质量标准、保障杜仲质量,是亟待解决的问题。
刘昌孝院士于2016年提出了中药质量标志物(Q-Marker)概念[2],后有专家将质量标志物归纳为“五原则”[3],为中药质量控制提供了科学依据。网络药理学是基于系统生物学理论,借助统计学、复杂网络等数学手段,强调对生物系统的网络分析以及反映中药药效成分的理化和生物学性质,在分子水平上诠释中药多成分与机体的网络作用关系,为探索中药复杂作用模式提供了新的视角[4];指纹图谱是目前较为成熟的发现不同批次产品共有成分的方法。
基于此,本研究采用高效液相色谱(HPLC)法建立杜仲(皮、叶、果荚、雄花)的指纹图谱,再利用网络药理学方法对杜仲成分、靶点、通路进行整理分析方法预测杜仲不同部位潜在的Q-Marker,从而建立杜仲(皮、叶、果荚、雄花)的质量控制研究方法,以期为杜仲(皮、叶、果荚、雄花)的质量控制以及作用机制研究提供参考。
1 材料与方法
1.1 仪器
高效液相色谱仪(Agilent1260二极管阵列检测器,德国安捷伦公司);ZORBAX Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 μm)。
1.2 材料
对照品桃叶珊瑚苷(批号19122404,质量分数≥98%)、京尼平苷酸(批号19101402,质量分数≥98%)、绿原酸(批号19101402,质量分数≥98%)、京尼平苷(批号21092708,质量分数≥98%)、松脂醇二葡萄糖苷(批号20011401,质量分数≥98%)、芦丁(批号18071907,质量分数≥98%)、紫云英苷(批号20121602,质量分数≥98%)、槲皮素(批号21032401,质量分数≥98%),均购于成都普菲德生物科技公司;磷酸(天津市恒心化学试剂制造有限公司,分析纯);甲醇(国药集团化学试剂有限公司,分析纯);乙腈(色谱纯)。
28批不同品种、不同产地杜仲叶样品、15批不同产地及采收期杜仲皮样品、10批不同产地杜仲果荚样品、10批不同产地及采收时间杜仲雄花样品,经湖南中医药大学周日宝教授鉴定为杜仲(EucommiaulmoidesOliv.)的不同部位。样品具体信息见表1。

表1 杜仲不同部位样品信息表Table 1 Sample information of different parts of E.ulmoides
1.3 杜仲不同部位指纹图谱研究
1.3.1 对照品溶液制备
精密称取对照品适量,用甲醇溶解分别制得浓度为0.024 0 mg/mL桃叶珊瑚苷溶液,0.075 0 mg/mL京尼平苷酸溶液,0.205 0 mg/mL绿原酸溶液,0.002 4 mg/mL京尼平苷溶液,0.010 6 mg/mL松脂醇二葡萄糖苷溶液,0.013 9 mg/mL芦丁溶液,0.005 5 mg/mL紫云英苷溶液,0.003 0 mg/mL槲皮素溶液,经0.45 μm微孔滤膜过滤,密封,低温避光保存,备用。
1.3.2 供试品溶液的制备
收集新鲜杜仲叶、皮、果荚、雄花样品,烘干,粉碎,精密称取样品粉末(过80目筛)0.5 g置100 mL锥形瓶中,精密加入甲醇12 mL后称重,超声提取30 min后取出,冷却、称重,损失的质量用甲醇补足后摇匀,滤过。取滤液在离心机中以4 000 r/min离心5 min,取上清液过0.45 μm滤膜,密封,低温避光保存,备用。
1.3.3 指纹图谱色谱条件
采用Supersil ODS-B100A色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-0.1%磷酸水溶液(B),采用梯度洗脱(0~12 min,5% A→8% A;12~17 min,8% A→11% A;17~25 min,11% A→13% A;25~28 min,13% A→14% A;28~40 min,14% A→14.5% A;40~41 min,85.5% A→14.5% A;41~56 min,20% A→30% A;56~65 min,30% A→24% A;65~66 min,76% A→95% A;66~67 min,5% A→5% A);体积流量为1.0 mL/min;柱温30 ℃;进样量10 μL;检测波长(0~8 min,207 nm;9~30 min,237 nm;31~40 min,207 nm;41~57min,320 nm;58~67 min,360 nm)。
1.4 基于网络药理学预测杜仲不同部位潜在Q-Marker
1.4.1 杜仲不同部位潜在质量标志物来源定位
通过文献查阅,定位杜仲不同部位潜在质量标志物。
1.4.2 候选化合物靶点预测
通过数据库对8个目标化合物筛选,合并筛选出的靶点蛋白并去除重复靶点,得到与8个化合物相关的173个靶点蛋白。
1.4.3 靶点蛋白与蛋白互作(PPI)网络分析
将筛选出的靶点导入STRING11.0(https://string-db.org/cgi/input.pl)数据库后做PPI分析,设置物种为“Homo sapiens”,隐藏网络中无联系的节点,其余参数设置不变,获得核心靶点PPI网络图,并将得出的结果导入Cytoscape 3.9.1软件,然后用Network Analyze进行网络拓扑学分析,计算度值(degree)、介数中心性(betweenness centrality)和接近中心性(closeness centrality)等参数对蛋白相互作用进行可视化处理。
1.4.4 功能富集分析与通路分析
基因本体(gene ontology,GO)功能富集分析主要用于描述基因靶点的功能,包括分子功能(molecular function,MF)、生物过程(biological process,BP)、细胞组分(cellular component,CC)三个部分。京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析可以得到潜在靶点所富集的信号通路。将筛选得到的靶点导入Metascape数据库(http://metascape.org/)进行GO功能富集分析和KEGG通路富集分析,P<0.01表示具有统计学意义,按照P值大小对结果进行排序,并进行可视化。
1.4.5 分子对接验证
综合网络药理学结果及杜仲药效考虑,选择核心靶标作为分子对接验证的靶标蛋白,将筛选出的潜在质量标志物与选择的蛋白进行分子对接。
2 结果
2.1 杜仲不同部位指纹图谱研究
2.1.1 精密度考察
精密称S12样品0.5 g,用“1.3.2”提取方法制备供试品溶液,在“1.3.3”液相色谱条件下进样,连续6次,记录色谱图。以绿原酸为参照峰,测得13个共有峰相对保留时间的RSD在0.02%~0.08%,相对峰面积的RSD在0.05%~2.29%,表明仪器精密度良好。
2.1.2 重复性试验
取S12样品6份,每份精密称取0.5 g,用“1.3.2”提取方法制备供试品溶液,在“1.3.3”液相色谱条件下进样,记录色谱图。以绿原酸为参照峰,测得13个共有峰相对保留时间的RSD在0.02%~0.08%,相对峰面积的RSD在0.68%~2.86%,表明该方法重复性良好。
2.1.3 稳定性试验
精密称取S12样品0.5 g,用“1.3.2”提取方法制备供试品溶液,在“1.3.3”液相色谱条件下进样,分别于0、2、4、8、12、24 h进样,进行色谱分析,记录色谱图。以绿原酸为参照峰,测得13个共有峰相对保留时间的RSD在0.02%~0.07%,相对峰面积的RSD在0.54%~3.01%,表明供试品溶液在24 h内稳定性良好。
2.1.4 参照峰选择
在不同部位杜仲色谱图中绿原酸的峰分离良好,峰形稳定,峰面积较大且为所有样品共有,所以确定绿原酸的峰为参比峰(S)。
2.1.5 杜仲不同部位HPLC指纹图谱的建立及相似度评价
取杜仲不同部位样品,用“1.3.2”提取方法制备供试品溶液,在“1.3.3”液相色谱条件下进样,记录63批样品的色谱图,采用“中药色谱指纹图谱相似度评价系统软件”(2012版)分别对杜仲不同部位样品HPLC色谱图进行多点校正,色谱峰匹配(时间宽度为0.10),用中位数法生成对照图谱R,计算相似度,建立杜仲不同部位的特征图谱,28批杜仲叶样品标定了13个共有峰,15批杜仲皮样品标定了12个共有峰,10批杜仲雄花样品标定了10个共有峰,10批杜仲果荚样品标定了8个共有峰。叶样品相似度0.922~0.999,皮样品相似度0.954~0.998,果荚样品相似度0.928~0.998,雄花样品相似度0.959~0.999,相似度均>0.9,说明不同部位杜仲样品之间相似度良好。杜仲不同部位色谱叠加见图1,杜仲不同部位对照特征图谱见图2(标出的峰为共有峰),不同部位样品相似度评价结果见表2。
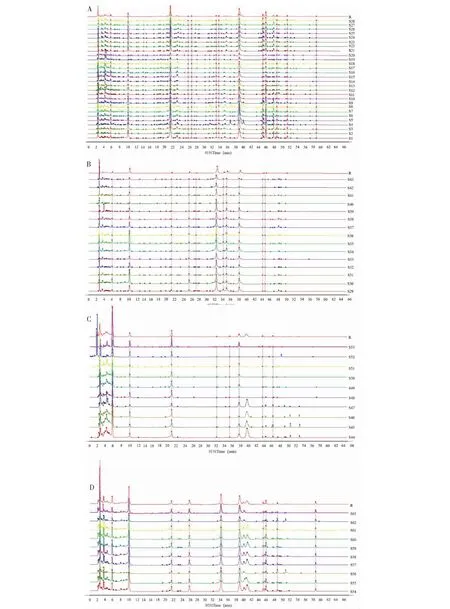
图1 杜仲不同部位HPLC指纹图谱Fig.1 HPLC fingerprints of different parts of E.ulmoides注:A-叶;B-皮;C-果荚;D-雄花。Note:A-Leaf;B-Bark;C-Fruit pod;D-Male flower.
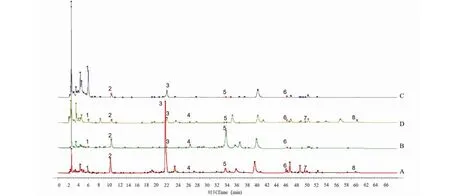
图2 杜仲不同部位对照特征图谱Fig.2 Control fingerprint of different parts of E.ulmoides注:A-叶;B-皮;C-果荚;D-雄花。1-桃叶珊瑚苷;2-京尼平苷酸;3-绿原酸;4-京尼平苷;5-松脂醇二葡萄糖苷;6-芦丁;7-紫云英苷;8-槲皮素(图3同)。Note:A-Leaf;B-Bark;C-Fruit pod;D-Male flower.1-Aucubin;2-Geniposidic acid;3-Chlorogenic acid;4-Geniposide;5-Pinoresinol diglucoside;6-Rutin;7-Astragalin;8-Quercetin (Same as Fig.3).
2.1.6 部分特征峰指认
进一步确认杜仲样品特征峰的化学信息,采用HPLC对杜仲叶样品对照特征图谱中共有峰中的8个色谱峰进行了指认,通过与对照品对照,分别鉴定为桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷、芦丁、紫云英苷、槲皮素,结果见图3。
2.1.7 聚类分析(HCA)
以杜仲叶、皮、雄花、果荚共有峰峰面积为变量运用SPSS 22数据统计软件,采用组间聚类方法,欧氏距离平方法测量样品间距离进行系统聚类分析。结果表明,以距离小于5为标准,将28份杜仲叶样品分为3类,S4、S9分别聚为一类,其余样品为一类;15批杜仲皮样品聚为4类,S29、S31、S34、S35、S36、S41、S42、S43聚为第一类,S30、S32、S39、S40聚为第二类,S33、S38聚为第三类,S37单独聚为第四类;10批杜仲果荚样品聚为3类,S45、S50聚为第一类,S44、S46、S51聚为第二类,S47、S48、S49、S52、S53聚为第三类;10批杜仲雄花样品聚为2类,S55、S57、S58、S60、S62、S63聚为第一类,S59、S61、S54、S56聚为第二类(结果如图4)。不同品种杜仲叶、雄花、果荚不聚为一类,说明不同品种的杜仲样品质量有一定差异,不同产地杜仲叶、皮、雄花、果荚聚为一类,说明不同产地的杜仲不同部位样品质量较为均一,没有明显地域性。
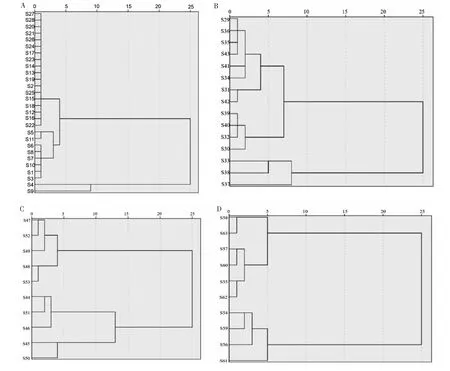
图4 杜仲不同部位聚类分析图Fig.4 Cluster analysis of different parts of E.ulmoides注:叶;B-皮;C-果荚;D-雄花。Note:A-Leaf;B-Bark;C-Fruit pod;D-Male flower.
2.1.8 主成分分析和正交偏最小二乘判别分析
主成分分析法(principal component analysis,PCA)是一种通过降维技术把多个变量化为少数几个主成分(综合变量)的统计分析方法。
将杜仲不同共有峰峰面积导入SPSS 22数据统计软件,以特定的特征值与累计贡献率作为判定依据,对杜仲不同部位样品进行主成分分析。以特征值>1为提取标准,28份杜仲叶样本有3个主成分,其特征值λ1=6.999,λ2=1.778,λ3=1.344,特征值λ1的贡献率为53.841%,λ2的贡献率为13.678%,λ3的贡献率为10.340%,累积贡献率为77.859%;15份杜仲皮样本有4个主成分,其特征值λ1′=6.275,λ2′=1.589,λ3′=1.366,λ4′=1.138,特征值λ1′的贡献率为52.293%,λ2′的贡献率为13,239%,λ3′的贡献率为11.383%,λ4′的贡献率为9.487%,累积贡献率为86.401%;10份杜仲果荚样本筛选出3个主成分,其特征值λ1′′=3.625,λ2′′=1.954,λ3′′=1.268,特征值λ1′′的贡献率为45.316%,特征值λ2′′的贡献率为24.425%,特征值λ3′′的贡献率为15.849%,累积贡献率为85.59%;10份杜仲雄花样本筛选出2个主成分,其特征值λ1′′′=7.215,λ2′′′=1.83,特征值λ1′′′的贡献率为72.151%,特征λ2′′′的贡献率为18.298%,累积贡献率90.449%。筛选出的杜仲不同部位的主成分具有良好代表性,可以反映出杜仲不同部位的综合质量。
以选取的主成分方差贡献率为权重系数,对杜仲不同部位样品主成分得分、综合得分进行分析,并对得分结果进行排序。得分情况反映各批杜仲样本质量情况,质量越好,则分数越高。本研究中,湖南慈利华仲12号杜仲叶药材、慈利江垭杜仲皮药材、华仲10号杜仲果荚、华仲12号雄花样本分别在不同部位样品仲得分最高,质量较好。
将杜仲不同部位样品中共有峰峰面积导入SIMCA多元变量统计软件,得到OPLS-DA得分图和VIP图,结果见图5。R2代表模型的解释能力,Q2代表模型的预测能力,模型中R2和Q2均大于0.5。结果表明,采用PCA-X和OPLS-DA来观察不同部位杜仲样品的自然聚集,28份杜仲叶样品聚为3类,18份杜仲皮样品聚为4类,10份杜仲果荚样品聚为3类,10份杜仲雄花样品聚为两类,且分离更加显著,与HCA结果基本一致。
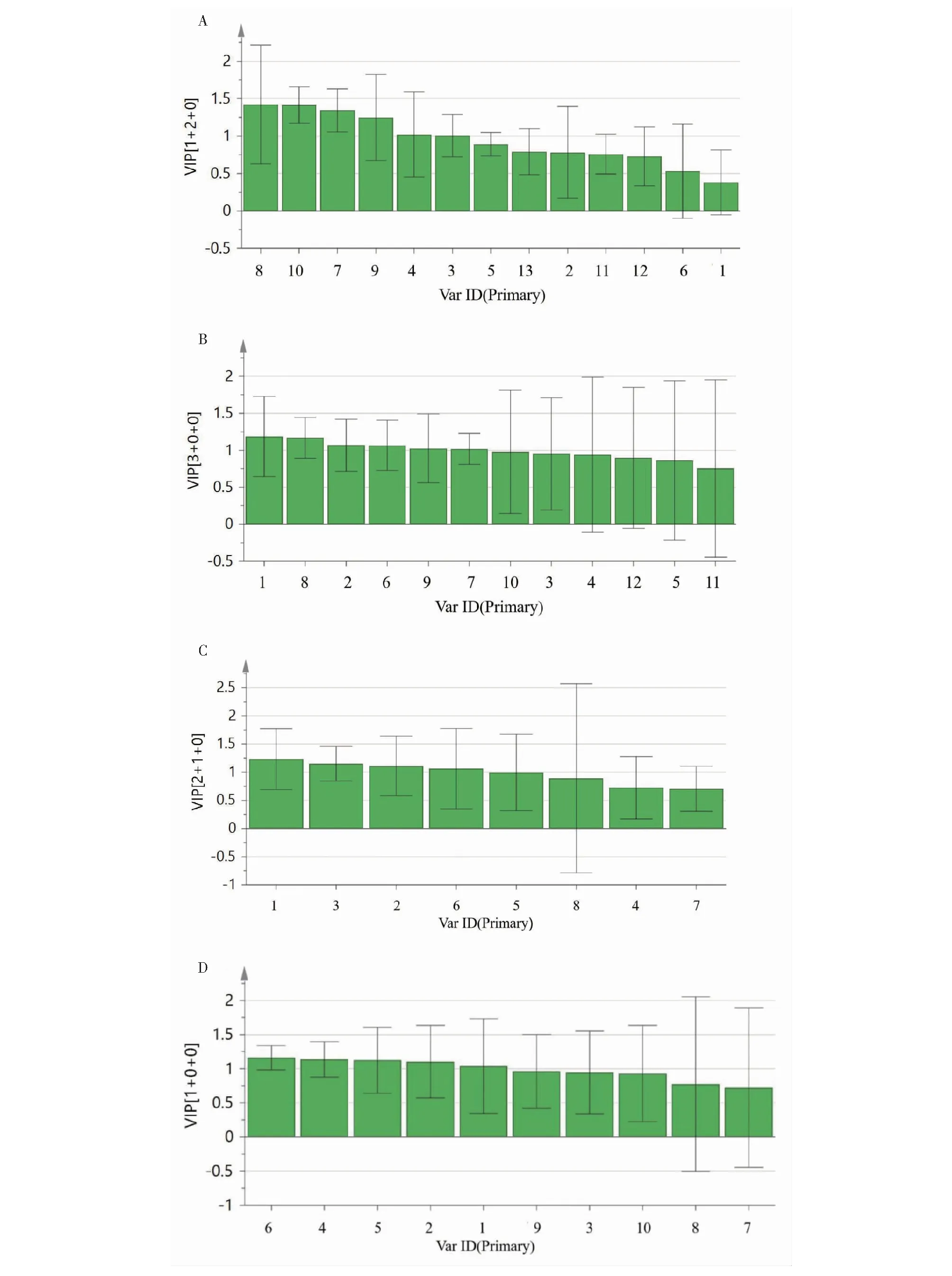
图5 杜仲不同部位的重要性变量Fig.5 Importance variables of different parts of E.ulmoides注:叶;B-皮;C-果荚;D-雄花。Note:A-Leaf;B-Bark;C-Fruit pod;D-Male flower.
为明确不同部位杜仲样品质量差异的物质,结合变量重要性投影法,以VIP值大于1为标准,杜仲叶筛选出贡献较大的6个变量,杜仲皮筛选出贡献较大的6个变量,杜仲果荚筛选出贡献较大的4个变量,杜仲雄花筛选出贡献较大的5个变量。一般VIP值>1的变量为组间样本的主要差异变量,且VIP值越大,表明该成分对组间差异的贡献越大。根据对照品指认结果,杜仲叶样品中共有峰3、4、9号峰,分别对应绿原酸、京尼平苷、芦丁;杜仲皮样品中共有峰1、2、6号峰,分别对应桃叶珊瑚苷、京尼平苷酸、松脂醇二葡萄糖苷;杜仲果荚样品中共有峰3、2、1,分别对应绿原酸、京尼平苷酸、桃叶珊瑚苷;杜仲雄花样品中共有峰2、4、1号峰,分别对应京尼平苷酸、京尼平苷、桃叶珊瑚苷。其中杜仲叶7、8、10号峰,杜仲皮7、8、9号峰,杜仲雄花及果荚中5、6号峰VIP值均大于1,但由于未做液质实验,未能识别出,在接下来的实验中,将会进行该方面研究。说明这些成分在区分不同批次杜仲不同部位样品时起到重要作用,是杜仲的主要标志性成分。
2.2 基于网络药理学预测杜仲不同部位潜在Q-Marker
2.2.1 杜仲不同部位潜在质量标志物来源定位
多项杜仲现代药理研究表明,杜仲中的化学成分主要包括木脂素类、黄酮类、环烯醚萜类、萜类和甾体类、酚酸类、多糖类等。Ma等[5]在研究中将京尼平苷酸、绿原酸、京尼平苷作为杜仲平压片质量评价标准;Liu等[6]测定不同部位化学成分含量时提议将桃叶珊瑚苷、松脂醇二葡萄糖苷作为杜仲雄花、皮的质量控制指标成分;Tu等[7]在杜仲叶抗氧化活性研究中以紫云英苷等8种化学成分作为杜仲叶的加工方式筛选、质控标准。结合HPLC色谱分析结果,最终确定桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷、芦丁、紫云英苷、槲皮素8种成分作为杜仲不同部位质量标志物的潜在来源范围进行分析。
2.2.2 候选化合物靶点预测
通过数据库对8个目标化合物筛选,合并筛选出的靶点蛋白并去除重复靶点,得到与8个化合物相关的173个靶点蛋白。
2.2.3 靶点蛋白与蛋白互作(PPI)网络分析
PPI可视化网络图结果见图6,将度值大于2倍中位数值且degree≥10作为筛选条件,筛选得到11个重要核心靶点,具体包括SRC(degree=21)、HRAS(degree=17)、PIK3R1(degree=16)、CDK1(degree=14)、CASP3(degree=13)、CCNB1(degree=12)、AKT1(degree=11)、CCNA2(degree=11)、CCNB2(degree=11)、EGFR(degree=11)、PTK2(degree=10)。
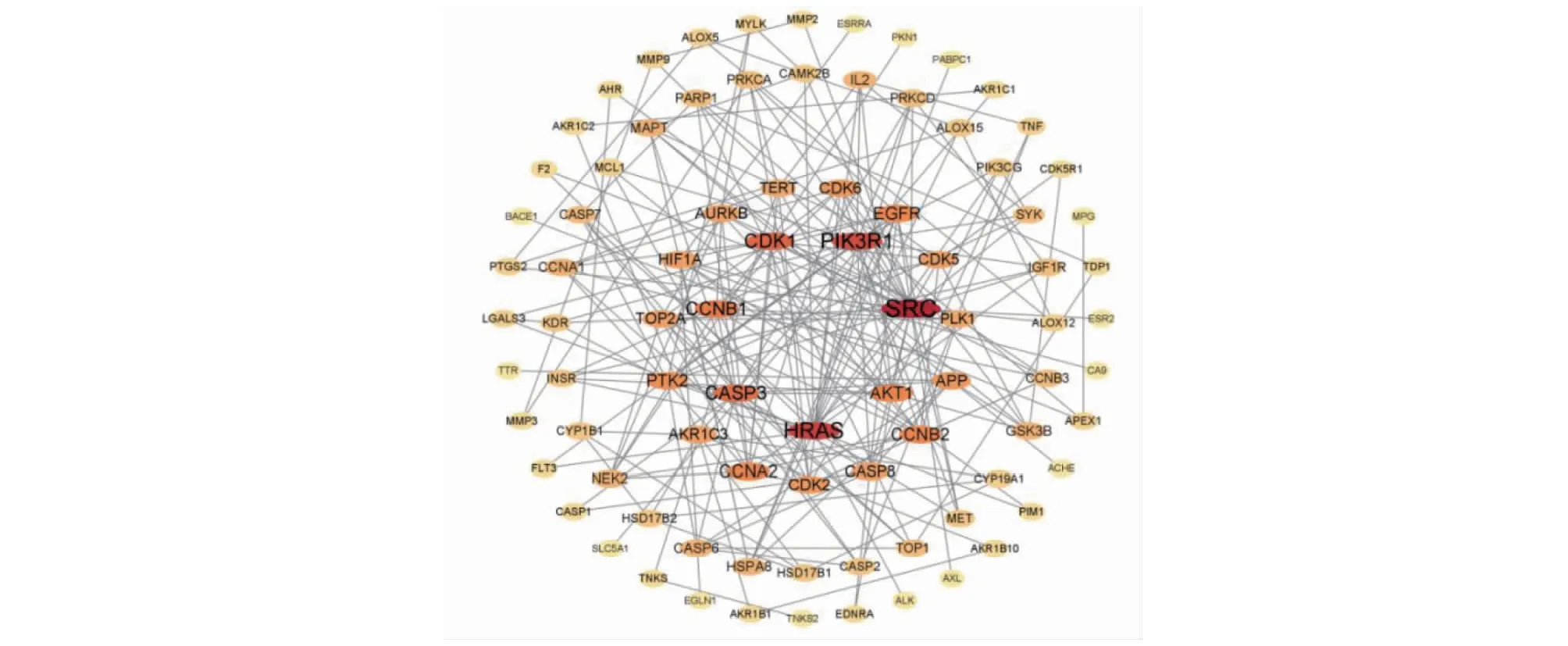
图6 蛋白-蛋白互作网络可视化图Fig.6 Visualization of protein-protein interaction network
2.2.4 功能富集分析与通路分析
GO功能分析中一共获得1 767个条目,其中包括1 487个生物过程(biological process,BP),186个分子功能(molecular function,MF),93个细胞组成(cellular component,CC),GO分析结果提示BP主要集中在蛋白质磷酸化、激酶活性的调节、对无机物的反应、正向调节转移酶活性等功能;MF主要富集在碳酸脱水酶的活动、醇基为受体的磷酸转移酶活性、蛋白激酶活性、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、激酶活性等功能;CC主要涉及周期蛋白依赖性蛋白激酶全酶复合体、蛋白激酶复合体等,分析结果见图7。

图7 GO功能注释柱状图Fig.7 Bar chart of GO function annotations
KEGG富集分析得到168条通路,选择前15条主要的通路进行展示,主要涉及氮代谢、癌症通路、脂质和动脉粥样硬化、癌症蛋白聚糖、PI3K-Akt信号通路、卵巢类固醇生成等,表明这173个靶点可能主要通过调控这些通路来干预相关疾病,结果见图8。
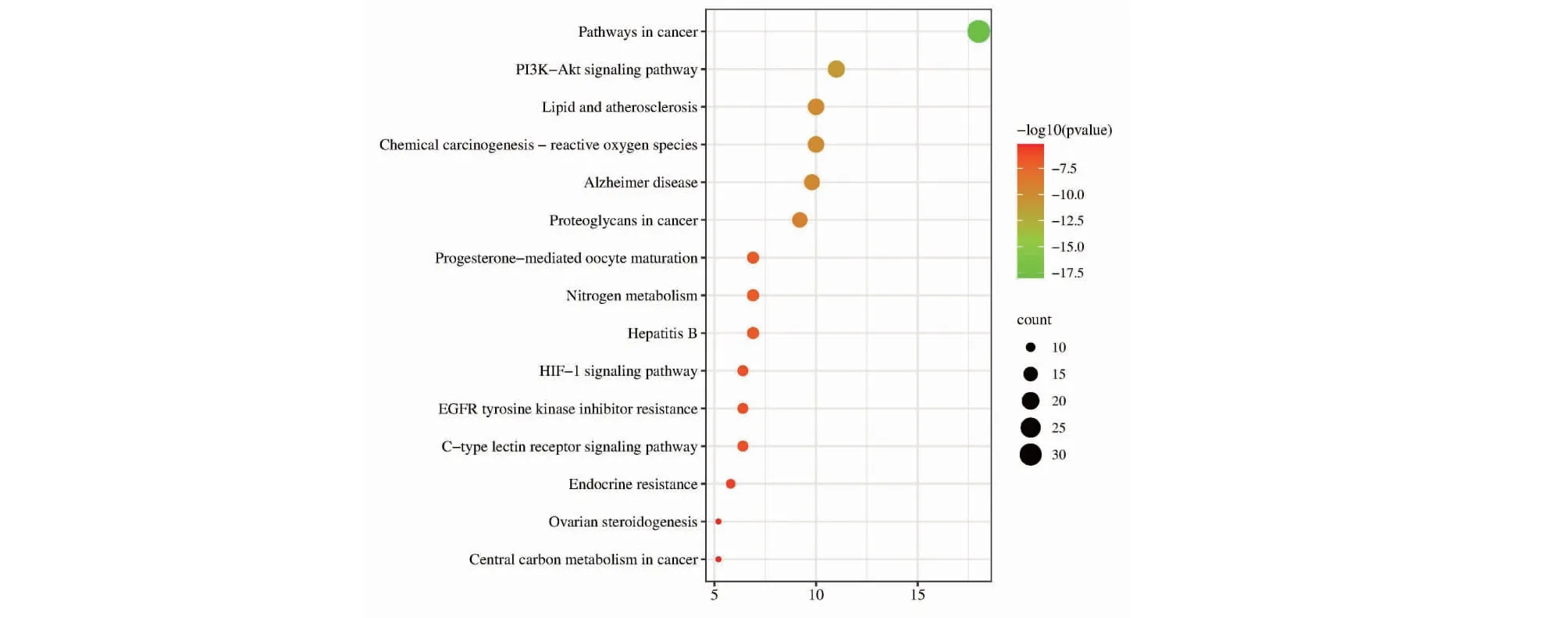
图8 靶标信号通路富集分析气泡图Fig.8 Bubble map of target signal path enrichment analysis
2.2.5 “成分-靶点-通路”网络构建
将筛选得到的8个成分、173个靶点和15条主要通路导入Cytoscape3.7.1软件,建立杜仲“成分-靶点-网络”网络图,结果见图9,由图可知,杜仲作用于多个靶点、多条通路发挥作用。利用Cytoscape 3.9.1分析可知,参考化合物、靶点蛋白、信号通路的连接度(degree),发现槲皮素(degree=103)、芦丁(degree=79)、紫云英苷(degree=77)、桃叶珊瑚苷(degree=60)、京尼平苷(degree=57)、绿原酸(degree=56)、松脂醇二葡萄糖苷(degree=40)、京尼平苷酸(degree=37)均有比较高的连接度,可能是杜仲的活性成分,PIK3R1(degree=15)、HRAS(degree=14)、AKT1(degree=14)、EGFR(degree=13)、SRC(degree=12)这5个靶点的连接度高于其他靶点,表明它们发挥了关键作用。

图9 “成分-靶点-通路”网络图Fig.9 Network diagram of "component-target-pathway"注:红色V形节点代表化学成分;蓝色方形节点代表靶点;黄色圆形节点代表主要通路。Note:Red V-shaped nodes represent chemical components;Blue square nodes represent targets;Yellow circular nodes represent major pathway
2.2.6 分子对接
综合上述网络药理学结果及杜仲药效考虑,选择核心靶标AKT1、SRC、HRAS、ERFR作为分子对接验证的靶标蛋白,将筛选出的8个潜在质量标志物与选择的蛋白进行分子对接,对接结果见表3,对接结合见图10。由对接结果可知8个化合物与蛋白质对接后对接分数(docking score)均<0,说明潜在的质量标志物与AKT1、SRC、HRAS、ERFR均表现出良好的结合作用。

图10 AKT1蛋白与京尼平苷酸、SRC蛋白与绿原酸的对接结果Fig.10 Docking results of AKT1 protein with geniposidic acid and SRC protein with chlorogenic acid

表3 成分与关键靶蛋白的分子对接结果Table 3 Binding result of components with its key targets
2.2.7 Q-Marker的分析
核心靶点HRAS为转化蛋白p21/H-Ras-1,是胃癌通路的靶点之一[8],PIK3R1是多个亚基组成的多聚体,多个研究均证实PIK3R1基因表达与恶性肿瘤疾病存在显著关联[9],AKT1是PI3K/Akt通路的核心蛋白,可促进成骨分化关键因子Runx2、Osx和OPN的表达,促进骨形成[10],另有研究表明,AKT1基因对海南黎族高血压性脑出血预警体系的构建具有重要价值[11],RAGE广泛存在于心肌细胞、内皮细胞中,可以促进血管的炎症因子释放,临床与冠心病等缺血性心脏疾病有关[12],Wang[13]研究证实了SRC在人肝癌组织中高表达,在肝癌的发生和发展中起到重要作用。核心靶点相应的作用,与杜仲不同部位Q-Marker降压、预防骨质疏松、护肝、调节血脂、抗肿瘤、抗炎、调节血脂等作用相关。
杜仲不同部位成分具有差异性,所对应的功效也有一定差异。例如木脂素类成分经过多年的实践研究证明是杜仲皮发挥降压作用的主要有效成分,杜仲叶中含量最高的绿原酸具有抗癌、消炎等作用,杜仲雄花中的主要成分黄酮类成分对冠心病、高血压等疾病有治疗作用等。结合HPLC结果,可将绿原酸、芦丁、京尼平苷作为杜仲叶潜在Q-Marker,将桃叶珊瑚苷、京尼平苷酸、松脂醇二葡萄糖苷作为杜仲皮潜在Q-Marker,将京尼平苷酸、京尼平苷、桃叶珊瑚苷作为杜仲雄花潜在Q-Marker,将绿原酸、京尼平苷酸、桃叶珊瑚苷作为杜仲果荚潜在Q-Marker。
3 讨论与结论
中药具有多成分、多靶点、整体性等特点,质量是保证其临床疗效的关键[14],但质量标准和质量控制研究依然是制约中医药产业发展的瓶颈问题。本研究以刘昌孝提出的Q-Marker理念为基础,结合实验结论及文献研究筛选出杜仲不同部位可能存在的Q-Marker化合物,并对筛选出的化合物进行网络药理学分析,结果表明这8个化合物可通过SRC、HRAS、PIK3R1、CDK1、CASP3、CCNB1等靶点作用于氮代谢、癌症通路、脂质和动脉粥样硬化、癌症蛋白聚糖、PI3K-Akt、卵巢类固醇生成等关键通路起作用,Huo等[15]研究发现杜仲叶中的总黄酮能显著降低高血脂大鼠血清中总胆固醇的含量,达到降低血脂的作用;同样有学者发现杜仲叶中的多糖能够明显降低动脉硬化指数和冠心指数及肝脏组织中总胆固醇、甘油三酯含量,从而发挥杜仲调节血脂作用[16];杜仲皮通过抑制PI3K/Akt通路来抑制骨关节炎的进展[17];Yuan等[18]发现杜仲叶总黄酮具有很强的体内抗肿瘤作用,与本研究结果一致。因此,所筛选出的桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷、芦丁、紫云英苷、槲皮素可作为杜仲不同部位的质量标志物。
杜仲皮作为临床常用的大宗中药材之一,在我国有两千多年的历史,具有较高的药用价值,杜仲化学成分较为复杂,药理作用广泛,且不同部位化学成分及药理作用具有差异性及相似性,现有相关研究大多局限于某一特定部位,割裂其整体性。杜仲的质量标准研究中缺少具有整体性成分的含量测定方法,有必要建立科学、全面的质量控制方法。本研究通过网络药理学和指纹图谱手段,预测杜仲中潜在的Q-Marker,可为全面建立杜仲质量评价方法及质量溯源体系提供较为可靠的理论依据,同时也作为含有杜仲的复方Q-Marker的筛选手段。

