太湖沉积物中厌氧铁氨氧化过程*
陈小锋,王润竹,陈 静,朱诗雅
(扬州大学环境科学与工程学院,扬州 225127)
近几十年来,水体富营养化已成为全球性的环境问题[1]。氮是组成生命的最基本的元素之一,同时也是造成水体富营养化的最主要的营养物质之一。反硝化或厌氧氨氧化(Anammox) 可以将水体中的氮素转化为N2逸出,因此被认为是水生态系统中氮素自净的最重要的两个途径[2]。然而,Anammox是自养型生物脱氮反应,较易发生于有机碳含量相对较低的区域,因此对于富营养化水体来说,反硝化可能才是最主要的脱氮途径[3]。

(1)
(2)
(3)
太湖,面积2239 km2,是我国的第三大淡水湖泊,具有饮用水源、蓄洪、工农业用水、航运等多重功能[11]。近几十年来,太湖富营养化日趋严重,并常年暴发蓝藻水华。研究表明,夏季太湖浮游植物处于氮限制状态,其原因可能是夏季太湖具有强大的氮素自净能力[12]。在此氮素自净过程中,除了常规反硝化和厌氧氨氧化以外,是否存在一些新的脱氮途径以及这些途径的脱氮潜力如何等尚不明确。
1 材料与方法
1.1 研究区域和样品采集
于蓝藻暴发期(2022年8月)布点采集沉积物样品(图1)。采样时间为下午14:00-16:00,天气晴,风力等级3级,采样时大量的蓝藻上浮并堆积在湖体表面。各采样点中,河口区(位点C)堆积了大量的蓝藻,梅梁湾区(位点B)湖面也有较多的蓝藻分布,而湖心区蓝藻密度则相对较低。使用彼得逊采泥斗采集湖泊表层沉积物样品,装入自封袋后置于保温箱中,低温下运回实验室后立即开展理化性质的检验和厌氧培养实验,剩余的沉积物样品置于4℃冰箱冷藏,用于测定细菌群落结构的样品则置于-70℃超低温冰箱中保存。
1.2 底物浓度对Feammox的影响
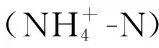
1.3 不同蓝藻暴发区域沉积物Feammox潜在速率测定

1.4 DNA提取和高通量测序
1.5 理化性质分析

1.6 数据分析
参照Li等[6]方法,估算太湖由Feammox导致的氮去除量,其公式为:
Nr=3.65×ρ×h×(1-W)×R
(4)
式中,Nr为氮去除量(t/(km2·a));ρ为太湖沉积物密度(g/cm3);h为发生Feammox反应的沉积物深度(cm);W为含水率(%);R为Feammox潜在速率(mg/(kg·d))。采用SPSS18.0软件进行相关性(Pearson)和单因素方差分析 (One-way ANOVA),P<0.05代表显著水平,P<0.01代表极显著水平。
2 结果与分析
2.1 太湖不同区域水体和沉积物理化性质
夏季是太湖蓝藻暴发季节,因此水体中叶绿素a浓度很高,其中河口区达到83.9 mg/m3,而湖心区也有47.7 mg/m3。受蓝藻光合作用的影响,3个位点的水体均有较高的溶解氧浓度,并且呈现弱碱性。3个位点的沉积物中有机质和铁元素的含量均比较高,其中梅梁湾中心位点的有机质浓度达到15.14 mg/L,河口区的总铁达23.7 g/kg, 而盐酸可提取Fe(Ⅱ)和Fe(Ⅲ)浓度达2.5、5.4 g/kg(DW)(表1)。

表1 太湖不同区域水体和沉积物理化性质Tab.1 Physiochemical properties of the water and sediments in different areas of Lake Taihu
2.2 底物浓度对太湖沉积物中Feammox过程的影响

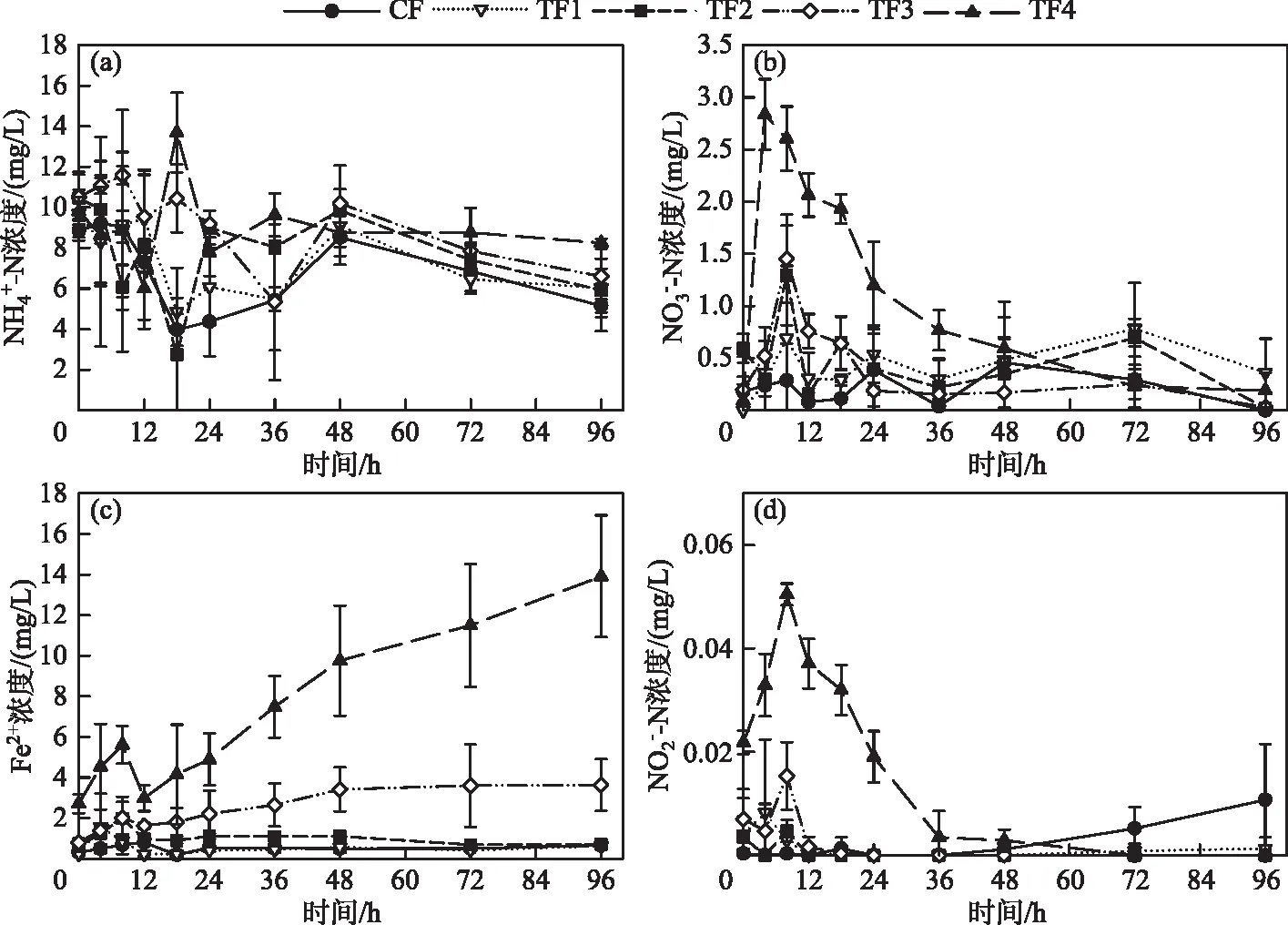
图2 不同Fe(Ⅲ)添加量的处理中的浓度变化(CF为对照组;TF1、TF2、TF3、TF4分别为添加2.8、5.6、8.4、14.0 mg Fe(Ⅲ)的处理)Fig.2 Variations of the concentrations of (b), Fe2+ (c) and (d) in the treatments with different Fe(Ⅲ) addition (CF represented control group; TF1, TF2, TF3 and TF4 were the treatments with the additions of 2.8, 5.6, 8.4 and 14.0 mg Fe(Ⅲ), respectively)

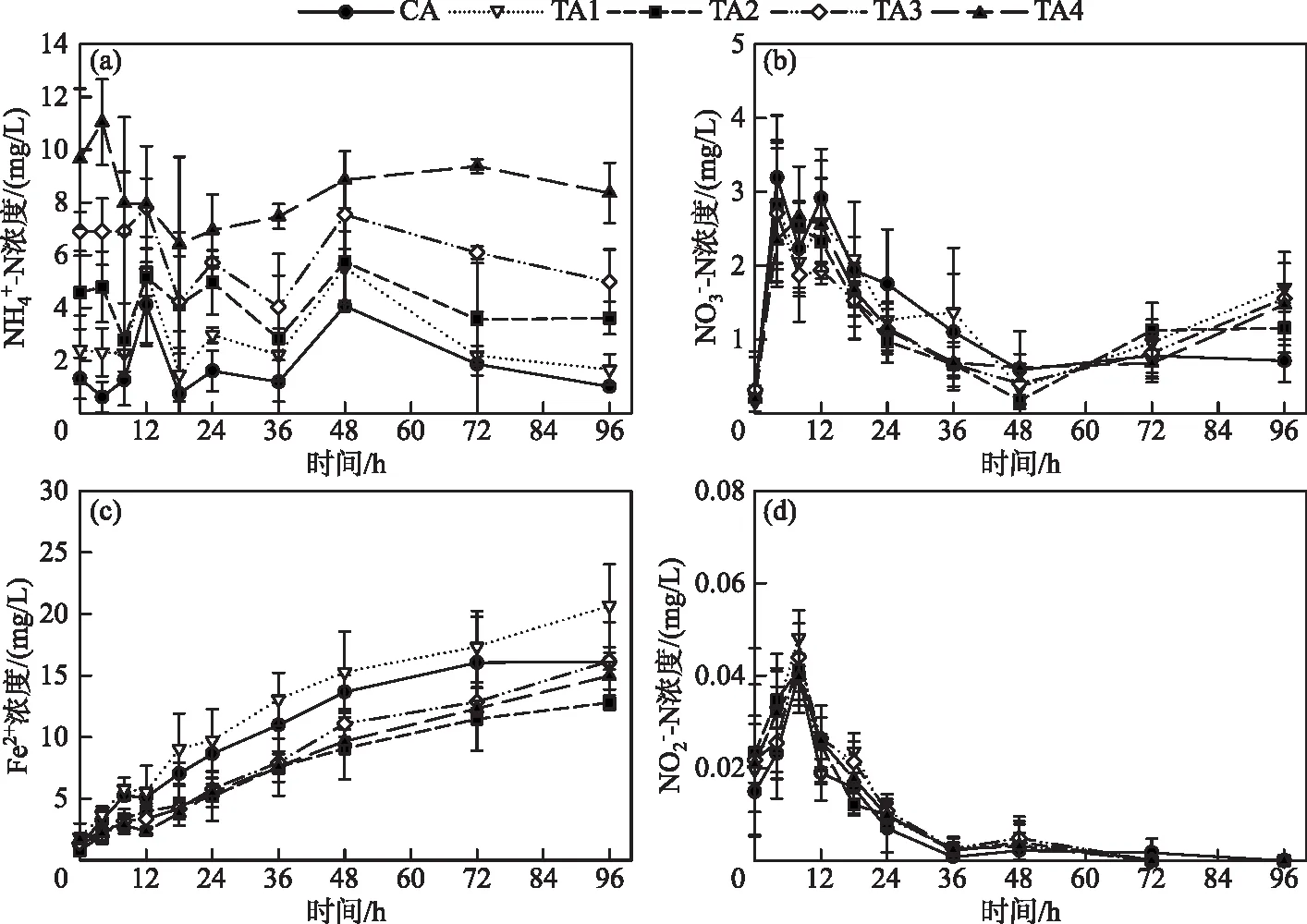
图3 不同添加量的处理中浓度的变化(CA为对照组;TA1、TA2、TA3、TA4分别为添加的处理)Fig.3 Variations of the concentration of (b), Fe2+ (c), (d) in the treatments with different addition (CA represented control group; TA1, TA2, TA3 and TA4 were the treatments with the additions of 0.14, 0.28, 0.42 and 0.7 mg respectively)
2.3 厌氧培养前后沉积物中的细菌群落结构变化
在属水平上,Thermodesulfovibrionia_norank是培养前沉积物中的优势属,其丰度达到8.7%~10.0%,其次是unculturedSutterellaceae(3.3%~4.1%)和unculturedSteroidobacteraceae(2.2%~3.7%),而在厌氧培养之后Symbiobacteraceae_uncultured成为优势属,其丰度达到15.0%~27.7%,其次是Thermodesulfovibrionia_norank(5.7%~7.4%)和Alicyclobacillus(3.3%~7.4%)(附图Ⅱ)。
针对大众化教育背景下研究生和导师关系中的不和谐状况,导师作为师生关系的主导者,应借助道德教育、实践教育、成才教育和情感教育构建师生和谐的伦理关系、教育关系和心理关系。“师贤方能生斐”[15],研究生导师只有在创新实践中不断完善自我、更新自我,才能以高尚的精神品质感染学生,以深厚的科学素养和高超的实践能力指导学生,以对学科前沿敏锐的自觉性和对知识创新的能动性启发和激励学生,以平等真挚的情感凝聚学生,从而在研究生大众化教育时代建立和谐的师生关系,成为知识更新、理念更新、育才更新的先导。
2.4 太湖不同区域沉积物Feammox潜在速率

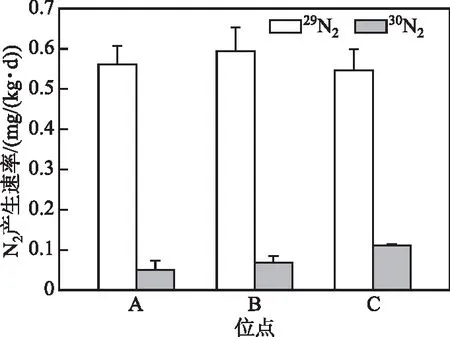
图4 同位素厌氧培养过程中30N2和29N2的产生速率(位点A、B和C分别为湖心区、梅梁湾中心和直湖港河口区)Fig.4 Production rates of 30N2 and 29N2 in the isotopic anaerobic culture (Sites A, B and C are the center of Lake Taihu, the center of Meiliang Bay and the estuary of Zhihugang, respectively)
3 讨论
3.1 厌氧培养条件下太湖沉积物中发生了Feammox反应
铁还原菌,如Exiguobacterium,Geobacter,Shewanella和Acidimicrobiaceae等[4,21],可以利用Fe(Ⅲ)为电子受体,氧化氨、乙酸盐、乳酸盐等电子供体并从中获取生命活动所需能量。尽管目前尚不能直接鉴别参与铁氨氧化进程的细菌,但铁还原菌可以影响铁氨氧化过程已得到证明,因此有学者认为这类细菌是介导Feammox过程的主要细菌[8]。厌氧培养结束后,沉积物中铁还原菌丰度从培养前的2.83%±0.36%上升至4.3%±1.77%(附图Ⅳ),这也从微生物学角度证明了培养过程中的确发生了Feammox反应。
3.2 底物浓度对Feammox的影响

3.3 Feammox对湖泊氮素自净的贡献
在浅水富营养化湖泊中,由于水生植物的光合作用和氧气在水-大气界面的充分交换,水体中的溶解氧在白天可能处于过饱和状态[28],此时沉积物中的氧气穿透深度可达到15 mm左右[29],进而有效促进了沉积物中有机氮的降解和Fe(Ⅱ)的氧化。藻华暴发过程中,夜间藻和其它微生物的呼吸作用会大大降低水体中的溶解氧水平,上覆水-沉积物界面2~6 mm深度以下已处于厌氧状态[30],这又为Feammox的进行营造了合适的环境条件[31]。铁被认为是除氮、磷外,影响蓝藻水华程度的最重要微量元素之一[32],因此一般而言,太湖、滇池、巢湖等蓝藻水华频发湖泊的沉积物中均含有较多的铁元素[33-34]。与之相对应,这些湖泊沉积物中也存在着较多的铁还原细菌,如巢湖中Thiobacillus、Desulfuromonas和Geobacter等铁还原菌相关属的相对丰度达到2.4%~ 6.7%[35],而本研究中,太湖沉积物中铁还原菌相对丰度也有2.83%±0.36%(附图Ⅳ),说明这些湖泊均具备发生Feammox反应的微生物基础[16]。充足的底物、适宜的环境条件和相关功能微生物的存在,表明Feammox反应同样可以在这些富营养化湖泊的实际环境中发生。

4 结论
1)Feammox反应可以在太湖不同区域沉积物中发生,其潜在速率可达到0.17~0.51 mg N/(kg·d);

4)Feammox可以促进反硝化功能菌属相对丰度的提高,形成Feammox和反硝化的耦合脱氮。
5 附录
附图Ⅰ~Ⅳ和附表Ⅰ~Ⅱ见电子版(DOI: 10.18307/2023.0521)。

